МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
УЧРЕЖДЕНИЕ ОБРАЗОВАНИЯ
«МОГИЛЕВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. А.А. КУЛЕШОВА»
ЗАДАЧНИК ПО ФИЗИЧЕСКОЙ ХИМИИ.
II ЗАКОН ТЕРМОДИНАМИКИ
Методическая разработка
МОГИЛЕВ 2012
СОДЕРЖАНИЕ
II ЗАКОН ТЕРМОДИНАМИКИ. ИЗМЕНЕНИЕ ЭНТРОПИИ………………………………………………..3
ХАРАКТЕРИСТИЧЕСКИЕ ФУНКЦИИ………………………………………………...41
ВАРИАНТЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ………………….54
СПИСОК ЛИТЕРАТУРЫ…………………………………55
I. II ЗАКОН ТЕРМОДИНАМИКИ. РАСЧЁТ ИЗМЕНЕНИЯ ЭНТРОПИИ
I.1. Основные уравнения
Взаимосвязь между теплотой и работой в процессе, осуществляемой по циклу Карно, описывается уравнением:
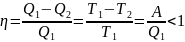 ,
,
Где
 -КПД
цикла;
-КПД
цикла;
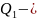 количество теплоты, сообщенное при
температуре
количество теплоты, сообщенное при
температуре
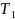 системе, совершающей данный цикл;
системе, совершающей данный цикл;
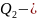 количество
теплоты, отданное системой при температуре
количество
теплоты, отданное системой при температуре
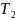 ;
А-работа, совершенная системой.
;
А-работа, совершенная системой.
1. Фазовые переходы вещества первого рода ( испарение, плавление, кипение и т.д. ) в изотермически обратимых условиях.
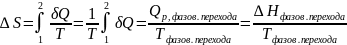
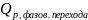 -
скрытая теплота фазового перехода,
-
скрытая теплота фазового перехода,
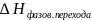 -
изменение энтальпии системы при данном
фазовом переходе, n-
количество вещества.
-
изменение энтальпии системы при данном
фазовом переходе, n-
количество вещества.
2. Нагревание или охлаждение любого вещества при постоянном давлении:
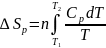 ,
,
поскольку
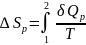 ,
то
,
то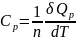 и
и
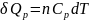
или постоянном объёме:
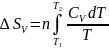 ,
,
поскольку
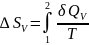 ,
то
,
то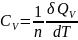 и
и
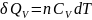 ,
,
где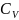 и
и
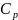 соответственно изохорная и изобарная
теплоёмкости, зависящие от температуры:
соответственно изохорная и изобарная
теплоёмкости, зависящие от температуры:
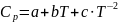 ,
,
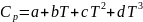 .
.
Если теплоёмкость не зависит от температуры в интервале от Т1 и Т2, то после интегрирования получаются конечные уравнения:
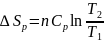 и
и

3. Изотермическое сжатие или расширение идеального газа:
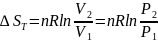
если изменяются и давление и, объём, то:
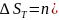 ln
ln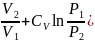 ;
;
4. Изохорный процесс в системе, состоящей из идеального газа:
,
если изменяются и температура, и давление, то:
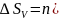 ln
ln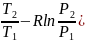 ;
;
5. Изобарный процесс в системе, состоящей из идеального газа:
,
если изменяются и температура, и давление, то:
ln ;
;
6. Изменение энтропии при адиабатическом расширении идеального газа:
 ;
;
7.Смешивание идеальных газов при постоянных температуре и давлении .
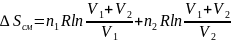 ;
;
8. Для химической реакции изменение энтропии:
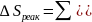 ,
,
где
 -
суммы абсолютных энтропий конечных и
начальных веществ:
-
суммы абсолютных энтропий конечных и
начальных веществ:
 .
.
9. Изменение энтропии
рабочей системы:
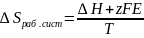 ,где
Е- э.д.с. электрохимического элемента,z-
заряд,F-
число Фарадея. Изменение энтропии
окружающей среды:
,где
Е- э.д.с. электрохимического элемента,z-
заряд,F-
число Фарадея. Изменение энтропии
окружающей среды:
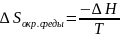 ,
чтобы определить направление процесса:
,
чтобы определить направление процесса:
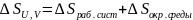 ;
теплота обратимого процесса:
;
теплота обратимого процесса:
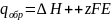
II. Характеристические функции
II.1. Основные уравнения
Основные свойства термодинамических потенциалов: энергия Гиббса G и энергия Гельмгольца А:
P, T=const,
-ΔG=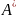 ,
,
V, T=const, -ΔA= ,
Где ΔG
и ΔA-
изменение энергий Гиббса и Гельмгольца
в каком-либо процессе;
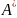 -полезная
работа. Энергии Гиббса и Гельмгольца
являются критериями направленности
самопроизвольного процесса и состоянии
процесса:
-полезная
работа. Энергии Гиббса и Гельмгольца
являются критериями направленности
самопроизвольного процесса и состоянии
процесса:
при
P
и T=constΔG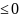 ,
,
при V и T=constΔA ,
ΔA=ΔU-TΔS,
ΔG=ΔH-TΔS,
Где ΔA, ΔU, ΔG, ΔS, ΔH-изменение соответствующих функций в любом физико-химическом процессе; при T=const
ΔG= ΔA+Δ(PV).
Для идеальных газов при Т=const
ΔG= ΔA+ΔnRT,
Где Δn-изменение числа молей газообразных веществ в ходе физико-химического процесса.
Изменения энергий Гиббса и Гельмгольца при нагревании(охлаждении) от T1 и T2 при постоянном давлении или объёме выражаются в дифференциальной форме уравнений:
(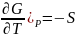 ,
,
(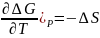 ,
,
(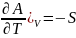 ,
,
(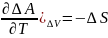 ,
,
и в интегральной форме:
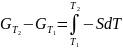 ;
;
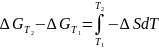 ;
;
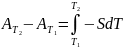 ;
;
 ;
;
В небольшом интервале
температур, если ,
то
,
то
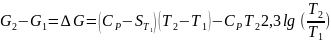 .
.
Изменения энергий Гиббса и Гельмгольца при сжатии или расширении, когда Т=const, выражаются в дифференциальной форме уравнениями:
(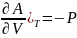 ,
,
(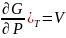 ,
,
(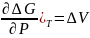 ,
,
где
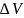 -
изменение объёма в ходе физико-химического
процесса; и в интегральной форме: для 1
моль идеальных газов
-
изменение объёма в ходе физико-химического
процесса; и в интегральной форме: для 1
моль идеальных газов
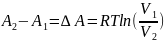 ,
,
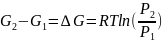 .
.
Для конденсированных систем при умеренных давлениях
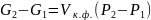
где
 –объём
конденсированной фазы; для химических
реакций (Т=const)
–объём
конденсированной фазы; для химических
реакций (Т=const)
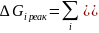
где
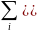 – суммы энергий Гиббса образования для
конечных продуктов и исходных веществ;
– суммы энергий Гиббса образования для
конечных продуктов и исходных веществ;
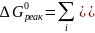
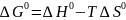 ,
,
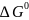 ,
,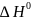 ,
,
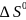 – изменение соответствующих функций
в стандартных состояниях при температуре
Т.
– изменение соответствующих функций
в стандартных состояниях при температуре
Т.
Изменение энергии Гиббса для фазовых переходов:
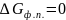 ,
,
для испарения и возгонки:
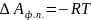 ,
,
для плавления и полиморфных превращений
Тема 1. II закон термодинамики. Изменение энтропии
1. Энтальпия плавления льда при 00С равна 6012 Дж/моль. Чему равна энтропия плавления льда? Найти энтропию льда при 00С, если энтропия воды при этой температуре равна 63,34 Дж/моль∙К.
Ответ: 41,33 Дж/моль∙К
2. Энтропия жидкого ацетона при температуре кипения 56,20С равна 213,31 Дж/моль∙К. Энтальпия испарения ацетона 29090 Дж/моль. Найти энтропию парообразного ацетона при температуре 56,20С и давлении 1 атм.
Ответ:
3. Диоксид углерода CO2 сублимирует при температуре -78,50С и давлении 1 атм. Энтальпия сублимации 25230 Дж/моль. Чему равна энтропия сублимации?
Ответ: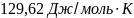
4.Серое олово при температуре 130С обратимо превращается в белое олова. Энтальпия превращения 20,92 Дж/моль. Чему равна энтропия превращения?
Ответ:
5.При температуре 95,50С и давлении 1 атм. Ромбическая сера обратимо превращается в моноклинную. Энтальпия превращения 450 Дж/моль. Чему равна энтропия моноклинной серы, если энтропия ромбической серы при этой температуре 36,73 Дж/моль∙К
Ответ: 1,22 Дж/моль∙К
6. Молярная энтропия водорода при 250С и 1 атм. Равна 130,62 Дж/моль∙К. Чему равна энтропия водорода при 1000С и 1 атм. , если теплоёмкость Ср(г)=28,85 Дж/моль∙К?
Ответ: 136,99 Дж/моль∙К
7.
Энтропия CO
при 25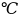 и 1атм. равна 197,55 Дж/моль∙К. Чему равна
энтропия CO
при 200
и 50 атм., предполагая, что CO
является идеальным газом?
и 1атм. равна 197,55 Дж/моль∙К. Чему равна
энтропия CO
при 200
и 50 атм., предполагая, что CO
является идеальным газом?
Ответ: 207,1 Дж/моль∙К
8.
Один моля кислорода расширяется до
десятикратного увеличения объёма и
одновременно охлаждается от 127 до 27 Чему равно изменение энтропии, если
теплоёмкость Ср(г)=29,2
Дж/моль∙К
Чему равно изменение энтропии, если
теплоёмкость Ср(г)=29,2
Дж/моль∙К
Ответ: 8,39 Дж/моль∙К
9. Энтропия NH3 при 25 и 1 атм. равна 192,66 Дж/моль∙К. Зависимость теплоёмкости Ср от температуры выражается уравнением: Ср(г)= 29,80+25,48∙10-3T-1,67∙105T-2 Дж/моль∙К. Чему равна энтропия аммиака при 500 и 10 атм.?
Ответ: 213,21 Дж/моль∙К
10. Найти изменение энтропии при переходе двух молей кислорода от объёма 30 л под давлением 3 атм. к объёму 15 л под давлением2 атм. Считать кислород идеальным газом.
Ответ: -23,49 Дж/моль∙К
11. Один моль идеального газа, занимающий объём 26 л, подвергается изотермическому расширению. Изменение энтропии 40 Дж/моль∙К. Каков конечный объём газа?
Ответ: 3191 л
12. 11,2 л азота нагревают от 0 до 100 и одновременно уменьшают давление от 1 до 0,01 атм. Найти изменение энтропии, считая азот идеальным газом.
Ответ: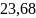 Дж/моль∙К
Дж/моль∙К
13. Один моль двухатомного идеального газа находится при 200 и 5 атм. В результате нагревания и сжатия газа температура стала 500 , давление равно 10 атм. Найти изменение энтропии газа.
Ответ: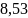 Дж/моль∙К
Дж/моль∙К
14.
При охлаждении 12 л кислорода от 200 до
-40 °С давление повышается от
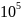 до 6,0
до 6,0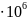 H/
H/ .
Рассчитать изменение энтропии, если
.
Рассчитать изменение энтропии, если
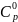 =
29,2 Дж/моль
=
29,2 Дж/моль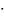 К
(считать кислород идеальным газом).
К
(считать кислород идеальным газом).
Ответ:
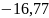 Дж/моль∙К
Дж/моль∙К
15. Определить изменение энтропии припревращении 2 г воды в пар при изменении температуры от 0 до 150°С и давлении Iат, если скрытая удельная теплота парообразования воды 2,255 кДж/г, мольная теплоемкость пара при постоянном давлении
Ср=30,13+11,3
103Т,
Дж/моль
К.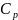 жидкой
воды 75,30 Дж/моль
К
жидкой
воды 75,30 Дж/моль
К
Ответ:
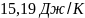
16.
Вычислить изменение энтропии при
нагревании одного моля CdS
от -120до
0°С, если зависимость мольной
теплоемкости от температуры выражается
уравнением Ср=54,0+3,8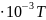 ,Дж/моль∙К
,Дж/моль∙К
Ответ:
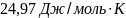
17. Найти изменение энтропии при нагревании 1 моля кадмия от 25 до 7270С, если температура плавления 3210С и энтальпия плавления 6109 Дж/моль. Теплоёмкость кристаллического и жидкого кадмия Ср(кр)=22,22+0,0123T Дж/моль∙К, Ср(ж)=29,83 Дж/моль∙К
Ответ: 44,78 Дж/моль∙К
18.
Энтропия кристаллического хлорида
натрия равна 72,13 Дж/моль∙К при Т=298,15 К
и Р=1 атм. Найти энтропию расплавленной
соли при температуре 850
,
если температура плавления 800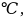 а
энтальпия плавления 31,0 Дж/моль∙К.
Теплоёмкость NaCl
в твёрдом и жидком состоянии равна:
а
энтальпия плавления 31,0 Дж/моль∙К.
Теплоёмкость NaCl
в твёрдом и жидком состоянии равна:
Ср(кр)= 49,94+16,32∙10-3T Дж/моль∙К
Ср(ж)=66,53 Дж/моль∙К
Ответ: 175,53 Дж/моль∙К
19. Вычислите изменение энтропии при нагревании 1 моля твёрдого брома от температуры плавления -7,32 до 100 , если энтальпия плавления 10544 Дж/моль, энтальпия испарения 30710 Дж/моль, температура кипения 59 . Теплоёмкость брома в жидком и парообразном состоянии равна:
Ср(ж)= 75,71 Дж/моль∙К
Ср(г)= 37,20+0,71∙10-3T-1,19∙105T-2Дж/моль∙К
Ответ: 113,51 Дж/моль∙К
20. Энтропия жидкого бензола при 25 и 1 атм. равна 173,26 Дж/моль∙К. Найти энтропию газообразного бензола при 500 и 1 атм. , если энтальпия испарения бензола при температуре кипения 80,1 равна 30752 Дж/моль. Теплоёмкость жидкого и газообразного бензола выражается уравнениями:
Ср(ж)= 59,50+255,0 ∙10-3T Дж/моль∙К
Ср(г)= -21,09+400,1∙10-3T-169,9∙10-6T-2 Дж/моль∙К
Ответ: 395,752 Дж/моль∙ К
21.Вычислить
изменение энтропии системы и окружающей
среды при изотермическом затвердевании
1 моля меди, переохлаждённой ниже
температуры плавления на 180 градусов.
Температура плавления меди 1356 К, энтальпия
плавления Δпл.H1356
K=12970
Дж/моль. Теплоёмкость твердой и жидкой
меди: Ср=22.64+6,28∙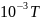 ,
Дж/моль∙ К
,
Дж/моль∙ К
Ср= 31,38 Дж/моль∙ К
Ответ: 1,46 Дж/моль∙ К
22. Рассчитать разность между мольными энтропиями твёрдой и жидкой ртути при температуре -50 . Температура плавления ртути -39 , энтальпия плавления при этой температуре 2340 Дж/моль. Теплоёмкость жидкой и твёрдой ртути равна: Ср(кр)=29,71+6,69∙ , Дж/моль∙ К
Ср(ж)= 26,9 Дж/моль∙ К
Ответ: -10,20 Дж/моль∙ К
23. Два сосуда объёмом 1 л каждый соединены трубкой с краном. В одном находится водород при 1 атм. и 20 , в другом – гелий при 3 атм. и 100 . Найти изменение энтропии системы после открытия крана и достижения равновесной температуры, если стенки сосудов и трубки теплоизолированные от окружающей среды, Газы считать идеальными.
Ответ: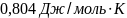
24. Вычислите изменение энтропии при плавлении 5 молейбензола, если температура плавления бензола равна 278.68 К, а теплота плавления 2,351 ккал/моль.
Ответ: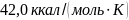
25. Определите изменение энтропии при превращении 2 гводы в пар при изменении температуры от 0 до 100 и давлении 1 атм., если скрытая удельная теплота парообразования воды равна 2,255 кДж/г.Мольнаяизобарическая теплоемкость жидкой воды в рассматриваемом температурном интервале постоянна и равна 75,30Дж/(моль К).
Ответ: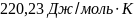
26. Определите изменение энтропии при нагреве Iмоля Аlот 25 до 600 , если для него в этом интервале теплоёмкость зависит от температуры следующим образом: Ср = 20,945 + 0,010728Т. (Дж/(моль К)).
Ответ:
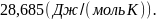
27. Определите изменение энтропии при плавлении меди массой 63,5 г, если теплота плавления меди равна 12980 Дж/моль.а температура плавления меди 1083 °С.
Ответ: 9,57 Дж
28. Вычислите изменение энтропии при плавлении свинца массой 100 г, если температура плавления свинца 327,4 °С, а теплота плавления 5485 Дж/моль.
Ответ:
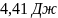
29. В двух сосудах одинаковой вместимости находится: в первом - азот массой 2,8 г, во втором аргон массой 4 г. Определите изменение энтропии при диффузии, возникающей в результате соединения сосудов с газами. Температура и давление постоянны.
Ответ: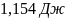
30. Найдите изменение энтропии в процессе обратимого изотермического сжатия 1 моля кислорода от 1,013 105до 10,13 105Па.
Ответ:
31. Вода массой 100 г при 25 °С превращена в пар с температурой 150 °С и давлением 1,013 105 Па. Вычислите изменение энтропии этого перехода, если удельная теплота испарения воды при 100 равна 2257 Дж/ г, удельная теплоемкость воды - 4,187 Дж/(г К), а удельная теплоемкость водяного пара при давлении 1,013 105 Па равна 1,968 Дж/(г К).
Ответ: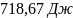
32. Найдите изменение энтропии при переходе 3 молей кислорода от объема 0,0336 м3 под давлением 2,026 105 Па к объему 0,0672 м3 под давлением 1,013 105 Па. Молярная теплоемкость кислорода Ср равна 29,37 Дж/(моль К), температура постоянна.
Ответ: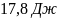
33. Определите разность энтропии 1г воды при 0 и 100 (давление нормальное), считая теплоемкость воды постоянной и равной 4,19 Дж/(г К).
Ответ: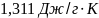
34. Определите изменение энтропии при охлаждении 5 молей алюминия от 0 до -100 °С. Средняя массовая
теплоемкость алюминия в указанном интервале температур 0,8129 Дж/(г К).
Ответ: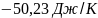
35. Чему равно изменение энтропии 1 моля нафталина при нагревании от 0 до 80,4 °С (температура плавления), если теплота плавления 149,6 Дж/г, а средняя массовая теплоемкость кристаллического нафталина 1,315 Дж/(г К).
Ответ: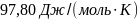
36. Рассчитайте суммарное изменение энтропии при нагревании 1 моля бензола от температуры плавления (5,49 °С) до полного испарения при температуре кипения (80,2 °С). Теплота плавления бензола 126,54 Дж/г, теплота парообразования 396 Дж/г, массовая теплоемкость бензола 1,94 Дж/(г К).
Ответ: 159,2Дж/(моль К)
37.В 0,30 кг жидкого ацетона поместили серебряную ложку массой 53 г. Определите энтропию системы при 25 .
Ответ:
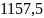 Дж/К
Дж/К
38.Вычислите
изменение энтропии в процессе затвердения
1 моль переохлажденного бензола при 268
К, если при 278 К
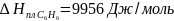 ,
,
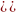 ,
,
,
P=const=1,01∙
,
,
,
P=const=1,01∙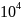 Па
Па
Ответ: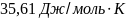
39.Вычислить энтропию хлорид серебра при 870 К.
Ответ: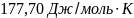
40.В одном из сосудов одинаковой вместимости 3 м3 находится 28 кг азота, а в другом 32 кг кислорода при одной и той же температуре. Вычислите изменение энтропии при диффузии в результате соприкосновения содержимого этих сосудов. Принять кислород и азот идеальными газами.
Ответ:
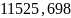 Дж/моль
Дж/моль
41. Определите ΔS для изобарического нагревания 1 моля азота от 300 до 10000 К. Ср = 6,4492 + 1,4125 · 10-3 Т – 0,807 · 10-7 Т2.
Ответ: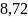 кал·0К-1·моль-1.
кал·0К-1·моль-1.
42.Нормальная
температура кипения бензола равно
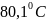 .
Оцените мольную теплоту испарения
бензола при этой температуре.
.
Оцените мольную теплоту испарения
бензола при этой температуре.
Ответ:
7400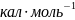
43.Найти изменение энтропии при превращении двух молей льда, взятых при О°С р = 1 атм, в пар при 200 °С и 3 атм. Теплота плавления льда равна 332,2 Дж∙г-1, теплота парообразования при 100 °С равна 2259 Дж∙г-1. Удельная теплоемкость пара равна 1,87 Дж∙г-1 ∙К-1, воды - 4,184 Дж∙г-1 ∙К-1 .
Ответ: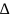 S=
306,32 Дж∙К-1.
S=
306,32 Дж∙К-1.
44. В одном из сосудов емкостью 0,1м3 находится кислород, в другом емкостью 0.4 м3 .В обоих сосудах температура 17е С и давление 1,013∙105н/м2.Найти изменение энтропии при взаимной диффузии газов из одного сосуда в другой при Р и Т=const. Считать оба газа идеальными.
Ответ: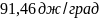
45.Вычислить
изменение энтропии в
процессе
изотермного расширения 2 моль
метана от
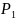 =101,3∙
=101,3∙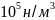 до
до
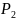 =1,013∙
Газ
считать идеальным.
=1,013∙
Газ
считать идеальным.
Ответ: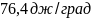
46.Рассчитать мольную энтропию окиси углерода при 200° С и 50,67∙105н/м2, если энтропия при 25° С и1,013∙105н/м2равна 197,9 дж/град∙моль, а зависимость мольной теплоемкости от температуры выражается уравнением
СР = 28,41+4,10∙10-3T — 0,46∙105T2дж/моль∙град.
Ответ: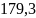 Дж/моль∙К
Дж/моль∙К
47.Найти изменение энтропии при нагревании Iг∙атомкадмия от 25 до 727°С, если температура плавления 321°С и теплота плавления равна 6109 дж/г∙атом
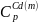 =
22,22+ 12,30∙
=
22,22+ 12,30∙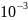 Tдж/моль∙град;
Tдж/моль∙град;
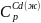 =
= 29,83 дж/моль∙град.
=
= 29,83 дж/моль∙град.
Ответ:44,78 Дж/моль∙К
48.Какому конечному объему отвечает изменение энтропии, равное 38,28 дж/моль∙град, если 1 мольидеального газа, занимающий в данных условиях 0,02м3,изотермически расширяется.
Ответ: 2 м3
49.Насколько изменится энтропия в процессе изотермического расширения
10 гкриптона от объема 0,05 м3 и давления 1,013∙105н/м2 до объема 0,2 м3 и давления 0,2133∙105н/м2?.
Ответ: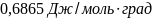
50.Найти изменение энтропии при изотермическом сжатии 1 моль паров бензола при 80°С от 0,4053∙105 до 1,013∙105н/м2с последующей конденсацией в охлаждением жидкого бензола до 60°С. Нормальная температура кипения бензола 80°С; мольная теплота испарения бензола 30,88 кдж/моль;удельная теплоемкость жидкого бензола 1,799 дж/г∙град.
Ответ: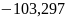 Дж/моль∙град
Дж/моль∙град
51.Определить
изменение энтропии в процессе сжижения
1 мольметана,
если начальная температура равна 25°С,
а конечная 111,8° К. Мольная теплота
испарения метана при 111,8° К равна 8234,0
дж/мольи
мольная теплоемкость
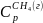 =35,79
дж/моль∙град.Вычислить
работу сжижения метана, приняв к. п.
д. равным 10%.
=35,79
дж/моль∙град.Вычислить
работу сжижения метана, приняв к. п.
д. равным 10%.
Ответ:-108,75; -143,11
52.Рассчитать
изменение энтропии 1 мольбензола
при переходе из жидкого состояния при
25°С в пар при 100°С, если теплота испарения
бензола 393,3 дж/г
и температура кипения бензола 80,2°С,
мольная теплоемкость жидкого бензола
равна Ср(ж)
= 136,1 дж/моль∙град,а
мольная теплоемкость паров бензолаСр(г)
= - 33,90 + 471,87∙
-298,34∙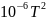 + 70,84∙
+ 70,84∙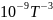 дж/моль∙град.
дж/моль∙град.
Ответ: 107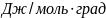
53.Вычислить возрастание энтропии 1 мольброма Вr2. взятого при температуре плавления —7,32°С, и переходе его из твердого состояния в пар при температуре кипения 61,55°С; мольная теплоемкость жидкого брома
Ср(ж) = 0,4477 дж/г∙град;теплота плавления 67,72 дж/г;теплота испарения 182,8 дж/г.
Ответ:
54. Определить увеличение энтропии 1 моля кристаллического магния при нагревании от 300 до 800 К при постоянном давлении, если теплоёмкость магния равна Ср(кр)= 22,3+10,64∙10-3T-0,42∙105T-2, Дж/моль∙К
Ответ: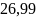 Дж/моль∙К
Дж/моль∙К
55. Определить увеличение энтропии 1 моля азота при нагревании от 25 до 10000С: а) при постоянном давлении; б) при постоянном объёме. Зависимость теплоёмкости от температуры выражается уравнением Ср=27,88+4,27∙10-3T Дж/моль∙К
Ответ: 44,64 Дж/моль∙К; 32,56 Дж/моль∙К
56. Как изменится энтропия 1 моля гелия при нагревании его от 20 до 70 °С, если объем газа при этом изменится от 24 до 28,1 л?
Ответ:
57. Средняя массовая теплоемкость железа в пределах температур 0 - 200 °С равна 0.486 Дж/(г К). Определите изменение энтропии при нагревании 1 кг железа oт 100 до 150 °С.
Ответ: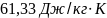
58. Вычислите изменение энтропии при нагревании 1 кг свинца от температуры его плавления (327,4 °С) до 800 . Теплота плавления свинца 24,8 кДж/кг, а теплоемкость жидкого свинца в интервале температур 327 - 1000°Сравна 0,1415 кДж/(кг К).
Ответ: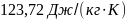
59. Вычислите изменение энтропии при нагревании 16кг О2 от 273 до 373К:
1) при постоянном объёме;
2) при постоянном давлении.
Считать кислород идеальным газом
Ответ: 3243,6; 4539,4 Дж/К.
60. Рассчитайте изменение энтропии при нагревании 58,82 кг В2О3 от 298 до 700К, теплоемкость В2О3 Ср0=36,5525+106,345*10-3Т Дж/(моль*К).
Ответ: 62153,7 Дж/К.
61. Бромбензол кипит при 429,8К, его теплота парообразования при этой температуре 241,9∙103 Дж/кг. Рассчитайте изменение энтропии при испарении 10 кг бромбензола.
Ответ: 6993,4 (Дж/К)
62. Вычислите изменение энтропии при охлаждении 12∙10-3 кг (12 г) кислорода от 290 до 233К и одновременном повышении давления от 1,01∙105 до 60,6∙105 Па, если Ср=32,9 Дж/(моль∙К).
Ответ: 47,81 Дж/(моль∙К).
63. Рассчитать изменение энтропии в процессе нагревания 1 моля ртути от -77°С до 25 °С. Теплота плавления ртути при t = -38,9 °С равна 11,58 Дж г-1; удельная теплоемкость твердой ртути Ст = 0,138 Дж г-1 К-1, жидкой ртути
Сж = 0,140 - 2,86 10 -6Т Дж г-1 К-1 .Атомный вес ртути равен 200,6.
Ответ: S = 21,56 Дж моль-1 К-1.
64.Определить изменение энтропии, если 0,0112 м3 азота нагреваются от 0 до 50°С. Одновременно давление уменьшается от 1,013∙105 до 1,013∙103н/м2. Теплоемкость равна 29,29 дж/моль∙град.
Ответ: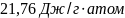
65.Как
изменится энтропия при нагревании 1
мольхлорида
натрия от 25°С до 1073° К, если температура
его плавления 800°С, удельная теплота
плавления 516,7 дж/г.
Мольная
теплоемкость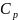 (т)
= 45,96+ 16,32∙
дж/моль∙град.
(т)
= 45,96+ 16,32∙
дж/моль∙град.
Ответ: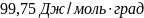
66.Найти изменение энтропии при нагревании 1 мольацетона от 25 до 100°С, если удельная теплоту испарения ацетона равна 514,6 дж/г,температура кипения равна 56°С, мольные теплоемкости жидкого ацетона
СР(ж)=
125 дж/моль∙град,
паров ацетона
Ср(г) = 22,47 + 201,8∙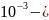 63,5∙
дж/моль∙град.
63,5∙
дж/моль∙град.
Ответ: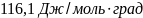
67.Рассчитать изменение энтропии при нагревании 2 мольметанола от 25 до 100°С, если удельная теплота испарения СН3ОН 1100,4 дж/г,температура кипения 64,7° С, мольные теплоемкости жидкого метанола СР(ж) = 81,56 дж/моль∙гради паров метанола
СР(г)= 15,28+ 105,2∙10 -3T—31,04∙ дж/моль∙град.
Ответ: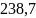 дж/моль∙град.
дж/моль∙град.
68.Определить
изменение энтропии при нагревании 1
мольэтанола
от 25 до 100°С, если удельная теплота
испарения С2Н5ОН
863,6 дж/г,температура
кипения 78,3°С, мольные теплоемкости
жидкого этанолаСР(ж)=
111,4 дж/моль∙град,и
паров этанолаСр(г)= 19,07 + 212,7∙10-3T-108,6∙10-6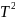 + 21,9∙
+ 21,9∙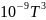 дж/моль∙град.
дж/моль∙град.
Ответ: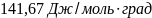
69.Найти
изменение энтропии при нагревании 1
мольтолуола
от 25 до 150°С, если удельная теплота
испарения толуола 347,3 дж/г,
температура
кипения 110,6°С, мольные теплоемкости
жидкого толуола СР(ж)
= 166 дж/моль∙гради
паров толуола СР(г)
= - 33,88 +557,0∙10-3T-342,4∙10-6
+79,87∙10-9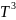 дж/моль∙град.
дж/моль∙град.
Ответ: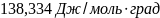
70. Как изменится энтропия при нагревании Iмольмоноклинной серы от 25 до 200°С, если удельная теплота плавления моноклинной серы 45,19 дж/г,температура плавления 119,3°С, мольные теплоемкости жидкой серы
СР(ж) = 35,73 +1,17∙ — 3,305 • 105 дж/моль∙гради твердой серы
СР(т) = 23,64 дж/моль∙град.
Ответ: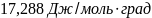
71.Определить изменение энтропии 1 мольхлорида натрия при нагревании от 20 до 850° С, если известно, что мольная теплоемкость твердого хлорида натрия составляетСр(т) = 45,94+ 16,32∙10-3Tдж/моль∙градидля жидкого соединенияСР(ж) = 66,53 дж/моль∙град;теплота плавления 31,0 кдж/моль; температура плавления 800° С.
Ответ: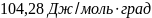
72. Рассчитать прирост энтропии при смешении 250 см3 азота с 500 см3 кислорода при 1067 гПа и 27 . Чему равнялась бы работа при обратном смешении газов?
Ответ: 0,17 Дж/моль
73. Вычислить изменение энтропии при смешении 10 л водорода с 5 л метана, если исходные газы и образующаяся смесь газов находятся при 25 и 100 гПа.
Ответ: 0,32 Дж/моль
74. Вычислить изменение энтропии при разделения 1 моль воздуха при 1 атм. на чистые кислород и азот. Принять, что в воздухе 21% об. Кислорода и 79% об.азота.
Ответ: -4,27 Дж/моль∙ К
75.Рассчитайте изменение энтропии при смешивании 1 моля водорода с 1 молем азота при н.у.
Ответ:
76.
В двух сообщающихся сосудах, разделенных
перегородкой, находится 1 моль азота и
2 моль кислорода. Перегородку вынимают,
газы смешиваются. Рассчитайте изменение
энтропии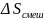 ,
если исходные температуры и давления
одинаковы, а объёмы различны;
,
если исходные температуры и давления
одинаковы, а объёмы различны;
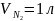 ;
;
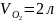 .Конечное
давление смеси равно исходному давлению
газа.
.Конечное
давление смеси равно исходному давлению
газа.
Ответ:
77.Смешали
1 моль аргона, взятого при
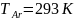 ,
с 2 моль азота, взятого при
,
с 2 моль азота, взятого при
 .
Исходные давления компонентов и конечное
давление смеси одинаковы. Вычислите
температурную составляющую энтропии
смешения. Теплоёмкость аргона
.
Исходные давления компонентов и конечное
давление смеси одинаковы. Вычислите
температурную составляющую энтропии
смешения. Теплоёмкость аргона
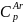 =20,8
Дж/моль
=20,8
Дж/моль и азота
и азота
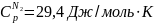
Ответ: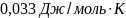
78. Рассчитайте изменение энтропии в процессе смешения 5 кг воды Т1=353К с 10 кг воды при Т2=290К. теплоемкость воды считать постоянной и равной 4,2 Дж/(моль∙К).
Ответ: 15,3 Дж/(моль∙К).
79.
Определите изменение энтропии при
смешении 1 моль аргона, взятого при TAr
= 293 К и
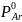 =
1,0133 • 105
Па с 2 моль азота, находящегося при
=
1,0133 • 105
Па с 2 моль азота, находящегося при
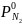 =
1,0133
105
Па и
=
1,0133
105
Па и
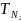 =
323 К. Давление смеси равно Рсм
= 1,0133∙105
Па. Принять аргон и азот идеальными
газами, а теплоемкость каждого газа
— величиной, постоянной в указанном
интервале температур и равной для азота
Сv=
20,935 Дж/(моль∙К), для аргона Сv=
12,561 Дж/(моль∙К).
=
323 К. Давление смеси равно Рсм
= 1,0133∙105
Па. Принять аргон и азот идеальными
газами, а теплоемкость каждого газа
— величиной, постоянной в указанном
интервале температур и равной для азота
Сv=
20,935 Дж/(моль∙К), для аргона Сv=
12,561 Дж/(моль∙К).
Ответ: 15,341 Дж/моль
80.Определить
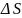 для
смешивания 1 моля азота с 3 молями
кислорода при
для
смешивания 1 моля азота с 3 молями
кислорода при
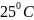 и общем конечном давлении 1 атм. Начальное
давление каждого газа 1 атм.
и общем конечном давлении 1 атм. Начальное
давление каждого газа 1 атм.
Ответ:
81.Найти изменение энтропии при расширении 2 молей водорода, которые при давлении 2 атм занимают объем 30 л, до давления 1 атм и объема 100 л. Изобарная теплоемкость водорода Ср при этих условиях равна 29,3 Дж∙моль1∙К-1.
Ответ:ΔS = 41,74 Дж∙К-1
82.2 моля N2 и 1 моль O2, находящиеся при 27 °С и 1 атм, смешиваются. После этого газовая смесь нагревается до 827 °С и сжимается до 5 атм. Найти изменение энтропии системы, если средние мольные теплоемкости (Сp) N2 и 02 равны, соответственно, 29,58 и 32,97 Дж∙моль-1∙К-1.
Ответ:ΔS = 95,40 Дж ∙К-1
83.Вычислить изменение энтропии при смешении 0,0001 м3кислорода с 0,0004 м3азота при постоянной температуре 17° С и давлении 1,013∙105н/м2.
Ответ: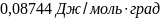
84. Смешаны 0,002 м3 гелия и 0,002 м3 аргона при 27°С и 1,013∙105н/м2каждый. После изотермного смешения полученная газовая смесь нагрета до 327°С при постоянном объеме. Вычислить общее возрастание энтропии, учитывая, что мольная теплоемкость обоих газов одинакова и равна
Cv(г)= 12,55 дж/моль∙град.
Ответ: 2,3
85.Вычислить изменение энтропии при разделении Iмольвоздуха при 1,013∙105н/м2на чистые кислород и азот (принять состав воздуха 21 об. % кислорода и 79 об. % азота).
Ответ: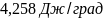
86.Рассчитать энтропию реакции 2H2(г)+CO(г)→CH3OH(г) при температурах 298,15 и 1000К, используя абсолютные энтропии соединений при Т=298,15 и р=1атм.:S0сн3OH=239,76 Дж/моль∙ К, S0H2=130,52 Дж/моль∙ К, S0СО=197,55 Дж/моль∙ К.
Зависимость теплоёмкости от температры выражается уравнениями:
Ср(CH3OH)=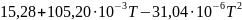 Дж/моль
Дж/моль
Ср(H2)=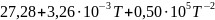 Дж/моль
Дж/моль
Ср(CO)=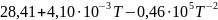 Дж/моль
Дж/моль
Ответ: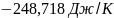 ;
-218,83 Дж/ К
;
-218,83 Дж/ К
87. Рассчитайте энтропию реакции CaCO3(кр)→CaO(кр)+CO2(г) при температурах 298,15 и 1200 К, используя абсолютные энтропии соединений при Т=298,15 и р=1атм.:S0CaO=38,07 Дж/моль∙К, S0CO2=213,66 Дж/моль∙К, S0CaCO3=91,71 Дж/моль∙К. Зависимость теплоёмкости соединений от температуры следующая:
Ср(CaO)=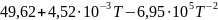 Дж/моль
Дж/моль
Ср(CO2)=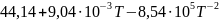 Дж/моль
Дж/моль
Ср(CaCO3)=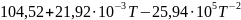 Дж/моль
Дж/моль
Ответ: 160,02Дж/К;
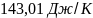
88. Рассчитать
энтропию реакции 2NaHCO3(кр)→Na2CO3(кр)+H2O(г)+CO2(г)
при температурах 298,15 и 500К на основании
абсолютных энтропий веществ при Т=298,15К
и р=1атм.:S0Na2CO3=138,80
Дж/моль∙К, S0H2O=188,72
Дж/моль∙К, S0CO2=213,66
Дж/моль∙К, S0NaHCO3=102,10
Дж/моль∙К. Теплоёкость участников
реакции равна: Ср(Na2CO3)=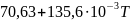 Дж/моль
Дж/моль
Ср(H2O)=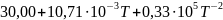 Дж/моль
Дж/моль
Ср(CO2)= Дж/моль
Ср(NaHCO3)=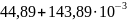 T
Дж/моль
T
Дж/моль
Ответ: 336,98Дж/К;
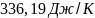
89. Энтальпия плавления льда при 0 равна -6013 Дж/моль. Теплоёмкость Ср льда и воды соответственно равна 37,24 и 75,30 Дж/моль∙ К. Найти изменение энтальпии и энтропии для процесса:
H 2O
(ж; -10
;
1 атм.) H2O
(кр; -10
;
1 атм.)
2O
(ж; -10
;
1 атм.) H2O
(кр; -10
;
1 атм.)
Ответ: -20,59 Дж/моль∙ К; -5632
90. Вычислите изменение энтропии для реакции С2Н2+ 2Н2 = C2H6в стандартных условиях при температуре 298 К.
Ответ: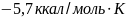
91. Вычислите изменение энтропии S° при стандартных условиях для реакций:
2H2S+S02=2H2O(ж) + 3S;
Zn + H2S04 = ZnS04 + Н2;
СН4 + 202 = СО2 + 2Н20(пар)
Ответ: (-423,82; 56,71; -5,17 (Дж/К)
92. Вычислите изменение энтропии S° при стандартных условиях для реакций:
2С2Н5С1 + 2Na = С4Н10 + 2NaCI,
2CH3OH = CH3-O-CH3+ Н20(ж),
С2Н5ОН + СНзСООН = Н3СООС2Н5 + Н20(ж).
Ответ: (-197,72; 8,40 (Дж/К))
93.
Газообразные водород и хлор при 25
поступают в реактор синтеза хлороводорода,
где взаимодействуют при 725
по реакции:
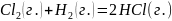 .
Определите изменение энтропии системы,
начиная с момента поступления газов в
реактор, если их объёмный расход одинаков.
.
Определите изменение энтропии системы,
начиная с момента поступления газов в
реактор, если их объёмный расход одинаков.
Ответ:
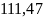 Дж/К
Дж/К
94. Определите изменение энтропии для реакции
Cd+2AgCl=CdCl2+2Ag
Если проводить её
в гальваническом элементе при 1,0133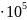 Па и 298,2 К, ЭДС элемента компенсируется
приложенной извне и равной 0,6753 В.
Стандартные теплоты образования хлоридов
кадмия и серебра соответственно равны
-389,0 и -126,8 кДж/моль
Па и 298,2 К, ЭДС элемента компенсируется
приложенной извне и равной 0,6753 В.
Стандартные теплоты образования хлоридов
кадмия и серебра соответственно равны
-389,0 и -126,8 кДж/моль
Ответ:
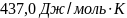
95. Определите стандартное изменение энтропии при 298 К для следующих реакций:
MgO+H2=H2Oж+ Mg (1)
C+CO2=2CO (2)
2SO2+O2=2SO3 (3)
FeO + CO=Fe+CO2 (4)
Ответ: -54,96Дж/моль∙К; 23,45 Дж/моль∙К; -140,45 Дж/моль∙К; -17,39 Дж/моль∙К
96. Определите стандартное изменение энтропии при 298К для следующих реакций:
MgO+ Н2 = Н2О(ж) +Mg (1)
C + CО2= 2CO (2)
2SО2 + О2 = 2 SО3 (3)
FeO+CO=Fe +CО2 (4)
Ответ: -54,64; 181,4; -16,4; -17,46 Дж/(моль∙К).
97. Идеальная тепловая машина, работающая по циклу Карно, совершает за один цикл работу 80 кДж. Температура термостатов соответственно равна 100 и 00С. Найти : а) количество теплоты, получаемым рабочим телом за один цикл от нагревателя; б) количество теплоты, передаваемое за каждый цикл холодильнику; в) КПД цикла.
Ответ:298,4 кДж; 218,4 кДж; 0,2681
98.Идеальная тепловая машина работает по циклу Карно. Определить КПД цикла, если известно, что за один цикл произведена работа 5 кДж и холодильнику передано 25 кДж тепла.
Ответ: 0,167
99.Идеальная холодильная машина Карно передаёт тепло от холодильника с водой при 00С к холодильнику при 1000С. Какое количество воды надо заморозить в холодильнике, чтобы превратить в пар 3 кг воды в кипятильнике? Энтальпия плавления льда и испарения воды соответственно равны 6,02 и 40,30 кДж/моль.
Ответ: 14699,2 г.
100. Тепловой насос (холодильная машина) работает обратимо между 00С и температурой t. Она потребляет энергию 1000 Дж и отдаёт в окружающую среду 10 000 Дж. Чему равна температура t ? Определить теплоту, которую отнимает холодильная машина от охлаждаемого тела при температуре 00С.
Ответ: 303,5 К; 9000 Дж
101.Холодильная машина по производству льда работает между температурами 0 и 250С. Она замораживает воду. Взятую при 00С. За 8 часов работы было получено 100 кг льда и при этом в окружающую среду при 250С выделилось 40 000 кДж. Какое количество электроэнергии необходимо для работы холодильной машины? Сколько электроэнергии понадобилось бы для работы идеальной холодильной машины для получения такого же количества льда? Энтальпия плавления льда 6013 Дж/моль.
Ответ: 3059,1 кДж; 40000 кДж
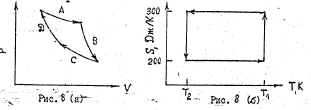
102. На рис.(а) дано классическое изображение цикла Карно в координатах P-V. Цикл Карно можно также представить в координатах S-T рис.(б).а) Какие процессы отражают кривые А, В, С, D на рис. (а). Указать соответствующие этим процессам отрезки прямых на рис. (б). б) Предположим, что идеальная тепловая машина работает между температурами T1 и T2, причём T2=300 К. за один цикл совершает работу 5000 Дж. Изменение энтропии газа для отдельных стадий цикла показано на рис. (б). Рассчитать теплоту Q1, которая поступает к машине от нагревателя, и теплоту Q2, которую машина отдаёт холодильнику. Чему равна температура нагревателя T1?
Ответ: ;
;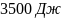
103. Определите максимальную работу, которую можно получить, если к воде при 100°С подводится 4000 Дж теплоты, а температура конденсата 20 °С.
Ответ: 858 Дж
104. В термостате поддерживается температура 96,6 °С. Температура воздуха в комнате 26,9 °С. Потеря теплоты через изоляцию термостата за некоторый промежуток времени составляет 4187 Дж. Найдите общее изменение энтропии.
Ответ:

105. Рассчитайте КПД идеальной машины Карно, получающей пар при 140 °С и выпускающей его при 105 °С.
Ответ: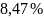
106. Максимальная температура в двигателе внутреннего сгорания 1800 °С, а минимальная, с которой газы выходят из цилиндра машины, 300 °С. Определите максимально возможный термический КПД, если двигатель будет работать по циклу Карно.
Ответ: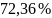
107. К газу при круговом процессе подведено 270 кДж теплоты. Термический КПДравен 0,48. Определите работу цикла и количество теплоты, отданное теплоприемнику.
Ответ: 129,6 кДж; 140,4 кДж
108. В результате осуществления кругового процесса получена работа, равная 70 кДж, а отдано теплоприемнику 47 кДж теплоты. Определите термический КПД цикла и количество теплоты, сообщенное рабочему телу от теплоотдатчика.
Ответ: 59,82 %; 117кДж
109. Идеальная машина Карно, работающая в интервале между 350 и 50 °С, дает33,52 кДж работы за цикл. Какое количество теплоты сообщается машине и отдается теплоприемнику за этот же цикл?
Ответ: 69,61 кДж; 36,09 кДж
110. В обратном цикле Карно от теплоотдатчика при 0 °С отнимается 419 кДж теплоты и передается теплоприемнику с температурой 77 °С. Определите работу, расходуемую на осуществление этого цикла.
Ответ: -118,1 кДж
111. В цикле Карно 1кг воздуха в пределах температур 800-273 К совершает работу, равную 50,28 кДж. Определите КПД цикла и количество отведенной теплоты.
Ответ: 65,88 %; 26,05 кДж
112. Сравните термодинамическую эффективность паровой машины и машины, работающей на ртутном паре, если котел первой имеет температуру 200 °С, второй 460 °С, а холодильник каждой из машин имеет температуру 30 °С.
Ответ: 1,6
113.
Практический коэффициент полезного
действия (КПД) двигателя внутреннего
сгорания равен
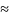 28%.
Насколько можно повысить КПД этого
двигателя, если температура газов
сгорания в его цилиндрах равна 1200 К, а
температура выхлопных газов - 400 К?
28%.
Насколько можно повысить КПД этого
двигателя, если температура газов
сгорания в его цилиндрах равна 1200 К, а
температура выхлопных газов - 400 К?
Ответ: 38,7 %
114. Спиральный электронагреватель за сутки расходует на обогрев помещения 86,4 кВт∙ч электроэнергии. Сколько энергии может быть сэкономлено, если этот нагреватель заменить тепловым нососом? Температуру обогреваемого помещения принять равной 18 , а температуру уличного воздуха принять равной минус 25 .
Ответ:
 кВт∙ч/сут.
кВт∙ч/сут.
115. Идеальная машина Карно, работающая в интервале температур от 200 до 300К, превращает в работу теплоту, равную 83,8 Дж. Какое количество теплоты отдано резервуару при 200К?
Ответ: -167,6 Дж
116. Какое количество теплоты будет превращено в работу идеальной машины Карно, работающей при температуре между 200 и 100 К, если она получит при 200 К сколько же теплоты, сколько получает машина в задаче 1 при 300 К?
Ответ:-129,7 Дж
117. При начальной температуре 348К 1 моль Н2по циклу Карно сначала расширяется до двойного объёма изотермически, затем расширяется до учетверенного первоначального объёма адиабатически, затем сжимается изотермически до такого объёма, чтобы при последующем адиабатическом сжатии вернутся в исходное положение. Вычислите работу каждой части цикла и КТД цикла γ=1,4.
Ответ: 2005,5; 1519,83; -1751,6; 1751,6 (Дж)
118. Вычислите максимальный теоретический коэффициент полезного действия обратимой тепловой машины, работающей между 25 и 1000К.
Ответ: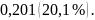
119.Рассчитайте
стандартную энтропию этилена, если
температуры и теплоты фазовых превращений
этилена соответственно равны: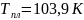 ,
,
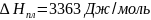 ,
,
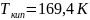 ,
,
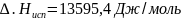 .
Зависимость теплоёмкости от температуры
см. в таблице
.
Зависимость теплоёмкости от температуры
см. в таблице
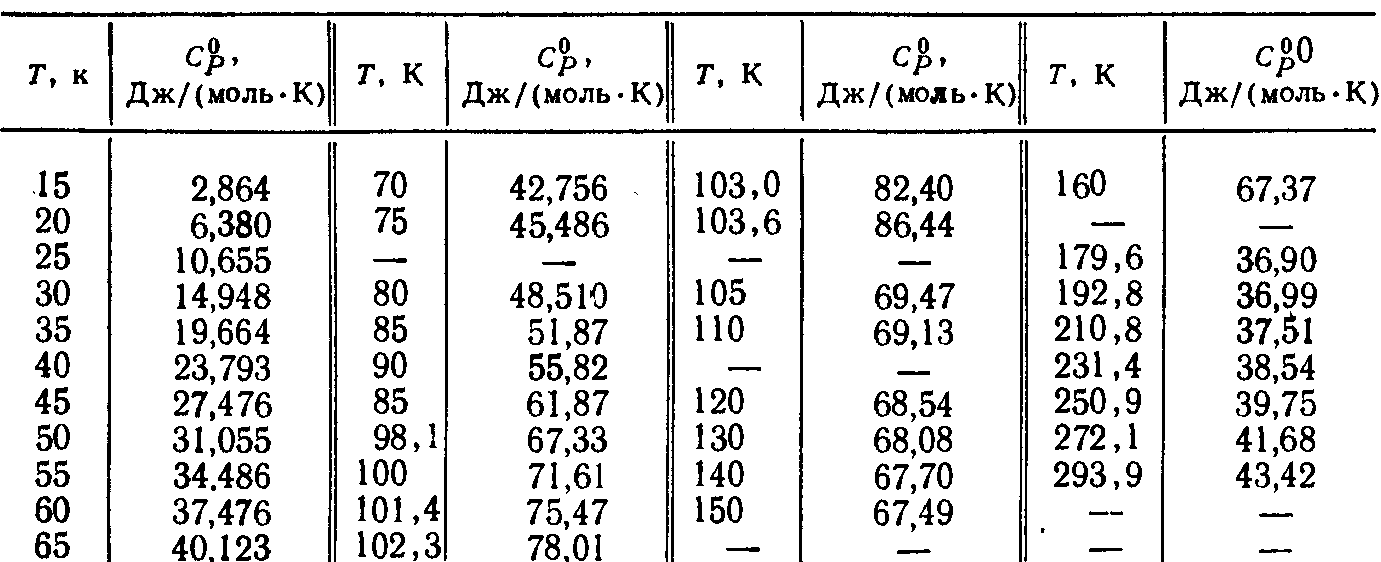
Ответ: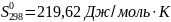
120.Установите,
осуществима ли при V=const
и 298 К реакция Ag+n AgCl(тв)+(n-
AgCl(тв)+(n-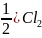 ,
использовав свойства энтропии.
,
использовав свойства энтропии.
121.Рассчитайте
давления, при которых графит и алмаз
находятся в равновесии для интервала
температур 298—4000 К. При расчете
используйте следующие данные для
равновесия С (графит)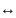 С (алмаз):
С (алмаз):
T,K |
Дж/моль |
Дж/(г |
Дж/моль |
|
|
,см3 |
|
298 1400 |
18 967,3
|
—3,364 —4,853 |
2903,7
|
2,602 0.418 |
|
—1,92 —1.90 |
|
122.
2 моля идеального одноатомного газа при
начальном давлении 1 атм и
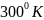 были
проведены через следующий цикл, все
стадии которого обратимы: изотермическое
сжатие до 2 атм ( I
); изобарическое нагревание до
были
проведены через следующий цикл, все
стадии которого обратимы: изотермическое
сжатие до 2 атм ( I
); изобарическое нагревание до
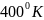 ( II
), возвращение в начальное состояние по
пути
( II
), возвращение в начальное состояние по
пути
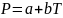 (a
и b
- постоянные) ( III
). Изобразите цикл на диаграмме P
– T
и вычислите
(a
и b
- постоянные) ( III
). Изобразите цикл на диаграмме P
– T
и вычислите
 рабочего тела для каждой стадии цикла.
рабочего тела для каждой стадии цикла.
Ответ: ;
;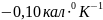
123.1
г жидкой воды при 100
и исходном давлении 1 атм. ограничен
объёмом, в котором отсутствует пар.
Затем был открыт клапан и вода испарилась
в эвакуированное пространство, причём
конечное давление равно 0,10 атм. Вся
аппаратура находилась в тепловом
резервуаре при 100
. испарения воды при 100
.
Составляет 540
испарения воды при 100
.
Составляет 540
 .
Примите, что пар является идеальным
газом и что объём жидкости незначителен
в сравнении с объёмом пара. Найдите q
и
.
Примите, что пар является идеальным
газом и что объём жидкости незначителен
в сравнении с объёмом пара. Найдите q
и
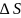 для а) воды; б) резервуара; в) и всей
системы; г) опишите обратимый процесс,
в котором вода может быть приведена к
тому же конечному состоянию. Покажите,
почему конечное состояние системы после
обратимого процесса будет отличаться
от неё состояния после действительно
проведенного процесса.
для а) воды; б) резервуара; в) и всей
системы; г) опишите обратимый процесс,
в котором вода может быть приведена к
тому же конечному состоянию. Покажите,
почему конечное состояние системы после
обратимого процесса будет отличаться
от неё состояния после действительно
проведенного процесса.
Ответ: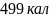 ;
;
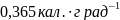
124. При
начальной температуре 373 К 1 моль кислорода
совершает цикл в идеальной машине Карно.
Сначала он расширяется изотермически
до двукратного объёма, затем расширяется
адиабатически до трёхкратного объёма
(по сравнению с первоначальным), затем
сжимается изотермически до такого
объёма, чтобы в результате последующего
адиабатического сжатия вернуться к
первоначальному состоянию. Приняв
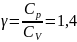 , рассчитайте работу, совершенную газом
в каждом части цикла; работу, произведенную
за счёт теплоты в цикле, и КПД цикла.
, рассчитайте работу, совершенную газом
в каждом части цикла; работу, произведенную
за счёт теплоты в цикле, и КПД цикла.
Ответ: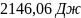 ;
; ;
; ;
321,2 Дж;
;
321,2 Дж;
125.
Для реакции Ag+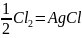 вычислите теплоту обратимого процесса.
Сведя данные справочника и результаты
вычислений в таблицу, покажите что
вычислите теплоту обратимого процесса.
Сведя данные справочника и результаты
вычислений в таблицу, покажите что
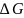 и
не зависят от пути процесса, а
и количество выделяющейся теплоты Q
зависят. Максимальная полезная
и
не зависят от пути процесса, а
и количество выделяющейся теплоты Q
зависят. Максимальная полезная
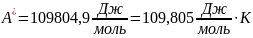
Ответ: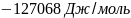
126. 200г олова [теплоемкость 6,1 кал ·(г∙атом)-1] с исходной температурой 1000С и 100г воды (теплоемкость 18 кал·моль-1) с исходной температурой 250С погружены вместе в калориметр. Приняв, что теплоемкость постоянна и что тепло не было потеряно или получено от окружающей среды или калориметра, найдите а) конечную температуру системы, б) изменение энтропии для олова, для воды и для олова и воды вмести.
Ответ:
31,90C;
8,95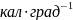
127. Коэффициент полезного действия цикла холодильной установки
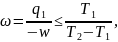
где Т1 и Т2 – температуры холодильных камер и окружающей среды соответственно, q1-теплота, отводимая от холодильных камер, w-потребляемая работа. а) Определите максимальную величину ω для холодильной установки, которая работает между 25 и -50С в окружающую среду с температурой 250С.
Ответ: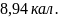 ;
;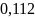 кал.
кал.
128. Тепловой насос является, в сущности, обратным холодильником, т.е. он использует тепло окружающей среды при низкой температуре Т1 на нагревание системы при высокой температуре (перекачивает тепло). Таким образом, этот тепловой насос может использоваться для обогрева помещений путем передачи тепла от холодного открытого воздуха к теплому внутреннему помещению. Преимущество этого метода перед обычным методом нагревания состоит в том, что максимальный коэффициент полезного действия холодильника намного больше, чем в случае обычных методов нагревания.
Ответ: в 6 раз
129.Процесс А: 1 моль одноатомного идеального газа расширяется изотермически в вакуум при 300 К от начального объёма 10 л до конечного объёма 20л.
Процесс Б: 1 моль
этого газа расширяется изотермически
и обратимо при 300 К от объёма 10 л до объёма
20 л. А) Для каждого процесса рассчитайте
q,
w, ,
,
,
, и
.
б) Опишите процесс, благодаря которому
газ мог бы возвратиться в исходное
состояние после каждого из процесса А
и Б. Покажите, как окружающая среда может
быть возвращена в исходное состояние
после одного из процессов и почему она
не может быть возвращена в исходное
состояние после другого процесса.
и
.
б) Опишите процесс, благодаря которому
газ мог бы возвратиться в исходное
состояние после каждого из процесса А
и Б. Покажите, как окружающая среда может
быть возвращена в исходное состояние
после одного из процессов и почему она
не может быть возвращена в исходное
состояние после другого процесса.
Ответ:А-
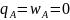 ;
Б-
;
Б- ;
;
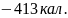
130.Вычислите энтропии CO2 при стандартных условиях (T=298,15K;1атм.) на основанииследующих данных:
T,K 15 25 50 75 100 125 150
Cp,Дж/моль∙К2,928 9,205 25,94 34,73 39,33 44,35 48,12
T,K 175 200 225 250 275 300
Cp,Дж/моль∙К51,04 25,00 29,30 32,74 35,33 37,28
Температура сублимации диоксида углерода при р=1атм. равна 194,7К, энтальпия сублимации 25 230 Дж/моль.
131.Вычислите энтропию аммиака при стандартных условиях (T=298,15K,р=1атм.) на основании следующих данных:
T,K 15 25 50 75 100 125 150
Cp,Дж/моль∙К0,836 3,347 11,30 18,41 25,94 32,64 38,49
T,K175 200 225 235 243 253 263 273
Cp,Дж/моль∙К44,77 52,30 53,97 54,81 34,39 34,60 34,81 35,02
T,K283 293 303
Cp,Дж/моль∙К 35,27 35,52 35,77
Аммиак плавится при Т=195,4К, энтальпия плавления 5657 Дж/моль. Температура кипения аммиака 239,7К, энтальпия испарения 23351 Дж/моль.
132. Вычислить энтропию воды при стандартных условиях (T=298,15K;1атм.) на основанииследующих данных:
Т,К 10 40 80 120 160 200 240
Cp,Дж/моль∙К1,674 6,276 13,39 19,25 23,01 28,03 33,05
Т,К 260 293 313
Cp,Дж/моль∙К36,82 75,73 75,31
Лёд плавится при Т=273,15К. энтальпия плавления льда 6015 Дж/моль.
133.Вычислите энтропию метана при стандартных условиях (T=298,15K;1атм.) на основании следующих данных:
Т,К 15 20 30 40 50 60 70 80
Cp,Дж/моль∙К9,832 43,93 24,48 29,08 32,64 35,56 38,07 40,79
Т,К90 100 110 203 223 263 303
Cp,Дж/моль∙К43,30 56,48 56,90 29,46 30,92 33,72 36,36
У твёрдого метана имеется фазовое превращение при Т=20,4 К, энтальпия которого равна 76 Дж/моль. При 90,6 К метана плавится, энтальпия плавления 937Дж/моль. Температура кипения метана 111,8 К, энтальпия испарения 8234 Дж/моль.
134. Вычислите энтропию азота при стандартных условиях (T=298,15K;1атм.) на основании следующих данных:
Т,К 15 20 25 30 35 40 50
Cp,Дж/моль∙К11,72 20,50 27,61 34,31 45,19 38,49 40,17
Т,К 60 65 70 75 100 150 200 300
Cp,Дж/моль∙К41,84 56,07 56,90 57,32 29,12 29,12 29,12 29,12
У твёрдого азота при Т=35б6 К имеется фазовый переход, энтальпия которого 229 Дж/моль. При Т=63,14 К азот плавится, энтальпия плавления 721 Дж/моль. Температура кипения азота 77,3 К. энтальпия испарения 5577 Дж/моль
135. Вычислите энтропию кислорода при стандартных условиях (T=298,15K;1атм.) на основании следующих данных:
Т,К 15 20 30 40 45 50 60
Cp,Дж/моль∙К7,113 15,06 27,61 41,00 46,02 46,02 55,23
Т,К 70 80 90 200 300
Cp,Дж/моль∙К55,65 56,07 56,48 29,12 29,37
У твердого кислорода имеются два фазовых превращения при 23,7 К и 43,6 К. Энтальпии фазовых превращений соответственно равны 94 и 743 Дж/моль. При температуре 54,4 К кислород плавится, энтальпия 44 Дж/моль. Температура кипения кислорода 90,13 К, энтальпия испарения 6816 Дж/моль.

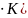
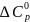 Дж/(г
Дж/(г