
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
8.3. Общие свойства ферментов
К ферментам применимы три основных критерия, характерных для неорганических катализаторов:
они остаются относительно неизменными после реакции, т. е. освобождаются вновь и могут реагировать с новыми молекулами субстрата;
ферменты оказывают свое действие в ничтожно малых концентрациях, например: 1 молекула реннина (содержится в слизистой оболочке желудка теленка) створаживает около 106 молекул казеиногена молока за 10 мин при 37 °С;
наличие фермента (катализатора) не оказывает влияния ни на величину константы равновесия, ни на изменения свободной энергии. Катализаторы лишь повышают скорость реакций (точку равновесия они не сдвигают).
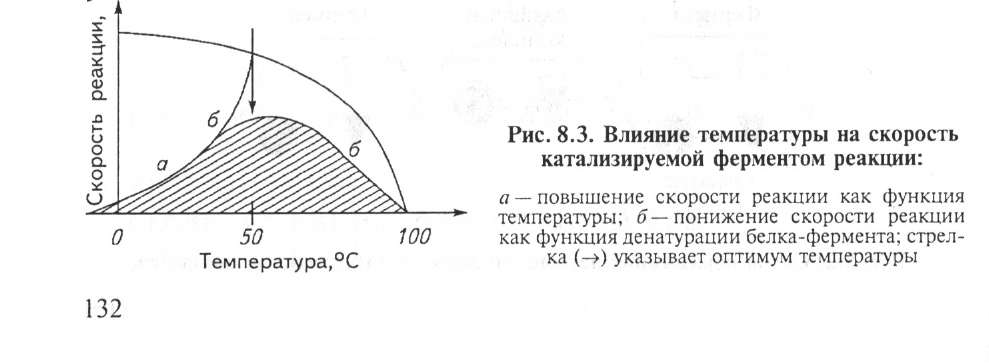
Термолабильность ферментов. Скорость химической реакции зависит от температуры. Реакции, катализируемые ферментами, также чувствительны к изменениям температуры. Скорость химической реакции повышается в 2 раза при повышении температуры на 10 "С. Ускорение реакции идет до 45 "С, затем, в связи с денатурацией белка-фермента, снижается. При 100 "С почти все ферменты полностью утрачивают свою активность.
Оптимальная температура для действия ферментов теплокровных 37...40 "С. При низких температурах (0 °С и ниже) ферменты не разрушаются, не денатурируют, но активность их снижается до нуля (рис. 8.3).
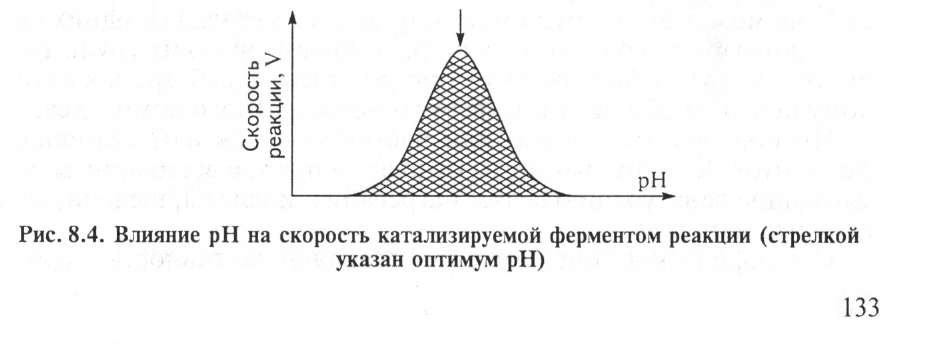
Зависимость активности ферментов от рН среды. Ферменты активны в узких пределах значений рН, как правило, 6,0...8,0. Каждый фермент имеет свой оптимум рН, который лежит в пределах физиологических значений. Исключением является пепсин, рН- оптимум которого 2,0. Объясняется это функцией данного фермента, так как в желудочном соке содержится свободная хлороводородная (соляная) кислота, обусловливающая кислое значение рН.
Влияние колебаний рН среды на активность фермента заключается в том, что изменяется сте-
пень ионизации кислотных и основных групп (—СООН, —SH, имидазольной, —NH2 и т. д.).
При разных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что сказывается на третичной структуре белка и соответственно на формировании активного комплекса фермент—субстрат (рис. 8.4).
Специфичность ферментов. Ферменты обладают высокой специфичностью действия и этим существенно отличаются от неорганических катализаторов. Например, измельченная платина или палладий могут катализировать восстановление десятков соединений различной структуры, а фермент обычно проявляет свою активность только при полном соответствии активного центра и субстрата, только при «узнавании» обычно протекает одна высокоспецифичная реакция среди тысячи других химических процессов, осуществляемых в живой клетке. В зависимости от механизма действия различают ферменты с относительной, или групповой, и абсолютной специфичностью.
Для действия некоторых гидролитических ферментов характерна относительная специфичность. Например, пепсин расщепляет белки животного и растительного происхождения, хотя они могут различаться по химическому строению, аминокислотному составу и физико-химическим свойствам; он разрывает пептидную связь — СО—NH— между аминокислотами. Однако пепсин не расщепляет жиры и углеводы.
Липаза, катализирующая гидролиз жиров на глицерин и жирные кислоты, разрывает сложноэфирные связи. Аналогично групповой специфичностью обладают трипсин; химотрипсин; пептидазы; ферменты, гидролизирующие а-гликозидные связи в полисахаридах. Все перечисленные ферменты — пищеварительные, их групповая специфичность имеет биологический смысл.
Абсолютная специфичность — это способность фермента катализировать превращение единственного субстрата. Например, аргиназа, расщепляющая в организме аргинин; уреаза, катализирующая распад мочевины, и др.
Стереохимическая специфичность — это способность фермента различать L- и D-изомеры. Например, оксидазы (аминокислот) действуют только на свой специфический стереоизомер L- или D-аминокислот. Специфичностью обладают также ферменты, катализирующие синтетические реакции.
