
- •Работа 1 определение чисел переноса в ионных полупроводниках
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 2 определение константы диссоциации слабого электролита
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 3 определение растворимости труднорастворимого соединения
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 4 определение стандартного окислительно-восстановительного потенциала
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 5 перенапряжение разряда ионов водорода
- •Экспериментальная часть
- •Контрольные вопросы
- •Работа 6 потенциометрическое титрование
- •Экспериментальная часть
Работа 1 определение чисел переноса в ионных полупроводниках
В процессе электролиза у электродов происходит разряд катионов и анионов в соответствии с законом Фарадея, а также направленное движение ионов согласно их знакам. Поскольку скорости движения анионов и катионов могут различаться, они будут переносить разные количества электричества. Уяснить смысл этого можно при рассмотрении схемы приведенной на рисунке 1.
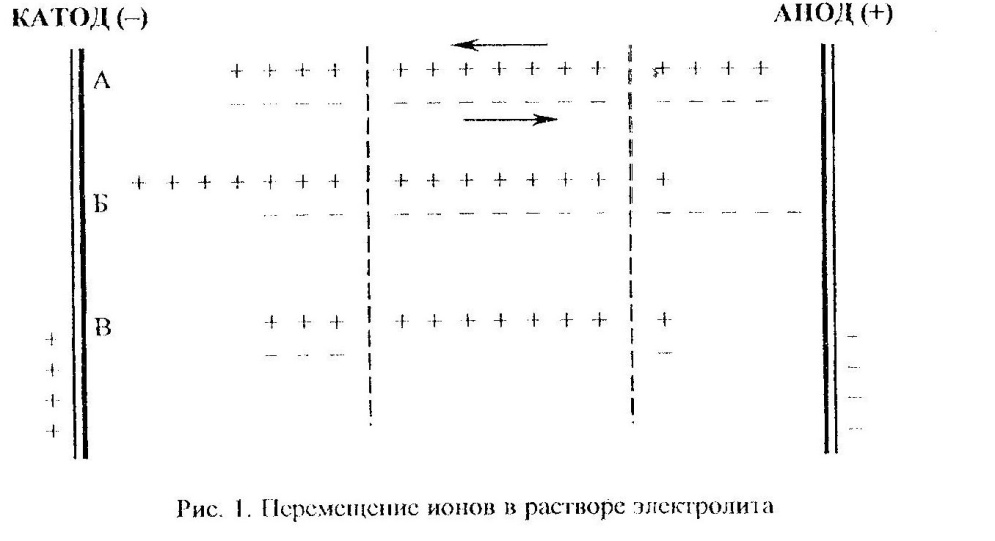
На схеме плюсами обозначены катионы, а минусами анионы. Пусть те и другие будут одновалентны. Разделим пространство между электродами на три части (катодную, анодную и среднюю) и рассмотрим, какие изменения произойдут в них при пропускании постоянного тока. Допустим, что катионы движутся быстрее анионов точно в три раза. Для простоты предположим, что ионы располагаются в виде цепочек (положение А). После прохождения одного Фарадея электричества на катоде и аноде произойдет соответственно разряд одного грамм-эквивалента анионов и катионов (В). Нетрудно убедиться в том, что различие в скорости движения катионов и анионов не приводит к появлению в катодном и анодном пространстве ячейки избытка ионов какого либо знака.
На схеме видно, что перенос ионов при принятом соотношении скоростей катионов и анионов приводит к увеличению концентрации раствора у катода и уменьшению – у анода. Доля тока (ti), переносимая данным видом ионов через раствор, называется числом переноса и определяется уравнением:
ti=Ii / I . (1.1)
Очевидно, сумма числа переноса всех ионов, присутствующих в растворе, равна единице, т.е. ∑ ti = 1.
Числа переноса связаны со скоростями движения соответствующих ионов и ионными подвижностями следующими соотношениями:
t+
=
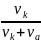 =
=
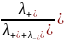 ;
t-
=
;
t-
=
 =
=
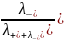 , (1.2)
, (1.2)
где
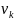 ,
,
 – скорости движения катиона и аниона;
– скорости движения катиона и аниона;
 ,
,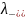 − ионные подвижности.
− ионные подвижности.
Для смесей электролитов число переноса каждого иона зависит также от его концентрации в растворе:
ti= , (1.3)
, (1.3)
где
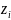 - заряд иона.
- заряд иона.
При стационарном процессе устанавливается некоторая постоянная разность концентраций между средней частью раствора и анолитом и католитом. Такое равновесие может наступить лишь по истечении длительного времени, но в первое время после начала электролиза изменения концентрации кислоты в приэлектродных слоях раствора целиком определяются количеством пропущенного электричества.
При пропускании 1F электричества произойдут следующие концентрационные изменения в анодном пространстве: 1 г-экв анионов разрядится; t- г-экв анионов поступит из катодного отделения; t+ г-экв катионов перенесется током в катодное отделение. В итоге имеем общую убыль концентрации анионов, равную (1-t-)=t+ г-экв, такую же убыль концентрации катионов, т.е. в целом общая концентрация электролита в анодном отделении понижается на t+ г-экв.
В катодном пространстве: 1 г-экв катионов выделится на катоде; t+ г-экв катионов поступит из анодного отделения; t- г-экв анионов уйдет в анодное отделение. Убыль концентрации катионов в катодном отделении равна (1-t+)=t- г-экв. В целом концентрация электролита в катодном отделении электролизера уменьшится на t- г-экв.
Обозначив изменение концентрации кислоты возле электродов через ΔCk для катодного и ΔCa – анодного отделений электролизера, запишем отношение
ΔCk / ΔCa = t+/t- . (1.4)
Найденное отношение дает возможность раздельно определить числа переноса анионов и катионов. Прибавив к обеим частям уравнения (1.4) по единице, получим:
1
+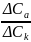 =
=
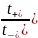 + 1, или
+ 1, или
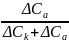 =
=
 . (1.5)
. (1.5)
Но так как t+ + t-=1, последнее равенство можно привести к виду:
t-=
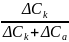 .
(1.6)
.
(1.6)
Аналогично для чисел переноса катиона:
t+
=
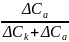 .
(1.7)
.
(1.7)
Уравнения (1.6) и (1.7) применимы для расчета чисел переноса после аналитического определения изменений концентрации кислоты возле электродов, но только для случая нерастворимых электродов.
Метод определения чисел переноса, основанный на установлении концентрационных изменений возле электродов электрохимической ячейки, называют методом Гитторфа.
Методом Гитторфа определяют кажущиеся числа переноса, так как ионы в водном растворе гидратированы и переносят с собой воду, что не было учтено в приведенных выше расчетах.
