
Работа 1
ИЗУЧЕНИЕ КИНЕТИКИ РЕАКЦИЙ ВТОРОГО ПОРЯДКА НА ПРИМЕРЕ РЕАКЦИЙ ИОДИРОВАНИЯ АЦЕТОНА В КИСЛОЙ СРЕДЕ
Теоретическое введение
Йодирование ацетона катализируется в водных растворах протонами
C H3
– CO – CH3
+ I2
H+
CH3
– CO
–
CH2I
+ H+
+ I-
(1)
H3
– CO – CH3
+ I2
H+
CH3
– CO
–
CH2I
+ H+
+ I-
(1)
и протекает в две стадии:
энолизация ацетона (с образованием промежуточного вещества)
+
CH3 – C – CH3 + H+ → CH3 – C – CH3 - - - CH3 – C = CH2 + H+ ; (2)
O OH OH
взаимодействие йода с энольной формой
CH3 – C = CH2 + I2 → CH3 – C – CH2I- + I- + H+. (3)
OH O
Первая реакция протекает значительно медленнее второй, поэтому скорость процесса определяется скоростью первой стадии, которая пропорциональна концентрации ацетона и ионов водорода, но не зависит от концентрации йода. Реакция проходит автокаталитически, так как ускоряется одним из продуктов реакции (Н+). В нейтральном разбавленном растворе она протекает очень медленно.
Скорость расходования ацетона выражается кинетическим уравнением второго порядка в соответствии с уравнением лимитирующей стадии:
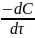 =
k (C0
– Cx)
(COH+
+
Cx),
(4)
=
k (C0
– Cx)
(COH+
+
Cx),
(4)
где С0 – концентрация ацетона начальная; СОН+ - начальная концентрация ионов водорода; Сх – концентрация ацетона, подвергающаяся превращению за время τ (убыль концентрации); τ – время от начала реакции до данного измерения.
Интегрирование выражения (4) дает уравнение константы скорости процесса:
k=
 * lg
* lg
 .
(5)
.
(5)
Для графической проверки это уравнение используют в линейной форме:
lg = k *
= k *
 * τ + lg
* τ + lg
 .
(6)
.
(6)
Экспериментальная часть
В работе исследуется зависимость константы скорости реакции от начальной концентрации катализатора ( по указанию преподавателя), а также изучается первичный и вторичный солевой эффект.
В каждую из четырех 200 мл мерных колб вливают 25 мл 0,1 N раствора йода в 4%-ном растворе KI, прибавляют к нему 25 мл соляной кислоты концентрации от 0,3 до 1,5 N (по указанию преподавателя) и разбавляют дистиллированной водой до объема 150 мл.
Ацетон (около 1,5 г) берут пипеткой (1,6 – 2,0 мл) и сливают в колбочку, содержащую 10 мл воды. Приготовленный раствор ацетона приливают в колбу с раствором йода и кислоты, после чего смесь доводят до метки дистиллированной водой. Момент вливания ацетона принимают за начало реакции. Аналогичную процедуру проделывают с остальными растворами йода с интервалом в 2-3 мин.
Первую пробу объемом 10 мл берут сразу же после доведения смеси до метки взбалтывания. Последующие пробы того же объема целесообразно брать через каждые 15-20 мин (всего 8-10 проб). Чем меньше концентрация кислоты, тем реже следует брать пробы.
Анализ пробы ведут следующим образом: пробу 10 мл вливают в 10 мл 0,1 N раствора NaHCO3 и титруют по йоду 0,01 N раствором Na2S2O3 с крахмалом в качестве индикатора. По ходу реакции время между последовательными титрованиями нужно постепенно увеличивать.
Концентрацию ацетона определяют по уравнению
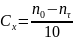 *
* , (7)
, (7)
где
 - количество 0,01 N
Na2S2O3
, израсходованного на титрование пробы,
мл;
- количество 0,01 N
Na2S2O3
, израсходованного на титрование пробы,
мл;
 - количество Na2S2O3
,
которое должно быть израсходовано на
титрование в момент начала реакции, мл;
N
– нормальность раствора Na2S2O3.
- количество Na2S2O3
,
которое должно быть израсходовано на
титрование в момент начала реакции, мл;
N
– нормальность раствора Na2S2O3.
Значение практически определить не удается, поскольку от момента вливания ацетона до момента взятия первой пробы проходит некоторое время. Поэтому для определения строят график в координатах n = f(τ) и экстраполяцией до τ = 0 находят искомую величину.
Расчет константы скорости проводят для каждой пробы и находят среднее значение.
Используя линейную формулу уравнения (6), строят графики в координатах lg
 ,
τ. Из наклона каждой прямой находят
значения констант скорости и сравнивают
с рассчитанными kср.
,
τ. Из наклона каждой прямой находят
значения констант скорости и сравнивают
с рассчитанными kср.Строят график зависимости константы скорости от концентрации кислоты.
Данные эксперимента и расчеты помещают в таблицу 1.
Таблица 1
-
Объем титруемой пробы – 10 мл, … г-экв/л,
Объем прибавленной кислоты – 25 мл, … г-экв/л,
Нормальность кислоты - … N
№
τ

lg
k
kср
lg kcp
Работа 1 а
Первичный солевой эффект заключается в увеличивании каталитического действия кислоты при прибавлении нейтральной соли, не имеющей общего аниона с катализирующей реакцию кислотой.
При постоянной начальной концентрации соляной кислоты проводят 5 опытов. Первый из них – без добавок соли, а последующие – с добавкой соли в таком количестве, чтобы концентрация ее в реакционной смеси изменялась в пределах от 0,025 до 0,2 N. Полученные опытные и расчетные данные помещают в таблицу 1.
Строят зависимости:
= f (τ),
Константы скорости реакции от концентрации соли.
Работа 1 б
Вторичный солевой эффект заключается в том, что при добавлении в реакционную смесь соли катализирующей кислоты каталитическое действие последний может сначала уменьшится, а затем возрастать с увеличением концентрации соли.
Катализатором здесь служит 1,0 N уксусная кислота, добавками – уксуснокислый натрий. При постоянной температуре проводят 8-10 опытов, причем максимальная концентрация соли в регенерирующей смеси не должна превышать 0,2 N. Несколько опытов должны быть сделаны в пределах до 0,02 N концентрации соли, так как характерный для изучаемого эффекта минимум наблюдается примерно при 0,01 N соли.
Полученные данные заносят в таблицу 1, а также представляют в виде графика.
Контрольные вопросы
Почему скорость реакции йодирования ацетона не зависит от концентрации йода?
Получите соотношение (5) интегрированием уравнения (4).
Какие координаты, кроме предложенных (6), можно использовать для графической проверки уравнения (5)?
Как влияет исходная концентрация реагентов на ход графиков
lg , τ ?
Какие соли необходимо добавлять в реакционную смесь для изучения солевых эффектов?
Работа 2
ИССЛЕДОВАНИЕ СКОРОСТИ ОКИСЛЕНИЯ МЕТАЛЛОВ ПРИ ВЫСОКИХ ТЕМПЕРАТУРАХ
Теоретическое введение
Примером газовой коррозии металлов может служить окисление последних при высоких температурах. При комнатной температуре окисление металлов чаще всего ограничивается потускнением или образованием тонких пленок. Вследствие малой диффузии кислорода к поверхности металла при таких температурах толщина этих пленок практически не увеличивается. Особое положение в условиях химических производств имеет газовая коррозия при высоких температурах. Такая коррозия является равномерной, так как распространяется вглубь металла почти одинаково по всей поверхности, а образующиеся пленки из продуктов коррозии имеют одинаковую толщину по всей площади, подвергающейся коррозии.
Скорость газовой коррозии оценивается по привесу с квадратного метра поверхности в единицу времени или по глубине коррозии.
При повышении температуры скорость коррозии возрастает, так как увеличивается скорость диффузии и химических процессов. Вследствие этого пленки продуктов коррозии утолщаются. Увеличение толщины пленки на разных металлах протекает по различным законам: прямолинейному, параболическому и логарифмическому. Данное обстоятельство обусловливается главным образом природой образующихся оксидов, а также целостностью покрытия. У металлов, на которых при окислении не образуется защитная пленка, скорость роста остается постоянной. Толщину ее рассчитывают на основании формулы
 =
=
 ΔC,
(1)
ΔC,
(1)
т.е.
δ = kτ + A, (2)
где δ – толщина слоя продукта коррозии, – коэффициент скорости процесса, ΔС – движущая сила коррозии, А – постоянная интегрирования.
Константа
интегрирования определяет толщину
пленки в начальный момент окисления,
т.е.
 =
0. Если окисление начинается на чистой
поверхности, то А = 0.
=
0. Если окисление начинается на чистой
поверхности, то А = 0.
Ряд металлов, применяемых в химической технологии, окисляется по параболическому закону, например, металлы, на которых в результате химической коррозии получаются сплошные пленки. В этом случае процесс тормозится диффузией агентов через пленку и по мере ее роста коррозия замедляется.
Представим сплошную пленку толщиной δ, находящуюся на поверхности окисляющегося металла (рис.1). Для этого случая имеем соотношение
 =
DF
=
DF
 ,
(3)
,
(3)
где G – количество диффундирующего вещества, τ – время, D – коэффициент диффузии, dC/dδ –градиент концентрации, F – площадь окисления.

Рис.1. Схема диффузии кислорода через пленку при соприкосновении металла.
Если принять, что в процессе окисления устанавливается стационарный режим диффузии, т.е. не происходит накопления диффундирующего кислорода на внешней поверхности пленки на границе с воздухом, С1 – концентрация кислорода на внутренней поверхности пленки на границе с металлом. Тогда скорость диффузии
UD
=
= D
 (4)
(4)
Для единичной поверхности пропорциональна разности концентраций кислорода и обратно пропорциональна толщине слоя.
Примем, что на корродируемом металле уже имеется защитная пленка, а процесс идет в диффузионной области, и весь кислород, диффундируя через пленку, не накапливается, т.е. немедленно вступает в реакцию. Для такого случая скорость роста пленки (Uкор) может быть равна скорости диффузии кислорода (UD)
Uкор
= UD
= D
 . (5)
. (5)
При постоянных условиях окисления (парциальное давление кислорода и температура процесса равны const, например, при воздействии воздуха, нагретого до определенной температуры).
Uкор
=
=
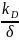 (6)
(6)
или после интегрирования
δ2 = kDτ + A. (7)
в некоторых случаях, например при наличии в растущей пленке трещин 9из-за нагревания или охлаждения), а также при сравнительно невысоких температурах, коррозия металлов протекает по логарифмическому закону
=
 (8)
(8)
или
δ = ln (kτ). (9)
при увеличении температуры скорость окисления возрастает. Это происходит потому, что с ростом температуры увеличивается скорость диффузии кислорода и константа скорости окисления в соответствии с уравнением Аррениуса
ln
k
= A
-
 . (10)
. (10)
перенос вещества через слой продукта реакции окисления – окалину осуществляется путем независимого движения заряженных частиц : ионов (катионов M+n X-m) и электронов е-. Согласно схеме, изображенной на рис.2, катионы и электроны движутся в одном направлении – от границы окалины с металлом к границе с неметаллом, анионы – в противоположном.

Рис.2. Схема движения частиц при окислении металла
Процесс переноса через слой окалины является лимитирующей стадией процесса окисления: переход ионов или электронов через поверхность раздела фаз протекает без затруднений, поэтому на межфазных границах существует термодинамическое равновесие.
Экспериментальная часть
Исследование кинетики газовой коррозии проводится по методике периодического взвешивания на лабораторной установке, схема которой приведена на рис.3.

Рис.3.Схема установки для изучения скорости газовой коррозии при высоких температурах
Испытуемый образец 2 подвешивают на нихромовом или кварцевом подвесе 5, состоящем из нескольких звеньев, в вертикальной трубчатой печи сопротивления 3, к коромыслу аналитических весов 6. Температуру в печи замеряют хромель-алюмелевой термопарой 1 и записывают на потенциометре КСП – 4 – 7. Конец термопары должен находиться вблизи испытуемого образца. Чтобы избежать нагрева весов, между печью и весами устанавливается экран 4.
Работа по исследованию скорости окисления металла проводится следующим образом: включают обогрев печи и потенциометр КСП – 4. По достижению заданной температуры (регулируют при помощи ЛАТРа) подвешивают в печи испытуемый образец 2 и через 1-2 мин его взвешивают. За это время образец принимает температуру печи, но еще не успевает заметно окислится. Далее в течение 1-2 ч через заданные преподавателем промежутки времени продолжают взвешивание образца. По окончании опыта при данной температуре образец вынимают, устанавливают в печи следующую заданную температуру, подвешивают в печи новый образец такого же металла и повторяют опыт в том же порядке.
Результаты опытов по исследованию кинетики газовой коррозии сводят в таблицу по образцу. По табличным данным для каждой температуры строят графики в координатах G1 – τ, Δ G12 – τ и Δ G1 – ln τ, устанавливая таким образом, по какому закону идет окисление в определенной температурной области.
Темпе-ратура,К |
Металл и номер образца |
Поверхность образца,м2 |
Время и номер взвешивания |
Время от начала опыта,τ |
Масса образца,G1,кг |
Привес ΔG1,кг |
Привес на единицу поверхности ΔG1кг |
Установив характер кривой и какому уравнению она подчиняется, рассчитывают константу скорости окисления при любой температуре, а затем определяют энергию активации и получают расчетное уравнение процесса окисления в зависимости от температуры. Для определения константы скорости окисления расчет проводится по формулам:
-
при прямолинейном характере кривых
окисления k
= ;
;
-
при параболическом характере кривых k
=
 ;
;
-
при логарифмическом законе окисления
k
=
 .
.
Контрольные вопросы
Почему нет единого уравнения для газовой коррозии металлов?
Каковы признаки диффузионного торможения гетерогенного процесса?
Напишите уравнения Фика для 1 и 2 закона диффузии.
Расскажите о механизмах окисления различных металлов.
