- •Раздел 2. Дискретное строение вещества
- •Тема 2.1 Атомно-молекулярные представления о строении вещества.
- •Тема 2.2 Строение атома и атомного ядра.
- •История атомистических учений.
- •Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Объяснение свойств агрегатных состояний вещества на основе атомно-молекулярных представлений.
- •Фазовые переходы. Использование физических свойств веществ в технике, для записи, хранения и воспроизведения информации. Жидкие кристаллы.
- •Применение жидких кристаллов
- •Окно становится экраном!
- •Будущее 3d видео - за жидкими кристаллами!
- •Солнцезащитные очки Uvex на жидких кристаллах
- •Строение атома.
- •Состав ядра.
- •Изотопы.
- •Электрон, протон, нейтрон, кварки и другие элементарные частицы.
- •Энергия связи. Связь массы и энергии.
- •7. Ядерная энергетика
- •Радиоактивные излучения и их воздействие на организм человека.
- •Виды радиоактивности
- •Альфа распад.
- •Бета-распад
- •Гамма-распад (изомерный переход)
- •К чему может привести воздействие радиации на человека?
- •Как радиация может попасть в организм?
- •Cуммарное облучение
Раздел 2. Дискретное строение вещества
Тема 2.1 Атомно-молекулярные представления о строении вещества.
Тема 2.2 Строение атома и атомного ядра.
История атомистических учений.
Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Объяснение свойств агрегатных состояний вещества на основе атомно-молекулярных представлений.
Фазовые переходы. Использование физических свойств веществ в технике, для записи, хранения и воспроизведения информации. Жидкие кристаллы.
Строение атома (планетарная модель) и атомного ядра.
Электрон, протон, нейтрон, кварки и другие элементарные частицы.
Энергия связи. Связь массы и энергии.
Ядерная энергетика.
Радиоактивные излучения и их воздействие на организм человека.
История атомистических учений.
Европейская атомистика возникла в Древней Греции. Атомистизм был создан представителями досократического периода развития древнегреческой философии Левкиппом и его учеником Демокритом Абдерским.
Согласно их учению:
существуют только атомы и пустота.
Атомы — мельчайшие неделимые, невозникающие и неисчезающие, качественно однородные, непроницаемые (не содержащие в себе пустоты) сущности (частицы), обладающие определённой формой.
Атомы бесчисленны, так как пустота бесконечна.
Форма атомов бесконечно разнообразна.
Атомы являются первоначалом всего сущего, всех чувственных вещей, свойства которых определяются формой составляющих их атомов.
Сторонником атомизма был Платон, который считал, что атомы имеют форму идеальных Платоновских тел (правильных многогранников).
В поэме древнеримского философа Лукреция «О природе вещей» атомы впервые характеризуются как телесные («тельца» — корпускулы) и состоящие из материи. Предшествующие античные атомисты ничего не говорили о телесной природе атомов.
Противники атомизма Демокрита утверждали, что материя делится до бесконечности. К их числу может быть отнесён Аристотель.
Возрождение и раннее Новое время. Пьер Гассенди высказал идею, что из однородных неделимых частиц состоят химические элементы.
XIX—XX века. В XIX стало известно, что химические атомы разлагаются на более мелкие элементарные частицы и таким образом «атомами» в Демокритовском смысле не являются. Тем не менее, термин используется и теперь в современной химии и физике, несмотря на несоответствие его этимологии современным представлениям о строении атома.
В современной физике вопрос об атомизме является открытым. Некоторые теоретики придерживаются атомизма, но под атомами подразумевают фундаментальные частицы, которые далее неделимы.
Наблюдения и опыты, подтверждающие атомно-молекулярное строение вещества. Объяснение свойств агрегатных состояний вещества на основе атомно-молекулярных представлений.
Все вещества и тела в природе состоят из атомов и молекул - групп атомов. Такие большие тела называются макроскопическими. Атомы и молекулы относятся к микроскопическим телам. О том, что все вещества и тела состоят из мельчайших неделимых частиц догадывались ещё древнегреческие философы Демокрит и Левкипп. Теперь эти догадки являются установленными фактами. Современные приборы (ионные проекторы, туннельные микроскопы) позволяют видеть изображения отдельных атомов и молекул.
Основа строения вещества - атомы. Атомы тоже имеют сложную структуру, они состоят из элементарных частиц - протонов, нейтронов, входящих в состав ядра атома, электронов, а также других элементарных частиц.
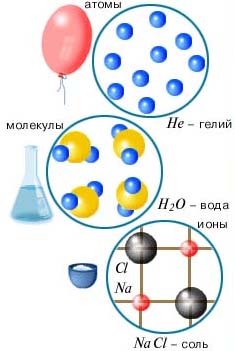
Атомы могут объединяться в молекулы, а могут быть вещества, состоящие только из атомов. Атомы в целом электронейтральны.
Атомы, имеющие избыток или недостаток электронов называются ионами. Бывают положительные и отрицательные ионы. Атомы могут находиться в состоянии ионов. Есть вещества, состоящие из ионов. На иллюстрации показаны примеры разных веществ, имеющих строение соответственно в виде атомов, молекул и ионов.
Любое вещество состоит из молекул, а его физические свойства зависят от того, каким образом упорядочены молекулы и как они взаимодействуют между собой. В обычной жизни мы наблюдаем три агрегатных состояния вещества — твердое, жидкое и газообразное.
Молекулярно-кинетическая теория (МКТ) занимается изучением свойств веществ, основываясь при этом на представлениях о частицах вещества.
МКТ базируется на трех основных положениях:
Все вещества состоят из частиц - молекул, атомов и ионов. Размеры атомов (молекул) равны 10-10 - 10-9 м. Число атомов (молекул) в единице объема вещества (твердого тела или жидкости) порядка 1022 частиц в 1 см3.
Массы атомов
(молекул) весьма малы в привычных единицах
(порядка 10-26 кг), поэтому для их описания
используют относительные единицы. По
определению массу молекулы (атома)
любого вещества m0 относят к 1/12 массы
атома углерода и называют относительной
атомной массой M отн:
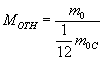 .
.
Частицы вещества беспрерывно и беспорядочно движутся. Наиболее яркое доказательство - броуновское движение (Р. Броун, 1827 г.) мелких частиц, взвешенных в жидкости, происходящее из-за непрерывных беспорядочных соударений этих частиц с молекулами жидкости. Другой простой экспериментальный факт, доказывающий тепловое движение атомов вещества, - диффузия (Явление самопроизвольного проникновения частиц одного вещества в другое вещество).
Частицы вещества взаимодействуют друг с другом. Между атомами (молекулами) вещества действуют силы притяжения и отталкивания, зависящие от расстояния между частицами. Молекула - это сложная система, состоящая из отдельных заряженных частиц: электронов и атомных ядер. Хотя в целом молекулы электрически нейтральны, тем не менее между ними на малых расстояниях действуют значительные электрические силы: происходит взаимодействие электронов и атомных ядер соседних молекул. На далеких расстояниях (превышающих несколько радиусов молекулы) взаимодействие слабо. С уменьшением расстояния это притяжение сначала несколько возрастает, а затем стремится к нулю. В момент соприкосновения электронных оболочек молекул возникают быстро растущие с уменьшением расстояния силы электростатического отталкивания. Если бы между молекулами не существовало сил притяжения, то все тела при любых условиях находились бы только газообразном состоянии. Но одни силы притяжения не могут обеспечить существования устойчивых образований из атомов и молекул. На очень малых расстояниях между молекулами обязательно действуют силы отталкивания. Благодаря этому молекулы не проникают друг в друга и куски вещества никогда не сжимаются до размеров одной молекулы.
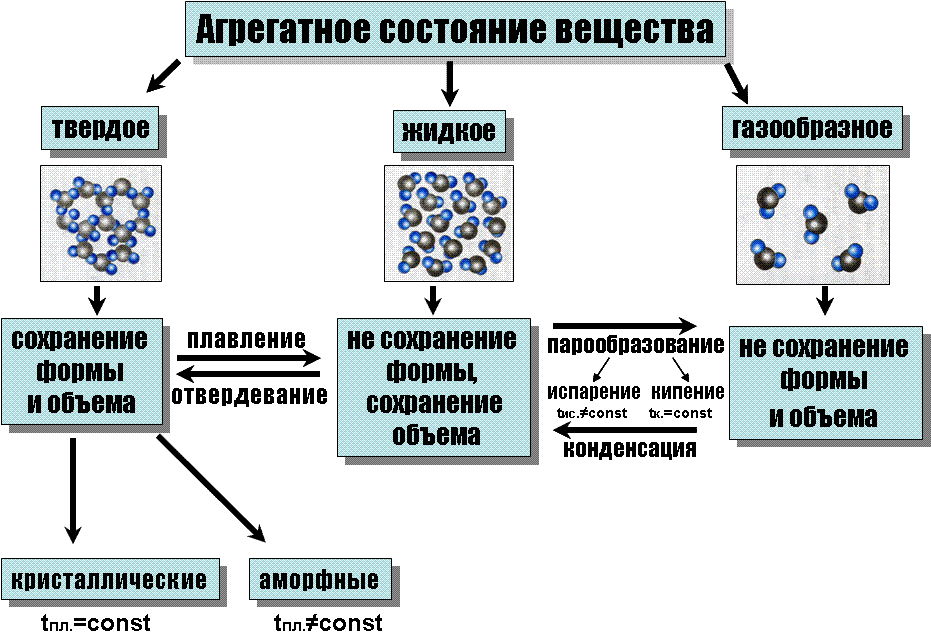
Агрегатное состояние — состояние вещества, характеризующееся определёнными качественными свойствами — способностью или неспособностью сохранять объём и форму, наличием или отсутствием дальнего и ближнего порядка и другими.
Изменение агрегатного состояния сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других основных физических свойств.
В современной физике выделяют следующие агрегатные состояния: твёрдое тело, жидкость, газ, плазма (ранее им соответствовали: Земля, Вода, Воздух, Огонь).
Понятие агрегатного состояния достаточно условно — существуют аморфные тела, сохраняющие структуру жидкости и обладающие небольшой текучестью; высокоэластичные состояния некоторых полимеров, представляющие нечто среднее между стеклообразным и жидким состоянием, жидкие кристаллы и другие.
![]() Твёрдое
тело:
Состояние,
характеризующееся способностью сохранять
объём и форму. Атомы твёрдого тела
совершают лишь небольшие колебания
вокруг состояния равновесия. Атомы и
молекулы твердых тел колеблются около
определенных положений равновесия.
Поэтому твердые тела сохраняют и объем,
и форму. Если мысленно соединить центры
положений равновесия атомов или ионов
твердого тела, то получится кристаллическая
решетка.
Твёрдое
тело:
Состояние,
характеризующееся способностью сохранять
объём и форму. Атомы твёрдого тела
совершают лишь небольшие колебания
вокруг состояния равновесия. Атомы и
молекулы твердых тел колеблются около
определенных положений равновесия.
Поэтому твердые тела сохраняют и объем,
и форму. Если мысленно соединить центры
положений равновесия атомов или ионов
твердого тела, то получится кристаллическая
решетка.
Жидкость: Состояние вещества, при котором оно обладает малой сжимаемостью, то есть хорошо сохраняет объём, однако неспособно сохранять форму. Молекулы жидкости расположены почти вплотную друг к другу. Поэтому жидкости очень плохо сжимаются и сохраняют свой объем. Жидкость легко принимает форму сосуда, в которую она помещена. Атомы или молекулы жидкости совершают колебания вблизи состояния равновесия, запертые другими атомами, и часто перескакивают на другие свободные места.
Газ: Газ (французское gaz, происшедшее от греческого chaos — хаос) состояние, характеризующееся хорошей сжимаемостью, отсутствием способности сохранять как объём, так и форму. Молекулы в газе движутся хаотично (беспорядочно). В газах расстояние между атомами или молекулами в среднем во много раз больше размеров самих молекул. Молекулы в газе движутся с большими скоростями (сотни м/с). Сталкиваясь, они отскакивают друг от друга как абсолютно упругие шарики, изменяя величину и направление скоростей. При больших расстояниях между молекулами силы притяжения малы и не способны удержать молекулы газа друг возле друга. Поэтому газы могут неограниченно расширяться. Газы легко сжимаются, среднее расстояние между молекулами при этом уменьшается, но все равно остается большим их размеров. Газы не сохраняют ни формы, ни объема, их объем и форма совпадают с объемом и формой сосуда, который они заполняют. Газ стремится занять весь объём, ему предоставленный. Атомы или молекулы газа ведут себя относительно свободно, расстояния между ними гораздо больше их размеров.
Плазма: Часто причисляемая к агрегатным состояниям вещества плазма отличается от газа большой степенью ионизации атомов. Фазовым состоянием большей части вещества (по массе ок. 99,9 %) во Вселенной является плазма.