
- •По биоорганической химии
- •По биоорганической химии
- •Способы получения алканов
- •Химические свойства алканов
- •Задачи (алканы)
- •Лабораторная работа № 2
- •Поместите в фарфоровую чашечку 2 мл циклогексена и подожгите. (Опыт выполняется под тягой). Проследите за характером пламени. Наблюдения и выводы запишите в журнал.
- •Задачи (алкены)
- •2. С какими из приведенных соединений реагируют бутен-1 в указанных условиях?
- •H2o, 20c; 7) Br2 / 20c (в темноте); 8) hBr. 9) Na . Напишите уравнения реакций.
- •Лабораторная работа № 3
- •Задачи (алкины)
- •Задачи (диены)
- •Ароматические углеводороды
- •Химические свойства ароматических соединений
- •Лабораторная работа № 4
- •Задачи (ароматические углеводороды)
- •Галогенопроизводные углеводородов
- •Химические свойства алифатических галогенопроизводных
- •Лабораторная работа № 5
- •Задачи (галогенопроизводные)
- •Спирты и фенолы
- •Методы получения спиртов
- •Методы получения фенола
- •Химические свойства спиртов
- •Химические свойства фенола
- •Лабораторная работа № 6
- •Задачи (спирты, фенолы)
- •Альдегиды и кетоны
- •Методы получения альдегидов и кетонов
- •Лабораторная работа № 7
- •Задачи (альдегиды и кетоны)
- •Карбоновые кислоты
- •Методы синтезы кислот
- •Химические свойства карбоновых кислот
- •Лабораторная работа №8
- •Задачи (карбоновые кислоты)
- •Задачи (оксикислоты)
- •Методы получения аминов
- •Химические свойства аминов
- •Химические свойства анилина
- •Задачи (амины)
- •Аминокислоты
- •Методы получения аминокислот
- •Задачи (аминокислоты)
- •Углеводы
- •Химические свойства моноз
- •Лабораторная работа № 9
- •Задачи (углеводы)
Ароматические углеводороды
Ароматическими углеводородами называются углеводороды, содержащие одно или несколько бензольных ядер. Типичным представителем ароматических углеводородов является бензол (С6Н6).
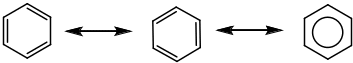
Необходимым условием проявления ароматических свойств являются:
Наличие плоской циклической структуры с сопряженными двойными связями.
Количество электронов в системе должно подчиняться правилу Хюккеля (4n+2); n0.
Поскольку арены достаточно стабильны, они содержатся в значительных количествах в некоторых сортах нефти.
Способы получения бензола
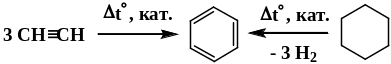
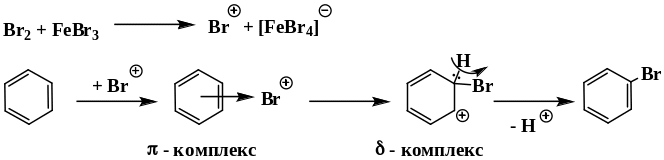
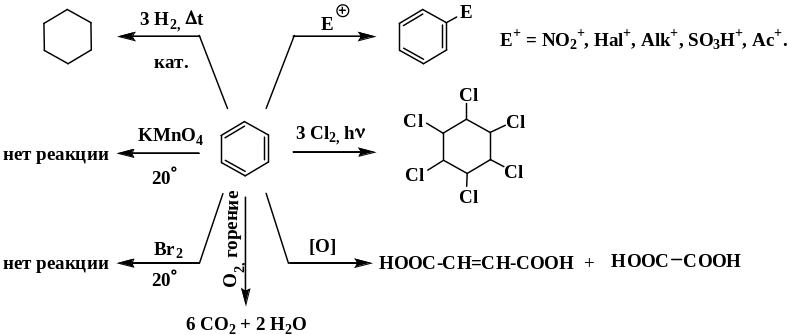
Химические свойства аренов определяются наличием устойчивой сопряженной системой -связей. Отличительная их особенность – устойчивость к окислителям и действию галогенов в обычных условиях. Таким образом, бензол и другие представители аренов не обесцвечивают бромную воду и раствор перманганата калия при контакте с ним в обычных условиях. Для ароматических углеводородов характерны реакции электрофильного замещения. Они проистекают в несколько стадий, промежуточными частицами являются - и - комплексы.
Электронодонорные заместители (алкил, NH2-, HO-, галогены) повышают электронную плотность в ароматическом ядре, облегчая реакцию электрофильного замещения. Они направляют замещение в орто- и пара-положения.
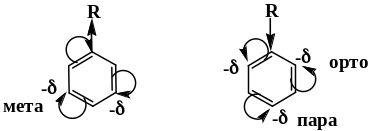
Электроакцепторные заместители (NO2-, -COOH, -SO3H, -+NH3) затрудняют электрофильное замещение и направляют заместитель в мета-положение, где электронная плотность повышена по сравнению с орто- и пара-положениями.
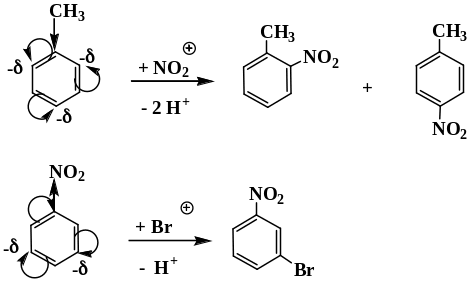
Для ароматических соединений в жестких условиях возможно также радикальное присоединение по двойным связям Cl2, Br2, H2.
Химические свойства ароматических соединений
Лабораторная работа № 4
Опыт 1. Горение ароматических соединений.
Поместите в фарфоровые чашечки под тягой 2 мл толуола и 1 г нафталина. Подожгите и наблюдайте характер пламени. Запишите реакции горения.
Опыт 2. Взаимодействие толуола с бромной водой и раствором перманганата калия.
В две пробирки налейте по 1 мл толуола и добавьте в одну 1 мл бромной воды, а в другую – 1 мл раствора перманганата калия. Обе пробирки встряхните. Наблюдения и выводы запишите в лабораторный журнал. Обратите внимание на то, что толуол легче воды.
Опыт 3. Нитрование толуола.
В плоскодонную колбу на 10 мл налейте 2 мл концентрированной серной кислоты и 1 мл концентрированной азотной кислоты. Полученную нитрующую смесь охладите до комнатной температуры. Прилейте к ней 1 мл толуола. Закройте пробкой и энергично встряхивайте в течение 5-6 минут. Затем вылейте смесь в стакан с холодной водой. Образовавшая смесь орто- и пара-нитротолуолов собирается на дне стакана в виде желтоватых маслянистых капель. Наблюдения и выводы запишите в лабораторный журнал.
Опыт 4. Бромирование толуола.
1. Налейте в пробирку 1 мл толуола и 2 мл бромной воды. Смесь нагрейте на водяной бане в течение 5 минут (до полного обесцвечивания бромной воды). Опустите полоску фильтровальной бумаги в раствор. Затем выньте ее и подсушите. Образовавшийся бромистый бензил можно обнаружить по резкому запаху. Наблюдения и выводы запишите в лабораторный журнал.
2. Налейте в пробирку 2 мл толуола, 2 мл бромной воды и прибавьте на кончике шпателя немного железных опилок. Смесь нагрейте на водяной бане в течение 5 минут (до полного обесцвечивания бромной воды). Опустите полоску фильтровальной бумаги в раствор. Затем выньте ее и подсушите. Образовавшиеся орто- и пара-бромтолуол обнаруживается по характерному ароматическому запаху. Наблюдения и выводы запишите в лабораторный журнал.
