
- •Конспект лекций по курсу «Аналитическая химия и физико-химические методы анализа» Лекция 1
- •1. Аналитическая химия как наука
- •2. Методы аналитической химии
- •3. Значение аналитической химии в решении практических задач пищевой промышленности и оценке состояния окружающей среды
- •4. Из истории аналитической химии
- •Равновесия в гомогеннЫх системах
- •Растворы
- •Закон действия масс и следствие из него
- •Теории электролитов
- •Расчет рН водных растворов
- •Сильные кислоты:
- •Сильные основания:
- •Слабые кислоты:
- •Слабые основания
- •Буферные смеси
- •Количественный анализ
- •3.Требования к реакциям, применяемым в титриметрии:
- •Протолитометрия
- •1.В основе метода находится реакция нейтрализации
- •2. Рабочие растворы
- •Indicare (лат.) – показывать, обнаруживать.
Протолитометрия
(рН-метрия, кислотно-основное титрование)
План:
Сущность метода, классификация метода.
Стандартные вещества, рабочие растворы, определяемые соединения.
Кислотно-основные индикаторы (рН-индикаторы)
История рК-индикаторов
Теория индикаторов
Кривые титрования метода рН-метрии
Практическое применение метода рН-метрии.
1.В основе метода находится реакция нейтрализации
Н3О+ + ОН- 2Н2О
Н+ + ОН- - Н2О
Если рассматривать как протолитометрию, то происходит реакция передачи протона от титранта к титруемому веществу или наоборот.
Различают методы алкалиметрии – титрование раствором основания и ацидометрию –титрование кислотой.
2. Рабочие растворы
НСl Н2SO4
NaOH KOH
концентрации 0,05 -1,0 моль/дм3
Растворы кислот более устойчивы, щелочи поглощают СО2 и взаимодействуют со стеклом – хранить в парафинированной или полиэтиленовой посуде и периодически уточнять титр раствора.
Стандартные растворы – из стандартных веществ в алкалиметрии Н2С2О4∙2Н2О, бензойная кислота, гидрофталат калия и т.д.
в ацидиметрии – Nа2СО3 (сода), Nа2В4О7·10Н2О (бура).
Стандартизировать растворы можно по соответствующим фиксанальным растворам.
Indicare (лат.) – показывать, обнаруживать.
Первоначально в качестве индикаторов применялись природные красители – вытяжки из лепестков и других частей растений (см. случай Р.Бойлем) или без индикатора – при титровании карбонатов.
Наиболее употребительны органические красители, изменяющие окраску в зависимости от рН раствора, поэтому они называются рН-индикаторами.
Требования к рН-индикаторам
- при близких значениях рН окраска должна быть значительно различима;
- окраска должна изменяться мгновенно и обратимо;
- должна быть интенсивной;
- количество реагента для изменения окраски должно быть минимальным.
Классификация индикаторов
по цвету:
- одноцветные (ф-ф);
- двуцветные (м-о);
- полихромные (универсальный индикатор).
по силе:
условно различают индикаторы : сильные (рК<7) и слабые (рК>7).
Теория индикаторов
Ионная теория индикаторов (Оствальда).
Индикатор – слабая кислота или основание

НInd Н+ + Ind-
НInd – кислотная форма, Ind- - кислотная основная формы имеют различную окраску
Кр
=
![]() ; [H+]
=
; [H+]
=
![]()
рН =рК + lg![]()
Основное уравнение ионной теории индикаторов показывает как рН влияет на соотношение концентраций основной и кислотной форм индикатора.
Если Сосн..> Скисл. – окраска будет соответствовать основной форме;
если Скисл > Сосн - окраска кислотной формы;
если Скисл = Сосн - смесь окрасок.
рН = рК = рТ - показатель титрования.
Глаз
человека чувствует изменение окраски,
если
![]() 10:1 или 1:10, т.е. рН = рК ± 1
10:1 или 1:10, т.е. рН = рК ± 1
рН от рК +1 до рК – 1 – интервал перехода окраски индикатора - интервал рН в которм происходит изменение окраски.
На самом деле рН несколько меньше.
Недостатки теории Оствальда – не объясняет почему окраска меняется немгновенно.
Хромоформная теория индикаторов
Объясняет связь изменения окраски индикатора с изменением структуры вещества (происходит таутомеризация):
1 и2 – таутомеры, соответственно бензольная структура и хиноидная структура;
Чтобы вещество было окрашено в молекуле должны быть хромофоры – группы атомов, сообщающие окраску.
Чтобы окраска была более интенсивной – должны присутствовать ауксохромы – группы, усиливающие окраску –ОН, -NН2, -СООН.
Ионно-хромофорная теория
Таутомеры могут быть либо кислотами, либо основаниями
Индикаторные ошибки
-на смещение равновесия требуется избыток титранта;
если раствор индикатора готовят в органическом растворителе, то происходит изменение степени диссоциации;
субъективные ошибки – восприятие глаза человека освещенности;
Ошибки могут быть за счет перетитровывания – т.е. индикатор меняет окраску после добавления избытка титранта.
Ошибки за счет недотитровывания – индикатор меняет окраску до достижения точки эквивалентности.
Одним из примеров выбора индикатора – метод кривых титрования.
Кривые кислотно-основного титрования
Титрование сильной кислоты сильным основанием и наоборот
f, % |
[H+] |
[OH–] |
р |
0 |
10–1 |
|
1 |
90 |
10–2 |
|
2 |
99 |
10–3 |
|
3 |
99,9 |
10–4 |
|
4 |
100 |
10–7 |
10–7 |
7 |
100,1 |
|
10–4 |
10 |
101 |
|
10–3 |
11 |
110 |
|
10–2 |
12 |
скачок от 4 до 10
т.э. совпадает с т.н., линия эквивалентности. совпадает с линией нейтральности, можно применять ф-ф и м-о.
Изменение концентрации в 10 раз приводит к уменьшению и возрастанию скачка соответственно на 2 единицы.
f, % |
[H+] |
[OH–] |
рН |
0 |
10–12 |
10–2 |
12 |
90 |
10–11 |
10–3 |
11 |
99 |
10–10 |
10–4 |
10 |
99,9 |
10–9 |
10–-5 |
9 |
100 |
|
|
|
100,1 |
10–-5 |
|
5 |
101 |
10–4 |
|
4 |
110 |
10–3 |
|
3 |
0,001 М
8
7
6
0,0001 М
̃ 7
7
̃ 7
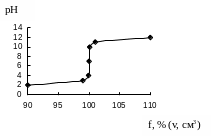
Кривая титрования слабой кислоты сильным основанием
f |
Что в колбе |
Формула для расчета |
рН |
0 |
0,1 м АсН |
рН = 1/2рКа- 1/2lgСа |
2,9 |
50 |
50 АсН 50 АсNa |
|
4,8 |
90 |
10 АсН 90 АсNa |
|
5,8 |
99 |
1 АсН 99 АсNa |
рН = рКа -
lg |
6,8 |
99,9 |
0.1 АсН 99.9 АсNa |
|
7,8 |
100 |
АсNa избыток NаОН |
рН =7+1/2рКа + ½ lgСс |
8,9 |
100,1 |
0,1 |
|
10 |
101 |
1 |
рН = 14 + lgС0 |
11 |
110 |
10 |
|
12 |
Скачок уменьшается с возрастанием рКа
Кривая титрования слабого основания сильной кислотой
f |
Что в колбе |
Формула для расчета |
рН |
0 |
0,1м NН4ОН |
14–1/2рКв + 1/2lgСв |
12,1 |
50 |
50% NН4ОН 50% NН4СI |
|
9,2 |
90 |
10% NН4ОН 90% NН4СI |
|
8,2 |
99 |
1% NН4ОН 99% NН4СI |
рН=14–рКв
+ lg
|
7,2 |
99,9 |
0,1% NН4ОН 99,9% NН4СI |
|
6,2 |
100 |
100% NН4СI |
|
5,1 |
100,1 |
0,1% HCI |
|
4 |
101 |
1% HCI |
рН = –lgСк |
3 |
Титрование слабой кислоты слабым основанием
нет скачка – при визуальном фиксировании т.с. титрование невозможно
Титрование многоосновных кислот
Н3РО4 К1i=10–2
К2i=10–7
К3i=10–13 3 скачка
Титрование смесей – оттитровывается сначала сильная кислота, затем слабая, аналогично – основания.
Можно оттитровать,
если
![]()
Nа2СО3 + NаОН 1) + фенолфталеин – весь NаОН и 1/2 Nа2СО3 до СО2
2) + метиловый оранжевый
остаток Nа2СО3 до СО2
ВЫВОДЫ
Кривые титрования строятся для выбора индикатора.
Кривая титрования имеет скачкообразный вид, скачок наблюдается вблизи точки эквивалентности, он зависит от
величины Кi (рК) титруемого вещества и титранта, чем больше рК, тем больше скачок
от концентрации растворов титруемого вещества и титранта, чем больше С, тем больше скачок
При титровании многоосновных кислот на кривых титрования несколько скачков, если Кi по ступеням различаются на 4 порядка.
При титровании в среде органических растворителей может изменяться сила кислот и оснований, что приводит к изменению скачка кривой титрования.

 Н
Н