
- •Конспект лекций по курсу «Аналитическая химия и физико-химические методы анализа» Лекция 1
- •1. Аналитическая химия как наука
- •2. Методы аналитической химии
- •3. Значение аналитической химии в решении практических задач пищевой промышленности и оценке состояния окружающей среды
- •4. Из истории аналитической химии
- •Равновесия в гомогеннЫх системах
- •Растворы
- •Закон действия масс и следствие из него
- •Теории электролитов
- •Расчет рН водных растворов
- •Сильные кислоты:
- •Сильные основания:
- •Слабые кислоты:
- •Слабые основания
- •Буферные смеси
- •Количественный анализ
- •3.Требования к реакциям, применяемым в титриметрии:
- •Протолитометрия
- •1.В основе метода находится реакция нейтрализации
- •2. Рабочие растворы
- •Indicare (лат.) – показывать, обнаруживать.
Расчет рН водных растворов
Сильные кислоты:
НА + Н2О → Н3О+ + А–; (НCl +Н2О = Н3О+ + С1–)
[H+] = [HA] =[H3O+]
рН = lg[HA].
При концентрации кислоты ск ≤ 10–5 моль/дм3 рН рассчитывают с учетом ионного произведения воды:
[H+]
= ск +
![]() .
.
[H+]
=
![]() .
.
Получить индивидуальное задание по качественному анализу у преподавателей (см. учебный стенд!) |
Самостоятельная работа. Вычислить рН раствора азотной кислоты с концентрацией 10–7 моль/дм3 с учетом и без учета автопротолиза воды. |
Сильные основания:
В + 2Н2О → ВН3О+ + ОН–;
NaOH → Na+ + OH–;
[OH–] = сВ;
рН = 14 + lgсВ.
Слабые кислоты:
НА +Н2О Н3О + А–
Кр =
![]()
Кр [H2O]=
Ка=
![]()
[H3O+] = [A–]
Ка
=
![]()
[H3O+]
= [H+]
=
![]()
рН = ½ рКа – ½ lgСк
Слабые основания
(NН4ОН, пиридин)
В + 2Н2О ВН3О+ + ОН– В + Н2О = ВН+ + ОН–
Кр =
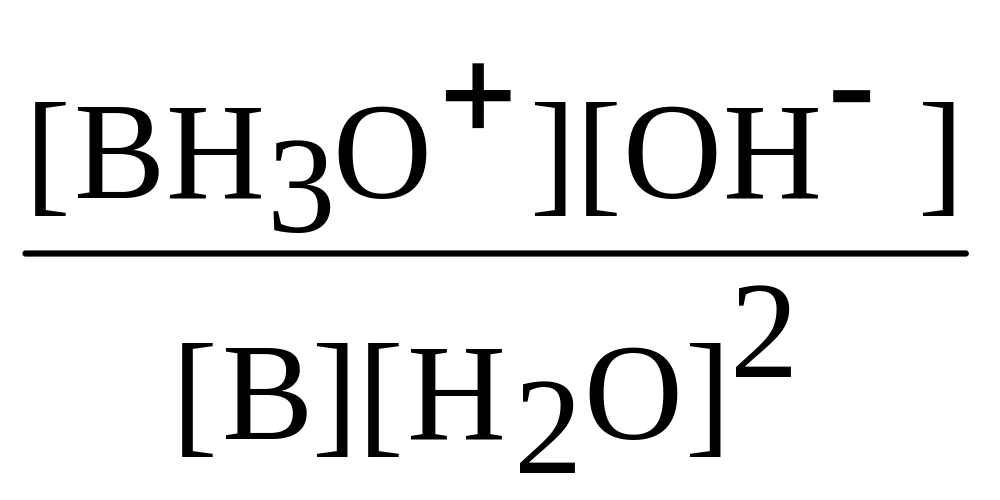 Кр[H2O]2
= Kв
Кр[H2O]2
= Kв
Кв=
![]() [BH3O+]
= [OH]
[BH3O+]
= [OH]
Кв
=
![]()
[OH–]
=
![]() рОН = 1/2рКв
–1/2 lgСосн
рОН = 1/2рКв
–1/2 lgСосн
рН = 14 – ½ рКb + ½ lgСo
Расчет рН солей
а) негидролизующиеся соли: NаС1, NaNO3, Na2SO4 – рН = 7
б) гидролизующиеся соли – соли слабых кислот и/или оснований (гидролиз – взаимодействие ионов соли с водой, образуются слабые электролиты, при этом изменяется рН):
по аниону, рН > 7
СН3СООNa + H2O СН3СООН + NaОН,
CH3COO– + H2O СН3СООН + ОН–,
по катиону, рН < 7
NH4Cl + H2O NH4ОН + НCl,
NH4+ + H2O NH4ОН + Н+;
по катиону и аниону, рН 7
NH4CH3COO + H2O NH4ОН + CH3COOН,
NH4+ + CH3COO– + H2O NH4ОН + CH3COOН.
Согласно теории Бренстеда–Лоури СН3СОО– – слабое сопряженное основание слабой кислоты СН3СООН:
рН = 14 – 1/2рКв + 1/2lgсв
рКв + рКа = 14
св = ссоли
рН = 14 –1/2(14 – рКа) + 1/2lgссоли
рН = 7 + 1/2рКа + 1/2lgссоли.
NH4+ – слабая сопряженная кислота слабого основания NH4ОН:
рН = 1/2рКа – 1/2lgса
рКа = 14 – рКв
рН = 7 – 1/2рКв – 1/2lgссоли.
Соль слабые кислоты и слабого основания
рН = 1/2рКw + 1/2рКа – 1/2рКв
Буферные смеси
Понятие буферной смеси ввел Ван-Слайк – биохимик, в организме человека и животных протекают процессы гомеостаза, т.е. поддержания рН крови на определенном уровне. Незначительные изменения рН плазмы крови вызывают патологические изменения (ацидоз, алкалоз).
В аналитической химии использование буферных смесей связано с тем, что многие реакции протекают только при определенном значении рН раствора, изменение рН приводит к смещению химического равновесия в противоположную сторону.
Буферный раствор – это смесь слабой кислоты или основания с их солями. Согласно теории Бренстеда-Лоури буферные растворы – это смеси сопряженных кислот и оснований.
Кислотные буферные растворы:
Основные буферные растворы:
Смеси солей многоосновных кислот.
Механизм буферного действия
СН3СООН NaOH
СН3СОО– НС1
NH4OH HC1
NH4+ NaOH
Буферная емкость – количество кислоты или основания, необходимое для изменения рН раствора на 1.
=
+![]()
= –
= –![]() max
max
Са = Св
Расчет рН буферной кислоты
НА – кислота
А– – сопряженное основание
Н2О + НА Н3О+ + А–
Ка =
![]() [B] = Cb
[B] = Cb
[HA] = Ca
[H+]
= Ka![]()
![]()
рН =
рКа
+ lg![]() Формула Гендерсона Хансельбаха
Формула Гендерсона Хансельбаха
рН =
рКа
– lg![]() СН3СООН
СН3СООН
СН3СООNa
рКа
+ рКв
= рКw рН
= рКw
– рКв
+ lg![]()
NH4OH – основание
NH4C1 – сопряженная кислота
Дома: Рассчитать рН аммонийной буферной смеси Са = Св = 0,1 моль/дм3,если кней добавили 0,05 моль/дм3 НС1
рН =
14 – рКв
+ lg![]()
При расчете рН концентрация должна быть выражена в единицах молярной концентрации эквивалента.
