
- •Конспект лекций по курсу «Аналитическая химия и физико-химические методы анализа» Лекция 1
- •1. Аналитическая химия как наука
- •2. Методы аналитической химии
- •3. Значение аналитической химии в решении практических задач пищевой промышленности и оценке состояния окружающей среды
- •4. Из истории аналитической химии
- •Равновесия в гомогеннЫх системах
- •Растворы
- •Закон действия масс и следствие из него
- •Теории электролитов
- •Расчет рН водных растворов
- •Сильные кислоты:
- •Сильные основания:
- •Слабые кислоты:
- •Слабые основания
- •Буферные смеси
- •Количественный анализ
- •3.Требования к реакциям, применяемым в титриметрии:
- •Протолитометрия
- •1.В основе метода находится реакция нейтрализации
- •2. Рабочие растворы
- •Indicare (лат.) – показывать, обнаруживать.
Количественный анализ
Цель количественного анализа – определение массы или концентрации вещества в пробе раствора.
План:
Классификация методов количественного анализа.
Титриметрический метод анализа.
Требования к химической реакции в титриметрическом методе анализа.
Способы отбора пробы при титровании.
Способы (методы) выполнения титрования.
Растворы. Приготовление.
Фиксирование точки эквивалентности, кривые титрования.
1 Количественный анализ с применением классических химических методов выполняются либо гравиметрически, либо титриметрически.
Гравиметрический (весовой) анализ основан на установлении массы вещества или какого-либо его производного в анализируемой пробе (растворе) с использованием аналитических весов.
Этот анализ может быть основан 1) на реакциях осаждения определенного иона или 2) в его основе находятся процессы дистилляции (перегонки). В любом случае окончательный результат получают посредством установления массы осадка или дистиллята.
Метод гравиметрии точен, но длителен.
Титриметрический метод анализа основан на регулированном прибавлении раствора одного вещества к раствору другого вещества.
Метод титриметрии экспрессен (быстро получают результаты), но менее точен.
Раствор, содержание вещества в котором точно известно называется стандартным (титрованным), если его концентрацию устанавливали в ходе титрования.
Стандартизованным раствор (рабочий раствор) помещают в бюретку , им титруют, поэтому он называется титрантом.
Титрант к титруемому раствору добавляют порциями. Этот процесс называют титрование. При этом количество титруемого вещества должно быть равно количеству вещества титранта.
n1 = n2
Момент окончания реакции в титровании называют точкой стехиометричности (эквивалентности) – может быть зафиксировано с индикатором, без индикатора или инструментально.
По типу химической реакции методы титриметрии различают:
1. кислотно-основные (протолиметрия) ОН– + Н+ Н2О
2. окислительно-восстановительные (редоксиметрия) Ox + e Red
3. комплексонометрические (комплексонометрия) А + В [AB]
4. осадительное титрование А + В АВ
3.Требования к реакциям, применяемым в титриметрии:
Реакция должна быть необратимой, т.е. проходить практически до конца, Кр 1.
Проходить в строго эквивалентных соотношениях.
Точка стехиометричности должна легко фиксироваться.
Отсутствие побочных реакций.
Вспомогательные вещества (индикаторы), буферные смеси и т.д. не должны мешать основной реакции.
4. По спосбу отбора пробы для титрования различают
Метод пипетирования – проба в жидком агрегатном состоянии отбирают пипеткой, титруют, расчет по
vxcx = vт-таст-та
Метод точной навески – пробу в любом агрегатном состоянии взвешивают на аналитических весах, растворяют, если это необходимо в подходящем растворителе и титруют, расчет ведут по формуле:
![]() .
.
5 Способы титрования:
– прямой
– косвенный
по избытку (по остатку)
метод замещения
В ходе прямого титрования титрант непосредственно реагирует с веществом титруемого раствора.
В ходе косвенных методов титрант не взаимодействует непосредственно с титруемым веществом, т.к. невозможно либо зафиксировать точку стехиометричности, либо реакция протекает нестехиометрично, либо медленно, т.е. не выполняются требования к химическим реакциям.
По избытку (остаток) А + Визб. АВ + Визб.остаток
В + Т ВТ
Заместительное А + В С
С + Т СТ
na = nc = nт
6. Стандартные растворы – концентрация известна
По навеске стандартного вещества – в мерной колбе (первичный стандарт)
Из стандартного раствора с большей концентрацией (пипетка, мерная колба)
Титрование нестандартного раствора (стандартизовано)
Из фиксанала (первичный стандарт).
7.Фиксирование точки стехиометричности
визуальное
с помощью прибора (инструментальное)
Визуальное с помощью индикатора и безиндикаторное (индикаторное – если титрант, титруемый раствор, продукты реакции бесцветны); безиндикаторный – если одно из веществ окрашено.
Важно правильно выбрать индикатор. Существует много методов их выбора, наиболее надежен метод кривых титрования.
Кривая титрования – зависимость изменяющегося в ходе титрования функции от объема прилитого титранта или степени оттитрованности.
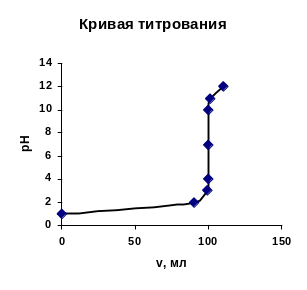
Для индикатора должен быть известен интервал перехода его окраски, то есть в каком интервале значения рН, Е, рМе, рАg он изменяет свою окраску.
Если интервал перехода окраски индикатора входит в величину скачка, то его можно применять для титрования в данном конкретном случае.
Скачок – резкое изменение функции вблизи точки стехиометричности. Величина скачка определяется необходимой точностью титрования, если точность 0,1% (обычно),то величина скачка от f=99.9 до 100,1;
если 1% до f=99 -101.
Скачок зависит от:
природы реагирующих веществ: Кi, Е, Кн, Кs;
концентрации;
температуры;
некоторых других факторов (ионная сила, растворитель и т.д.,комплексообразователь).
