
- •Конспект лекций по курсу «Аналитическая химия и физико-химические методы анализа» Лекция 1
- •1. Аналитическая химия как наука
- •2. Методы аналитической химии
- •3. Значение аналитической химии в решении практических задач пищевой промышленности и оценке состояния окружающей среды
- •4. Из истории аналитической химии
- •Равновесия в гомогеннЫх системах
- •Растворы
- •Закон действия масс и следствие из него
- •Теории электролитов
- •Расчет рН водных растворов
- •Сильные кислоты:
- •Сильные основания:
- •Слабые кислоты:
- •Слабые основания
- •Буферные смеси
- •Количественный анализ
- •3.Требования к реакциям, применяемым в титриметрии:
- •Протолитометрия
- •1.В основе метода находится реакция нейтрализации
- •2. Рабочие растворы
- •Indicare (лат.) – показывать, обнаруживать.
4. Из истории аналитической химии
В древности умели анализировать благородные металлы по их удельному весу, пробирный камень применяли для определения чистоты золота.
Как наука возникла из алхимии, просуществовавшей 1,5 тысячи лет (поиск философского камня).
Понятие «химический анализ» впервые упомянул Роберт Бойль в 1654 г., он же ввел понятие об элементах.
В 18 в. шведский химик Т. Бергман сформулировал основные различия между качественным и количественным анализом.
Начало периода научной химии соответствует концу 18 – началу 19 века, в это время французский химик А. Лавуазье открыл кислородную теорию горения, закон сохранения вещества, ввел понятия между элементами и соединениями. В это же время произошло становление стехиометрических законов.
В России развитие аналитической химии началось с 1583 г – по указу Ивана Грозного открыты аптеки.
В 1744 г М.В. Ломоносов создал первую химическую лабораторию в России.
В 1756 г М.В.Ломоносов открыл закон сохранения массы вещества – первый основополагающий закон химии.
Наиболее интенсивное развитие аналитической химии началось в 19 веке в связи с ростом производства.
Равновесия в гомогеннЫх системах
План:
|
Аналитик должен разбираться в методах и аппаратуре, используемых для анализа, должен понимать принципиальные основы анализа, уметь применять, а если надо усовершенствовать методику…, должен уметь оценивать и интерпретировать результаты анализа (Дж. Фритц, Г. Шенк «Количественный анализ»). |
Растворы
Химические реакции – основа химического анализа. Большинство химических реакций протекает в гомогенных системах – растворах. Гомогенные системы (истинные растворы) не содержат взвешенных частиц и состоят из 2-х или нескольких компонентов, в любой части раствора химические и физические свойства его одинаковы.
Качественной характеристикой раствора является его состав. Количественная характеристика раствора – концентрация вещества.
Основные способы выражения концентрации вещества:
массовая доля – число граммов вещества в 100 граммах раствора, выражается в процентах, обозначение (H2SO4);
титр – число граммов или миллиграммов вещества в 1 см3 раствора, Т(H2SO4), г/см3, мг/см3;
молярная концентрация – число моль вещества (количество вещества) в 1 дм3 раствора, с(H2SO4), моль/дм3;
молярная концентрация эквивалента число моль-эквивалентов вещества (количество вещества) в 1 дм3 раствора, с(1/2H2SO4), моль/дм3 .
Закон действия масс и следствие из него
Любую реакцию можно охарактеризовать с 2-х позиций.
С термодинамической точки зрения реакции характеризуются состоянием равновесия – при постоянной температуре устанавливаются постоянные во времени равновесные концентрации участников реакции.
С кинетической точки зрения реакцию можно охарактеризовать скоростью ее протекания.
В 1884 году Гульдберг и Вааге установили закон действия масс:
скорость реакции прямо пропорциональна концентрации реагирующих веществ.
Для реакции
А + В
![]() С + D,
С + D,
скорость прямой () и обратной () реакции равны:
V = kсА сb,
V = kсс сd,
где k – константа скорости химической реакции
При установившемся равновесии V = V, тогда
k сА сb = k сС сd,
![]() =
К,
=
К,
где K – константа химического равновесия.
Закон химического равновесия (следствие закона действия масс):
при установлении химического равновесия отношение произведения концентраций продуктов реакции к произведению концентраций реагирующих веществ есть величина постоянная для данной реакции в данных условиях.
В реакции со стехиометрическими коэффициентами отличными от 1
аА + bВ сС + dD
К =
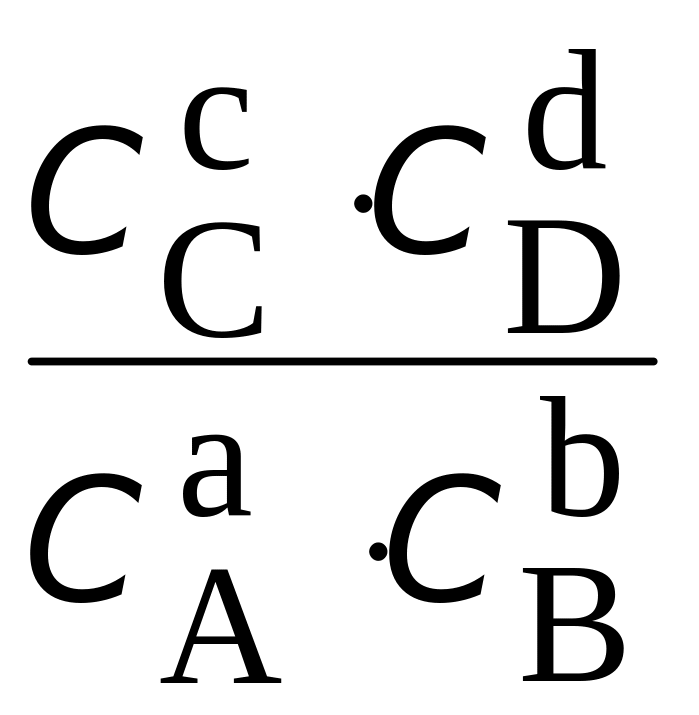
Реакция протекает практически до конца, если соблюдается условие
К >> 1.
Константы химического равновесия К называется концентрационной, если она рассчитывается с применением концентраций реагирующих веществ.
В реальных условиях реагирующие частицы часть своей энергии затрачивают на взаимодействие с соседними частицами (молекулами, ионами), диполярным растворителем, такое взаимодействие учитывают при использовании вместо значений концентраций величины активностей.
Активность (а) – часть энергии, которую реагирующая частица способна проявлять при химических взаимодействиях:
а = f c,
где f – коэффициент активности, он характеризует меру электростатического взаимодействия реагирующих частиц друг с другом и с растворителем.
Для бесконечно разбавленных растворов f = 1, а = с.
Термодинамическую константу равновесия рассчитывают с учетом активностей реагирующих веществ (ионов):
К = -
-
В растворах электролитов коэффициент активности, зависит от ионной силы раствора:
μ = 1/2Σсi·zi2,
где сi и zi – соответственно концентрации и заряды i-х ионов.
Термодинамические константы зависят от температуры и природы растворителя.
Константа диссоциации электролитов, константа реакции гидролиза и т.д. – частные примеры констант равновесия.
