
- •3.2.Методические указания
- •3.3.Учебные пособия
- •1. Классификация маркировка и применение
- •1.1. Классификация материалов
- •1.2.Способы маркировки металлических материалов
- •1.3.Углеродистые стали
- •1.3.1. Конструкционные углеродистые стали
- •1.3.2.Качественные конструкционные углеродистые стали для деталей машин
- •1.3.3. Инструментальные углеродистые стали
- •1.4. Маркировка легированных сталей
- •1.5.Особые способы маркировки сталей
- •1.5.1. Маркировка сталей для отливок.
- •1.5.2. Маркировка автоматных сталей
- •1.5.3. Стали для подшипников
- •1.5.4. Маркировка быстрорежущих сталей
- •1.5.5. Маркировка строительных сталей.
- •1.5.6. Магнитные стали
- •1.5.7. Стали специальных способов выплавки
- •1.5.8. Нестандартные легированные стали
- •1.6. Чугуны
- •1.7. Порошковые материалы.
- •1.8. Медь и сплавы на основе меди
- •1.8.1. Латуни
- •1.8.2 Бронзы
- •1.9. Алюминий и сплавы на основе алюминия
- •1.10. Магний и сплавы на основе магния
- •1.11. Титан и сплавы на основе титана
- •2. Термический анализ сплавов, построение и анализ диаграмм состояния
- •2.1. Структурные составляющие системы.
- •2.2. Построение диаграмм состояния
- •2.3. Анализ диаграмм состояния
- •Кристаллизация и структурообразование сплавов.
- •3.1.Условия работы и методы испытания материалов
- •3.2. Механические свойства конструкционных материалов
- •3.3. Определение количественных характеристик механических свойств
- •3.3.1. Испытания на статическое растяжение
- •3.3.2 Испытания на твердость
- •3.3.2.1 Твердость по бринелю
- •3.3.2.2 Твердость по роквеллу
- •3.3.2.3 Твердость по виккерсу и микротвердость
- •3.3.3 Связь между твердостью и прочностью материалов
- •4.Стали
- •Приготовление микрошлифов
- •Металлографический микроскоп.
- •Конструкция микроскопа мим – 7
- •Определение величины зерна
- •Определение балла неметаллических включений
- •4.2. Cистема железо-углерод. Диаграмма состояния железо-углерод.
- •Двухфазные составляющие
- •4.3. Структура углеродистой стали в равновесном состоянии.
- •Сплав 4. Эвтектоидная сталь
- •Сплав 3. Доэвтектоидная сталь
- •Зависимость механических свойств стали от содержания углерода
- •5.Чугуны
- •5.1. Структура, свойства и применение чугунов
- •Белые чугуны
- •Применение серых чугунов
- •6. Закалка
- •6.1. Краткие теоретические сведения.
- •7.Отпуск
- •7.1. Превращения при отпуске сталей
- •8. Отжиг
- •Ускоренное охлаждение на воздухе приводит к распаду аустенита при
- •3.4. Справочные материалы
2.2. Построение диаграмм состояния
Сущность термического метода построения диаграммы состояния сводится к определению критических температур при нагревании или охлаждении металлов и сплавов. Критическими называются температуры, при которых происходят фазовые превращения в сплаве (начало и конец кристаллизации, полиморфные превращения и другие).
В процессе охлаждения сплава (рис.1.) вначале скорость охлаждения велика, затем она уменьшается, т.к. происходит кристаллизация одной из фаз, при которой выделяется некоторое количество тепла. При кристаллизации
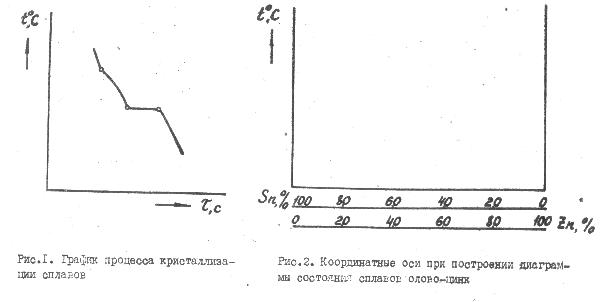
эвтектики происходит остановка охлаждения (площадка на кривой охлаждения), так как выделяемое тепло, в связи с кристаллизацией двух и более фаз одновременно, полностью компенсирует теплоотвод.
При охлаждении сплавов с различным содержанием компонентов получают ряд кривых, изображающих ход процесса охлаждения сплава.
Для двухкомпонентных систем при построении диаграмм по оси ординат откладывается температура, по оси абсцисс - концентрация элементов в сплаве (рис.2).
Общее содержание компонентов в сплаве 100 %, и поэтому каждой точке на диаграмме соответствует определенное содержание компонентов.
Критические температуры начала и конца кристаллизации, полученные при охлаждении сплавов, переносятся на координатные оси "температура-концентрация". Затем плавными линиями соединяются точки начала и конца кристаллизации сплавов. При наличии эвтектики в сплаве точки конца кристаллизации сплавов располагаются на одной прямой при температуре кристаллизации эвтектики (рис.2.4).
С
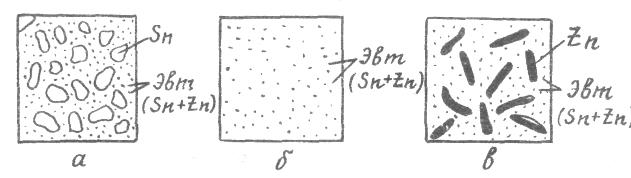
Рис. 2.3. Схематическое изображение структуры системы олово-цинк:
2.3. Анализ диаграмм состояния
По диаграмме состояния можно определить критические точки сплава при нагревании и охлаждении и установить его структуру, выбрать сплав, обладающий наилучшими литейными свойствами, правильно назначить режим термической обработки.
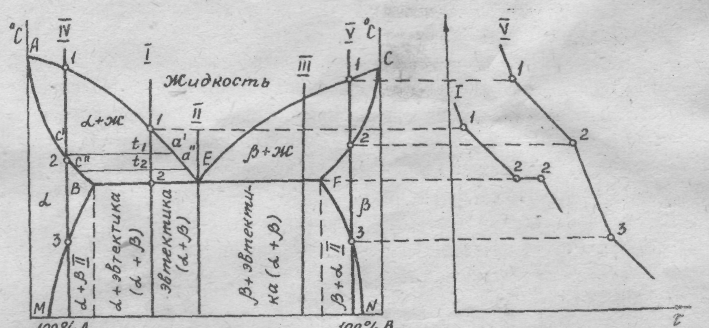
Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют эвтектику (рис. 4):
АЕС - ликвидус, начало кристаллизации сплавов.
ВЕF - солидус, конец кристаллизации сплавов; на этой линии происходит одновременная эвтектическая кристаллизация компонентов А и В при постоянной температуре. Линия называется эвтектической.
АЕ - начало кристаллизации компонента А.
ЕС - начало кристаллизации компонента В.
Точка Е называется эвтектической, в ней происходит одновре- менная кристаллизация компонентов при самой низкой и постоянной температуре.
Кристаллизация и структурообразование сплавов
Сплав I - доэвтектический. Критическая точка I - начало кристаллизации компонента А, две фазы: жидкость и зародыши зерен компонента А.
Критическая точка 2- кристаллизация эвтектики, т.е. из оставшейся к этой температуре жидкости одновременно кристаллизуются компоненты А и В:
![]()
На кривой охлаждения образуется площадка 2-2. Структура сплава после охлаждения состоит из зерен компонента А и эвтектики.
По мере охлаждения сплава между точками I и 2 жидкость меняет свою концентрацию по линии AЕ. Чтобы определить состав твердой и жидкой фаз при заданной температуре t1 сплава I (рис.4), необходимо через точку t1 провести коноду, т.е. прямую линию, параллельную оси концентрации, до пересечения с линиями диаграммы и точки пересечения спроектировать на ось концентрации. Точка пересечения l c линией ликвидус покажет концентрацию компонентов А и В в жидкой фазе, точка S - в твердой (чистый компонент А).

III I
II
Рис. 2.4. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют смесь (эвтектику)
I II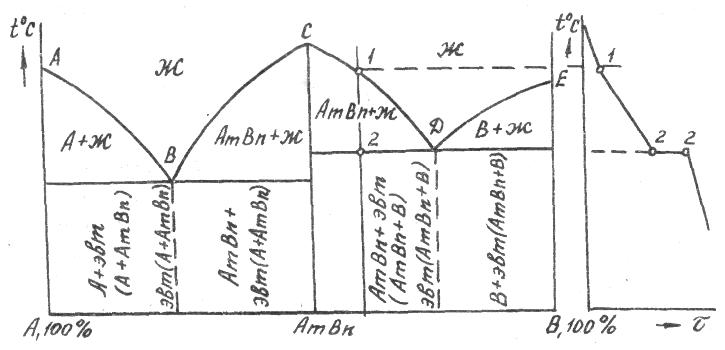
Рис.
2.5. Диаграмма
состояний сплавов, компоненты которой
неограниченно
растворимы в жидком состоянии,
нерастворимы в твердом и при кристаллизации
образуют устойчивое химическое
соединение
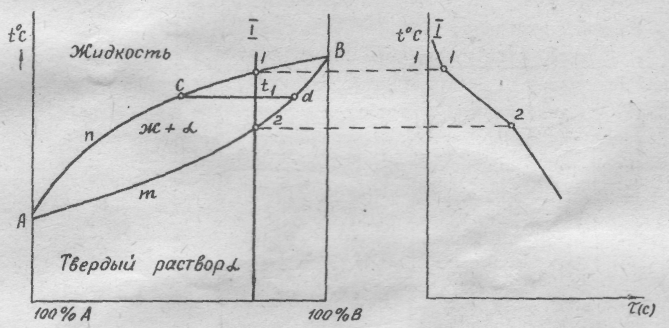
Рис. 2.6. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы друг в друге в жидком и твердом состояниях
100% А
100% В
Рис. 2.7. Диаграмма состояния сплавов, компоненты которой
неограниченно растворимы в жидком состоянии, ограниченно в твердом и при кристаллизации образуют смесь (эвтектику)
Соотношение масс фаз при заданной температуре можно определить по правилу отрезков.
(1)
(2)
(3)
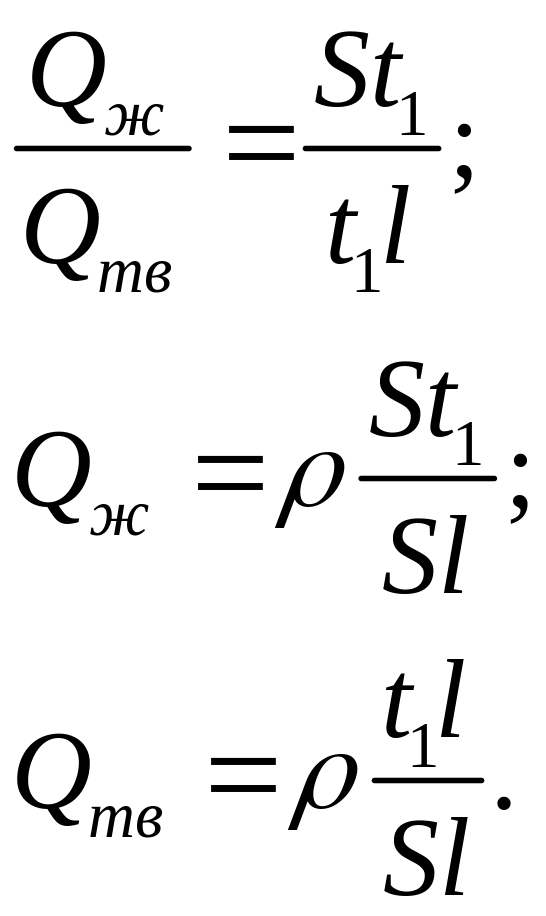
где Р - общая масса сплава.
Сплав II - эвтектический. Критическая точка Е - компоненты А и В кристаллизуются одновременно при постоянной температуре:
Присутствуют 3 фазы: жидкость эвтектического состава, компоненты А и В. На кривой охлаждения образуется площадка 1-1.
Структура сплава после охлаждения состоит из эвтектики (смеси кристаллов компонентов А и В).
Сплав III - заэвтектический. Критическая точка - 1 начало кристаллизации компонента В. Фазы две: жидкость, кристаллы компонента В. По мере охлаждения сплава жидкость меняет концентрацию по линии ликвидус ЕС. Например, при t2 состав жидкости определится точкой n , спроектированной на ось концентраций, а состав твердой фазы - проекцией точки m .
Критическая точка 2 - кристаллизация эвтектики, т.е. из оставшейся к этой температуре жидкости при постоянной температуре кристаллизуются оба компонента:
Структура сплава после охлаждения состоит из зерен компонента В и эвтектики.
Правило фаз Гиббса устанавливает зависимость между числами фаз системы, ее компонентов и степеней свободы:
![]() (4)
(4)
где С - число степеней свободы, или вариантность системы;
К - число компонентов системы;
Ф - число фаз, находящихся в равновесии в данной критической точке.
Под числом степеней свободы понимается число независимых параметров системы, которые можно изменить, не изменяя равновесия, например, температуру без изменения числа фаз. Так как степень свободы не может быть меньше нуля и дробным числом, то
![]()
![]() .
.
Следовательно, в двойной системе в равновесии может находиться не более трех фаз, в тройной - не более четырех и т.д.
Например, определим число степеней свободы у сплава I в 1-й критической точке (рис.4) :
![]()
![]()
т.е. с изменением температуры между точками 1-2 число фаз не изменяется, а происходит переход одной фазы (жидкости) в другую (компонент А). Во второй точке
![]()
т.е. процесс кристаллизации эвтектики идет при постоянной температуре, система нонвариантна. Изменение температуры ведет к изменению количества фаз.
Диаграмма состояния сплавов, компоненты которой растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют устойчивое химическое соединение (рис.2.5)..
Диаграмма рассматривается как совокупность двух диаграмм состояния, где в роли компонента выступает химическое соединение:
I часть диаграммы - компоненты А и АтВn ;
II часть диаграммы - компоненты В и АтВn ;
Обе части диаграммы характеризуются неограниченной растворимостью в жидком состоянии. В твердом они нерастворимы, при кристаллизации образуется эвтектическая смесь, состоящая из кристаллов компонента и химического соединения.
'Диаграмма состояний сплавов, компоненты которой неограничен-' но растворимы друг в друге в жидком и твердом состояниях (рис.2.6):
АnВ - ликвидус, начало кристаллизации твердого раствора;
АтВ - солидус, конец кристаллизации твердого раствора.
