
- •Отчет о научно-исследовательской работе,
- •Реферат
- •Содержание
- •Определения, обозначения и сокращения
- •Введение
- •1 Исследование и разработка технологии получения очищенных растворов хлористого магния и никеля из отходов м. Житикара и очищенных растворов сильвинита из отходов ао «ук тмк»
- •1.1 Объекты исследования и методики проведения экспериментов
- •Методика проведения экспериментов
- •1.1.2 Методика определения магния
- •1.1.3 Методика определения никеля
- •Получение очищенных растворов сильвина из ортх
- •2 Производство искусственного карналлита в печи сушки с получением опытных образцов и исследование процесса экстракции никеля из растворов хлористого магния
- •2.1 Получение искусственного карналлита
- •2.2 Идентификация синтезированного карналлита
- •Обезвоживание
- •Карналлит
- •3 Монтаж оборудования и проведение опытно-промышленных испытаний производства исходных растворов для получения искусственного карналлита
- •3.1 Получение раствора хлорида магния из асбестовых отходов
- •3.2 Получение раствора хлорида калия из ортх
- •3.3 Синтез карналлита из раствора хлорида магния, полученного из асбестовых отходов, и хлорида калия - из отработанных расплавов титановых хлораторов
- •Обезвоживание
- •Карналлит
- •4 Разработка технологического регламента по производству искусственного карналлита
- •Заключение
- •Список использованных источников
1.1.3 Методика определения никеля
Наиболее приемлемым методом определения никеля при небольшом содержании в растворе является фотометрический.
Определению мешают ионы меди, кобальта, железа, алюминия, хрома и марганца. Для удержания их в растворе в виде комплекса вводят лимонную или винную кислоту. Железо выделяют аммиаком, предварительно окислив. Полное отделение никеля от железа достигается двукратным переосаждением. Кобальт, хром и марганец отделяют от никеля введением диметилглиоксима и экстракцией этого комплекса хлороформом из раствора, содержащего лимоннокислый натрий. В хлороформенный слой вместе с никелем переходит медь, ее удаляют путем промывания экстракта разбавленным аммиаком. Затем, промыв экстракт водой, проводят реэкстракцию соляной кислотой. Мешающее действие марганца устраняют введением солянокислого гидроксиламина.
Реактивы. Стандартный раствор соли никеля. Растворяют 0,048 г NiSO4·7H2O или Ni(NO3)2·6 H2O в дистиллированной воде. 1 мл этого раствора содержит 0,1 мг никеля. Рабочий раствор получают разведением стандартного раствора в 10 раз.
Бромная вода – насыщенная бромом дистиллированная вода
Лимонная кислота, 5% раствор
Аммиак, 1:1
Диметилглиоксим, 1% спиртовый раствор
Татрант калия-натрия, 20% раствор
Персульфат аммония
Гидроксиламин солянокислый, 10% раствор
Хлороформ
Определение. В мерную колбу 100 мл отбирают аликвот, разбавляют так, чтобы содержание никеля было не более 0,1 мг никеля. Приливают 5 мл лимонной кислоты, 4 мл бромной воды, по капле аммиак до исчезновения окраски брома и еще 1 мл избытка. В раствор вводят 2 мл 1% раствора диметилглиоксима. Доводят раствор до метки водой. Через 15 мин измеряют оптическую плотность полученного раствора на фотоколориметре с зеленым светофильтром в кювете 20 мл или 50 мл. По калибровочной кривой определяют содержание никеля в растворе по оптической плотности.
Построение калибровочного графика. В мерные колбы на 100 мл отбирают 1,0; 2,0; 3,0…. до 10 мл рабочего стандартного раствора, добавляют дистиллированной воды до 50 мл. А затем добавляют все реактивы, которые добавляют и в пробы. Полученные значения оптической плотности наносят на график.
Ni мг/л = С·1000: V, где
С – концентрация раствора, отснятая по графику;
V – объем воды, взятый на определение; 1000 – пересчет на литр.
1.2 Оптимизация условий и разработка технологии получения
очищенных растворов хлорида магния из асбестовых отходов
Целью этапа работы, согласно календарного плана, является исследование и разработка технологии получения очищенных растворов хлористого магния и никеля из отходов АО «Костанайские минералы», и очищенных растворов сильвина из отходов титано-магниевого производства АО «УК ТМК».
Технологический процесс получения очищенных растворов хлористого магния и никеля из отходов АО «Костанайские минералы» включает следующие основные операции.
Выщелачивание асбестовых отходов.
Цель операции – максимально извлечь в раствор хлорид магния. Подобраны оптимальные условия кислотного выщелачивания АО. За критерий оценки эффективности процесса принято содержание магния в растворе. Результаты исследования приведены на рисунках 1-3. Концентрацию соляной кислоты варьировали от 7 до 25%.
Из представленных данных следует, что с повышением концентрации НСl содержание магния в растворе увеличивается. Однако при концентрации соляной кислоты >20% значительно понижается скорость фильтрации пульпы вследствие образования гидрогелей. Наилучшие результаты по скорости фильтрации достигаются при 18% концентрации кислоты.
На извлечение магния в раствор из АО оказывает влияние отношение Т:Ж, как следует из рис. 1 и 2 оптимальное отношение Т:Ж=1:3, дальнейшее повышение Т:Ж нежелательно, поскольку при этом сильно увеличиваются материальные потоки.
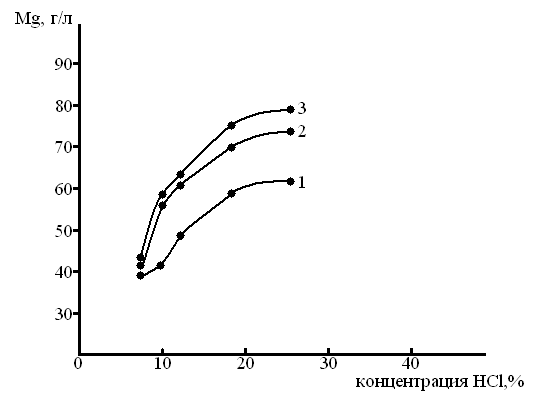
Рисунок 1– Влияние концентрации кислоты и времени выщелачивания на содержание магния в растворе при отношении Т:Ж 1:2: 1 – 2 ч, 2– 4 ч, 3– 6 ч.
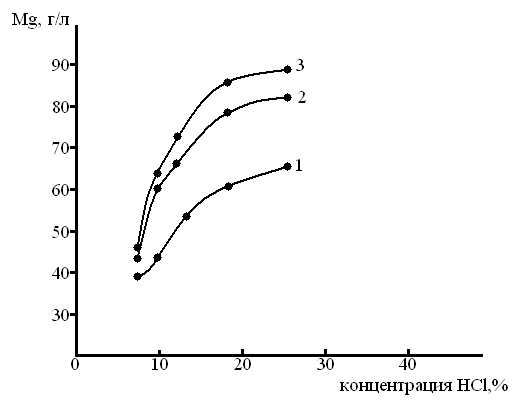
Рисунок 2– Влияние концентрации кислоты и времени выщелачивания на содержание магния в растворе при отношении Т:Ж 1:3: 1 – 2 ч, 2– 4 ч, 3– 6 ч.
С повышением температуры при прочих равных условиях содержание магния в растворе увеличивается (рис. 3).
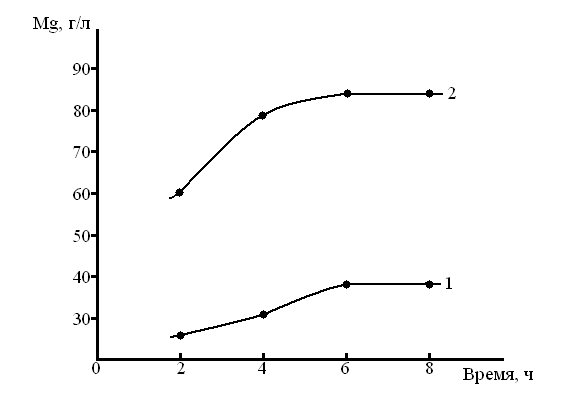
Рисунок 3 – Влияние времени выщелачивания АО на содержание магния в растворе (концентрация соляной кислоты 18%): 1– при 20оС, 2– при 90оС
На основании проведенных исследований рекомендован следующий режим выщелачивания асбестовых отходов: обработка измельченных асбестовых отходов после фракционирования (фракция 1 мм 100%) солянокислотным раствором, содержащим 18-20 % НСl, при постоянном перемешивании в течение 6 ч и температуре 90-95оС. Отделение, полученного раствора на вакуум-фильтре от аморфного осадка диоксида кремния, промывку осадка водой.
Следующая операция – нейтрализация раствора до рН 6,5 и отделение осадка примесных металлов вакуумным фильтрованием.
Для достижения необходимого рН в технологических процессах очистки магниевых растворов от примесей возможно использование двух доступных реагентов магнезита (МgО) и брусита (Мg(ОН)2).
Каустический магнезит – техническая окись магния, получаемая при обжиге магнезита в интервале 700-1000оС. Обычно технический магнезит получают как отход – пыль, улавливаемая при обжиге магнезита во вращающихся печах при производстве металлургического магнезиального порошка.
Брусит для разрабатываемой технологии получали из очищенных растворов МgCl2 осаждением гидроксида магния щелочью при рН 11,5. Осадок после фильтрования использовали в технологических процессах для нейтрализации растворов.
Осадки гидроксида магния плохо фильтруются, однако при введении флокулянта 0,25 % ПАА в количестве 5-10% от объема исходного раствора и оптимальной скорости подачи щелочи 0,5-0,7 л/мин на 1 л хлоридного раствора коэффициент фильтрации осадков Мg(ОН)2 достигает высокого значения 80·10-9м/с.
Главной причиной потерь растворов и полезных веществ является неудовлетворительная фильтрация отвального кека. Фильтрующий материал и свободное пространство между частицами осадка забивается гидроокисью двухвалентного железа Fe(OH)2. Специальные опыты по осаждению гидратов окислов металлов из раствора, не содержащего двухвалентного железа, показали, что физические свойства такого осадка более благоприятны для его декантации и фильтрации. Кроме того, присутствие в растворе двухвалентного железа вызывает повышенный расход нейтрализатора, так как осаждение Fe(OH)2 происходит при рН >7, в то время как для осаждения Fe(OH)3 достаточно рН=2÷3 [9]. Эксперименты показали, что для устранения этого недостатка необходима операция окисления двухвалентного железа.
С целью окисления двухвалентного железа раствор обрабатывали гипохлоритом кальция до остаточного содержания железа (II) в растворе не более 0,2 г/л. Выявлено, что осадок гидроксидов, не содержащий Fe(OH)2, лучше фильтруется, что приводит к уменьшению потерь.
В перспективе при организации производства магния из расплавленного синтетического карналлита методом электролиза процесс окисления Fe2+ до Fe3+ можно будет вести анодным хлоргазом. Отходящие газы передела окисления, а также часть анодного хлоргаза целесообразно также использовать для получения соляной кислоты (процесс отработан на АО «УК ТМК»), которая будет востребована на переделе выщелачивания асбестовых отходов. При этом технико-экономические показатели производства значительно повысятся.
После окисления железа пульпу фильтровали, промывали водой, фильтрат отправляли на экстракцию никеля.
Экстракции никеля органическим экстрагентом из водного раствора.
Содержание никеля в растворе 1 г/л. Экстракция никеля из растворов хлоридов смеси солей осуществляется в интервале рН 6-7 ди-2-этилгексилфосфорной кислотой (Ди-2-ЭГФК). Ди-2-ЭГФК обычно используют в виде 5-20% раствора в керосине. Использование этого экстрагента без разбавителя сопряжено с затруднениями при расслоении фаз из-за высокой вязкости реагента. В слабо- и умеренно кислых средах ведет себя как типичный катионообменный экстрагент. Интерес к этому экстрагенту определяется высокими коэффициентами распределения и разделения отдельных элементов, а также технологическими факторами – емкостью, легкостью реэкстракции, низкой стоимостью и доступностью.
В технологический раствор после окисления и удаления железа (рН 6,5) прибавляли Ди-2-ЭГФК (10% раствор в керосине) 5 об. %. Экстракция в виде комплекса ди(2-этилгексил)фосфата никеля. Процесс включает перемешивание (встряхивание смеси экстрагента и раствора в делительной воронке), отстаивание и разделения фаз. Время экстракции не более 0,5 ч. По достижении равновесия между органической и осветленной водной фазой экстракт отделяли от рабочего раствора, содержащего магний, собирали в другую делительную воронку, дважды промывали дистиллированной водой и проводили реэстракцию органического слоя 0,5н раствором соляной кислоты. Реэкстракци.я эффективна при рН<1. Время реэстракции 1 сутки при отношении органической фазы к водной 1:1. Экстракцию и реэкстракцию никеля осуществляли при комнатной температуре.
Осаждение никеля. Выделение никеля из солянокислого реэстракта достигается нейтрализацией кислого раствора NH4OH, медленное добавление аммиака способствует получению крупнокристаллического осадка. Аммиачный раствор нагревали на бане до 80-90оС. После осаждения никеля пробу выдерживали на бане ~0,5 ч, затем осадок фильтровали через стеклянный фильтр, промывали 1% раствором аммиака.
Остаточное содержание никеля в рабочем растворе 192 мг/л. Степень извлечения составляет 80,8%.
Раствор, содержащий хлорид магния отправляется на доочистку нейтрализацией до рН 7,5 с последующим фильтрованием.
Очищенный прозрачный раствор хлорида магния с рН 7,5 использовали для получения синтетического карналлита. В опытах по синтезу карналлита использовали растворы с содержанием Mg 80-85 г/л.
