
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы 1в группы
- •3.1.1. Распространение в природе и получение
- •3.1.2.Физические свойства
- •3.1.3. Химические свойства
- •3.1.4. Соединения металлов
- •3.1.5.Применение
- •3.2. Элементы подгруппы II a
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
Соединения металлов
Оксиды состава Э2О3 образуются непосредственным взаимодействием Al, Ga, Jn с кислородом, Tl образует оксид Tl2О.
Al2О3 Ga2О3 Jn2О3 Tl2О3 Tl2О
бел. бел. желт. корич. черн.
![]() амф. амф. амф.(осн.) осн. осн.
амф. амф. амф.(осн.) осн. осн.
![]() -576,4 -996 -837 -318
-576,4 -996 -837 -318

Tl2О3 образуется косвенным путем из соединений Tl (+3) и окислением Tl2О озоном.
3 Tl2О + 2О3 = 2 Tl2О3
При 100 0С Tl2О3 разрушается с выделением О2.
Al2О3 известен в нескольких модификациях, наиболее устойчив в обычных условиях - Al2О3, в природе это минерал корунд. По твердости он уступает лишь алмазу, что объясняется высокой прочностью связи Al – О – Al и плотной кристаллической структурой (атмно- ковалентная решетка). Примеси других металлов придают окраску корунду: красный рубин – примесь Cr (+3), синий сапфир – примесь Ti (+3) и Fe (+3).
Кристаллические модификации Al2О3 химически очень стойки, не взаимодействуют с водой и кислотами. Щелочами разрушаются лишь при длительном нагревании. Остальные оксиды растворяются в кислотах, а проявляя амфотерный характер (кроме Tl2О3) растворяются и в щелочах. Все Э2О3 в воде нерастворимы, кроме основного Tl2О, образующего с водой щелочь TlОН:
Э2О3 + 2NaOH + 3H2O = 2Na[Э(OH)4]
Э2О3
+ 2NaOH
![]() 2NaAlO2
+ H2O
2NaAlO2
+ H2O
Tl2О + H2O = 2TlОН
Гидроксиды. Для всех элементов характерны гидроксиды типа Э(ОН)3, для таллия – TlОН.
Al(ОН)3 Ga(ОН)3 Jn(ОН)3 Tl(ОН)3 TlОН
бел. бел. бел. красно-корич. черн.
амф. амф. амф.(осн.) осн. щелочь
Гидроксиды получают осаждением щелочами из растворимых солей соответствующих металлов:
Э(NO3)3 + 3NaOH = Э(ОН)3 + 3NaNO3
Нерастворимые в воде гидроксиды Al, Ga, Jn, Tl, при температурах около 100 0С легко теряют воду.
Э(ОН)3
![]() ЭООН
Э2О3
ЭООН
Э2О3
Легко обезвоживается также TlОН
2
TlОН
![]() Tl2О
Tl2О
![]() = 5 кДж
= 5 кДж
Вследствие амфотерности гидроксиды Al, Ga, Jn реагируют со щелочами с образованием алюминатов, галлатов, индатов.
Э(ОН)3 + NaOH = Na[Э(ОН)4]
Кроме координационного числа 4 (sp3– гибридизация) рассматриваемые элементы могут проявлять более высокие координационные числа. Типично для них к.ч. = 6 (sp3d2 – гибридизация), например, в анионе [Al(ОН)6]3-.
По некоторым признакам соединения Tl+ напоминают соединения щелочных металлов – радиусы ионов Tl+ и Rb+ одинаковы, их гидроксиды – щелочи, для них нехарактерно комплексообразование. Однако низкая термическая устойчивость гидроксидов, малая растворимость однотипных солей и некоторые другие особенности сближают по свойствам ионы Tl+ и Ag+.
Гидриды алюминия, галлия, индия – полимерные соединения состава (ЭН3)п. Получают гидриды косвенным путем:
3Li[AlH4]
+ 3NH3
![]() 4AlH3
+ LiCl
4AlH3
+ LiCl
Они легко разлагаются и обладают преимущественно кислотными свойствами.
2AlH3
![]() 2Al + 3H2
2Al + 3H2
(JnH3)n + nNaOH = nNa[JnH4]
кисл. осн.
(AlH3) (AlH3)n (GaH3)2 (JnH3)n TlH3
тв. газ тв. жид.

Несколько более устойчивы соединения с гидридами s- металлов І группы, которые легко гидролизуются (иногда со взрывом).
LiH + AlH3 = Li[AlH4]
аланат
Li[GaH4] + 4H2O = 4H2 + Ga(OH)3 + LiOH
Соли. Известны много солей Ga3+, Jn3+, Tl3+, большинство из которых хорошо растворимы в воде. Ионы Ga3+ и Jn3+ бесцветны, Tl3+ имеет светло-желтую окраску. Все соли рассматриваемых Э3+ подвержены гидролизу:
Al2(SO4)3 + H2O = 2AlOHSO4 + H2SO4
NaAlO2 + H2O = Al(OH)3 + NaOH
Ga2S3 + 6 H2O = 2Ga(OH)3 + 3H2S
Соли Tl+ в водном растворе не гидролизуются.
Все элементы рассматриваемой группы образуют галогениды типа ЭГ3, являющиеся солями. Это твердые, легкоплавкие вещества, кислотного характера. Все галогениды (кроме фторидов) растворимы в воде, при этом подвергаются гидролизу, который ослабляется в ряду AlГ3 – TlГ3.
GaCl3 + H2O = GaOHCl2 + HCl
Пары хлоридов Al, Ga, Jn и Tl являются димерами состава Э2Сl6 и следующего строения:
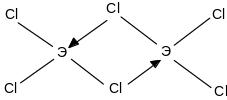
Образование димеров объясняется стремлением атомов, имеющих вакантную р- орбиталь, к завершению октета электронов - ns2 np6.
В ряду галогенидов р- металлов ІІІА – группы термическая устойчивость уменьшается от ЭF3 к ЭJ3. Так, иодид Tl разлагается при 40 0С:
TlJ3 = J2 + TlJ
Проявляя кислотные свойства галогениды склонны к комплексообразованию. Более устойчивы комплексы с октаэдрическим расположением связей (к.ч. = 6):
AlF3 + 3KF = K3[AlF6]
JnBr3 + NH3 = [Jn(NH3)6]Br3
Кристаллы галогенидов Tl+ (TlF, TlСl, TlBr, TlJ) основны, имеют ионную структуру и, в водном растворе не гидролизуются. Таллий образует смешанные галогениды, причем ион Tl+ переходит во внешнюю сферу:
TlСl3 + TlСl = Tl[TlСl4]
Окислительно-восстановительные свойства элементов ІІІА - группы наиболее четко проявляются для соединений элемента таллия (соединения Tl+3 – сильные окислители, соединения Tl+ - восстановители). Все оксиды Э2О3 (для Ga, Jn, Tl) проявляют окислительные свойства, но лишь Tl2О3 является сильным окислителем:
Tl2О3 Tl2О + О2
Для таллия (+1) известны многочисленные соединения, производные же галлия (+1) и индия (+1) неустойчивы и являются сильными восстановителями.
TlCl + KBiO3 + 6HCl = Bi + TlCl3 + KCl + 3H2O
TlNO3 + Cl2 + 3KOH = Tl(OH)3 + KNO3 + 2KCl
