
- •660025, Г. Красноярск, ул. Вавилова, 66 а
- •1.1.Распространение в природе и получение
- •1.2 Физические свойства
- •Химические свойства
- •Соединения s – металлов
- •1.6.Применение
- •Элементы іііа – группы
- •Распространение в природе и получение
- •Физические свойства
- •Химические свойства
- •Соединения металлов
- •2.1.4. Применение
- •Глава 3. Химия переходных металлов
- •В периоде с ростом z восстановительные свойства металлов уменьшаются, достигая минимума у элементов iв группы (табл.3.1.). Тяжелые металлы viiiв и iв групп за свою инертность названы благородными.
- •3.1. Элементы 1в группы
- •3.1.1. Распространение в природе и получение
- •3.1.2.Физические свойства
- •3.1.3. Химические свойства
- •3.1.4. Соединения металлов
- •3.1.5.Применение
- •3.2. Элементы подгруппы II a
- •3.2.1.Распространение в природе и получение
- •3.2.2.Физические свойства
- •3.2.3. Химические свойства По химическим свойствам Zn и его аналоги менее активны, чем подгруппа Са. В ряду от Zn к Hg-химическая активность металлов уменьшается (см. Табл.3.3.).
- •3.2.4. Соединения металлов
- •3.2.5. Применение
- •3.3. Элементы подгруппы iiia
- •3.3.1. Способы получения
- •3.3.2.Физические и химические свойства
- •3.3.3. Соединения металлов
- •3.3.4. Применение
- •3.4. Элементы подгруппы ivb
- •3.4.1.Распространение в природе и получение
- •3.4.2.Физические свойства
- •3.4.3. Химические свойства
- •3.4.4. Соединения металлов
- •3.4.5. Применение
- •3.5. Элементы подгруппы vb
- •3.5.1.Распространение в природе и получение
- •3.5.1.Физические свойства
- •3.5.2. Химические свойства
- •3.5.4. Cоединения металлов
- •3.5.5.Применение
- •3.6. Элементы подгруппы viв
- •3.6.1. Распространение в природе и получение
- •В промышленности чистый хром получают из хромистого железняка:
- •Вольфрам, молибден получают из соответствующих оксидов, например:
- •3.6.2.Физические свойства
- •3.6.3. Химические свойства
- •3.6.4. Соединения металлов
- •3.6.5. Применение
- •3.8. Элементы подгруппы VII b
- •3.8.1. Распространение в природе и получение
- •3.8.2.Физические свойства
- •3.8.4. Химические свойства
- •3.8.5.Соединения металлов
- •3.8.6. Применение
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5. Применение
- •3.9. Элементы VIII в группы (платиновые металлы)
- •3.9.1. Распространение в природе и получение
- •В виде соединений находятся в Си- Ni сульфидных рудах.
- •3.9.2. Физические свойства
- •3.9.3. Химические свойства
- •3.9.4.Соединения металлов
- •3.9.5.Применение
- •Глава 4. Лантаноиды и актиноиды
- •4.1. Электронные конфигурации атомов лантаноидов и актиноидов и их свойства.
- •4. 1.1.Монотонно изменяющиеся
- •4.1.2.Периодически изменяющиеся свойства
- •4.2.Распространение f - элементов в природе и получение
- •4.3.Разделение смеси соединений лантаноидов (актиноидов)
- •4.3.1.Ионообменная хроматография
- •4. 3.2.Жидкостная экстракция
- •4.3.3.Разделение по изменению степени окисления
- •4.4.Физические свойства
- •4.5.Химические свойства
- •4.6.Соединения f-металлов
- •4.7.Применение
4.1.2.Периодически изменяющиеся свойства
а) изменение степеней окисления
Причины возникновения "аномальных" валентностей подробно рассмотрены выше. Периодичность их изменения по ряду лантаноидов подтверждает рис.4.3;
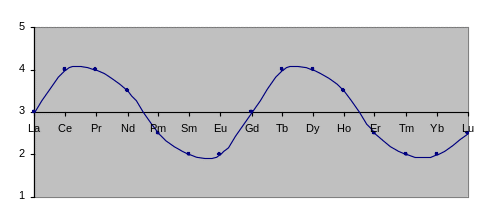
Рис.4.3. Схема валентных состояний лантаноидов
б) изменений магнитных свойств
К периодическим свойствам лантаноидов относится также магнитная восприимчивость, определяемая числом неспаренных электронов на 4f -подуровне. Изменение значений эффективных магнитных моментов ( μ ) трехзарядных ионов лантаноидов при 25°С изображено на рис.4.4. Ход кривой указывает на периодическое изменение
магнитных свойств Ln3+ подтверждает справедливость деления группы лантаноидов на две подгруппы. Наблюдается почти полное равенство магнитных восприимчивостей ионов с одинаковым числом электронов: Eu2+ и Gd3+, Eu2+ и Sm2+, Yb2+ и Lu3+.Этим подтверждается тождественность их электронных конфигураций;
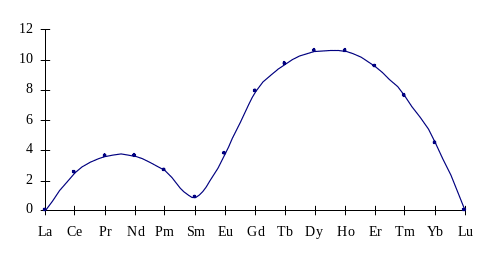
Рис. 4.4. Магнитные моменты ионов лантаноидов
в) изменение окраски ионов ( Ln3+. )
Последовательность изменения окраски у первых семи ионов повторяется в обратном порядке у последних семи:
|
La3+ |
Ce3+ |
Pr3+ |
Nd3+ |
Pm3+ |
Sm3+ |
Eu3+ |
Число несп. электр. |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
цвет |
б/ц |
б/ц |
зел |
крас |
жел |
жел |
роз |
|
Gd3+ |
Tb3+ |
Dy3+ |
Ho3+ |
Er3+ |
Tm3+ |
Yb3+ |
Lu3+ |
Число несп. электр |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
0 |
цвет |
б/ц |
роз |
жел |
жел |
крас |
зел |
б/ц |
б/ц |
Различие в цвете ионов лантаноидов обусловлено различным количеством электронов на 4f -подуровне и различной энергией их переходов на наружные уровни. Одинаковую окраску имеют ионы с одинаковым числом неспаренных электронов. Ионы с устойчивыми конфигурациями 4f0 4f7 , 4f14 - бесцветны.
Таким образом, периодический характер заполнения 4f -орбиталей сначала по одному, а затем по второму электрону предопределяет внутреннюю периодичность в изменении свойств лантаноидов и их соединений.
4.2.Распространение f - элементов в природе и получение
Одним из наиболее важных следствий структурной близости Лантаноидов - скандия и иттрия - является их постоянное совместное нахождение в природе. Их общее содержание в земной коре составляет около 0,015-3 %. Для индивидуальных лантаноидов эта величина колеблется от 5*10-3 % до 8 * 10-5% , т.е. по распространению в природе они не уступают таким промышленно важным элементам как медь, олово, свинец. Практически нет горных пород, где бы не было хоть небольшого количества РЗЭ, однако являясь редкими и рассеянными, они не имеют собственных руд.
Лантаноиды с четными порядковыми номерами распространены в природе значительно чаще, чем с нечетными, и составляют 88,5% от общего числа РЗ элементов. Известно около 200 минералов, содержащих РЗЭ в количестве около 0,1%, и более 60 минералов со значительным содержанием лантаноидов (5 *10%). Основным источником получения этих элементов является минерал монацит - это смесь фосфатов редкоземельных элементов, содержащая также некоторое количество фосфата тория - (Ln ,Th) PO4 , Прометий - радиоактивный элемент, получаемый искусственным путем.
Все актиноиды радиоактивны. Торий (7 * 10-5), уран (2 * 10-5 ) и протактиний (8 * 10-12, %) встречаются в природе, остальные элементы получены искусственным путем в ядерных превращениях. Богатые торием или ураном минералы редки. К ним относятся торит ThSiO4 и уранит UO2-3.
Основными промышленными способами получения РЗЭ является: - металлотермическое восстановление безводных хлоридов, фторидов и оксидов; электролиз расплавов безводных хлоридов или фторидов,
Металлотермическое восстановление из-за высокой активности лантаноидов при температурах 800-1000°С проводят в атмосфере инертного газа в танталовых тиглях. В качестве восстановителей обычно используют металлический кальций, магний и лантан;
2LnCl3 + 3Ca = 3CaCl2 + 2Ln
Ln2O3 + 2La = La2O3 + 2Ln
Чистота полученного в виде губки металла составляет 97-99%. Возможность очистки лантаноидов от примеси кальция или магния вакуумной дистилляцией делает этот метод предпочтительнее электролитического.
Электролиз расплавов солей проводят в стальных ваннах, служащих катодом. В качестве анода обычно используют угольные или графитовые стержни. На аноде выделяется газообразный хлор. Таким способом обычно получают "смешанный металл - мишметалл, представляющий собой сплав металлов цериевой группы (50% Cl, 25% La, 20% Nd, 20% Pr).
Для получения металлов тербиевой подгруппы применяют электролиз расплавов хлоридов иди фторидов РЗЭ с жидким катодом (Сd или Zn). Из полученных сплавов кадмий или цинк отделяют при 900°С вакуумной дистилляцией.
Актиноиды получают теми же способами, что лантаноиды. Так, U и Th. выделяют электролизом их расплавленных комплексных фторидов (КэF5); Th, Np, Pu, Аm, Cm – восстановлением фторидов барием или натрием, Pa-термическим разложением соединений:
NpF4 + 2Ba = Np + 2BaF2
2PaCl5 = 2Pa + 5Cl2
Остальные элементы (Bk, Cf, Es, Fm, Md, No, Lr) синтезированы в столь малых количествах, что в металлическом состоянии не выделены.
