
Химия(Full version)
.docxВопросы к экзамену по дисциплине «Химия»
Группы: ГЭ 13-01Б; ГЭ 13-02Б; ГЭ 13-03Б
|
Билет |
Вопросы |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
1 |
Предмет химии. Одним из основных объектов химии являются вещества, из которых состоят все окружающие нас тела. Телом называется все то, что имеет массу и объем. Явления, при которых из одних веществ образуются новые вещества, называются химическими. Изучением таких явлений и занимается химия. Химия - это наука о превращениях веществ. Химия изучает состав и строение веществ, условия и пути превращения одних веществ в другие, зависимость свойств веществ от их состава и строения. Химические изменения всегда сопровождаются изменениями физическими. Поэтому химия тесно связана с физикой. Химия также связана и с биологией, поскольку биологические процессы сопровождаются непрерывными химическими превращениями. Все вещества изучаются и получают свое название, поскольку, несмотря на наличие сходных признаков, каждое из них имеет свои индивидуальные свойства. Для установления свойств вещества необходимо иметь его в возможно более чистом виде. Иногда, даже очень малое содержание примеси приводит к сильному изменению некоторых свойств вещества. Вещества в чистом виде в природе не встречаются. Природные вещества представляют собой смеси, состоящие иногда из очень большого числа различных веществ. Например, природная вода всегда содержит растворенные соли и газы. Если одно из веществ преобладает в смеси, то обычно вся смесь носит его название. В неоднородных смесях частицы разных веществ можно различить глазом или с помощью микроскопа. Если этого сделать не удается, говорят об однородных смесях. Неоднородную смесь твердого вещества с водой можно разделить, например, отстаиванием или фильтрованием, а однородную - выпариванием. Изучая свойства веществ, химия не ограничивается только внешними наблюдениями. Она изучает и внутренние изменения, происходящие с веществами в результате физических явлений, которые не связаны с превращениями одних веществ в другие. Примером физических явлений служит переход вещества из одного агрегатного состояния в другое (превращение жидкой воды в пар при нагревании или в лед при охлаждении). Главная задача химии - выявление и описание таких свойств веществ, благодаря которым возможно превращение одних веществ в другие в результате химических явлений, или химических реакций.
Вещество в химии — физическая субстанция со специфическим химическим составом. Свойства вещества Каждому веществу присущ набор специфических свойств — объективных характеристик, которые определяют индивидуальность конкретного вещества и тем самым позволяют отличить его от всех других веществ. К наиболее характерным физико-химическим свойствам относятся константы — плотность, температура плавления, температура кипения, термодинамические характеристики, параметры кристаллической структуры. К основным характеристикам вещества принадлежат его химические свойства. Химическая классификация Индивидуальные вещества и смеси в химии принято разделять все объекты изучения на индивидуальные вещества (иначе — соединения) и их смеси. Под индивидуальным веществом понимают абстрактное понятие, обозначающее набор атомов,связанных друг с другом по определённому закону. Граница между индивидуальным веществом и смесью веществ довольно расплывчата, так как существуют вещества непостоянного состава, для которых, вообще говоря, нельзя предложить точной формулы. Кроме того, индивидуальное вещество остаётся абстракцией в силу того, что практически достижима лишь конечная чистота вещества. Это значит, что любой конкретный, реально существующий образец представляет собой смесь веществ, пусть и с подавляющим преобладанием одного из них. Несмотря на кажущуюся надуманность этого ограничения, зачастую чистота вещества играет ключевую роль в его свойствах. Так, знаменитая прочность титана проявляется только после того, как он очищен от кислорода до определённого предела (менее сотых долей процента). Неорганические вещества Соли
Органические вещества
Химия в решении проблемы обеспечения энергией. Вся история развития цивилизации - поиск источников энергии. Это весьма актуально и сегодня.
Но в ближайшие десятилетие энергетики ещё не сбросят со счетов ни дерево, ни уголь, ни нефть, ни газ.И в то же время они должны усиленно разрабатывать новые способы производства энергии. В течение 80 лет одни основные источники энергии сменялись другими: дерево заменили на уголь, уголь - на нефть,нефть - на газ, углеводородное топливо - на ядерное. К началу 80-х годов в мире около 70% потребности в энергии удволетворялось за счёт нефти и природного газа, 25% - каменного и бурого угля и лишь около 5% - других источников энергии. Сейчас наиболее крупными потребителями органического топлива являются промышленность и тепловые электростанции. Из всего используемого топлива около 20% идёт на производство электроэнергии, 30% - на получение так называемой низкопотенциальной теплоты (отопление помещений, горячая вода и т.д.), 30% - на автономный транспорт (авиация, морской и автотранспорт). Около 20% топлива потребляет химическая и металлургическая промышленность. В век научно-технического прогресса проблема нехватки энергетических ресурсов особенно обострилась, так как растущая техника требует всё больше и больше "питания" в виде электроэнергии, органического топлива и пр. Но кому же решать эту проблему как не самому НТП. И для этого есть все данные сегодня и в перспективе. Поскольку среди видов горючего наиболее дефицитным является жидкое, во многих странах выделены крупные средства для создания рентабельной технологии переработки угля в жидкое (а также газообразное) топливо. В этой области сотрудничают учёные России и Германии. Суть современного процесса переработки угля в синтез-газ заключается в следующем. В плазменный генератор подаётся смесь водяного пара и кислорода, которая разогревается до 3000оС. А затем в раскалённый газовый факел поступает угольная пыль, и в результате химической реакции образуется смесь оксида углерода (II) и водорода, т.е. синтез-газ. Из него получают метанол: CO+2H2ðСH3OH. Метанол может заменить бензин в двигателях внутреннего сгорания. В плане решения экологической проблемы он выгодно отличается от нефти, газа, угля, но, к сожалению, теплота его скорания в 2 раза ниже, чем у бензина, и, кроме того, он агрессивен по отношению к некоторым металлам, пластическим массам. История развития нефтяной индустрии короче, чем угольной. Хотя нефть использовалась с античных времён для освещения и как топливо, неудержимые темпы роста её добычи и использования тесно связаны с созданием авто- и авиатранспорта. Начиная с 1854 г. простой перегонкой нефти стали получать керосин. Низкокипящие фракции не использовалисяь. В 1913 г. американец У. Бартон разработал термический крекинг-процесс, который дал возможность не только производить до 50% бензина из нефти, но и осуществлять гидрогенизацию ненасыщенных углеводородов, образующихся во время крекинга. Например, в 1928 г. по крекинг-процессу из 195 млн. м3 нефти было полученно 62 млн. м 3 бензина,18 млн. м3 керосина, 7 млн .м 3 смазочных масел, остальное - газойль, мазут, парафин, асфальт и др. А нельзя ли бензин заменить газом?Впервые исседования по применению сжатого природного газа в транспорте велись в 30-х годах, а в 50-х на дорогах только нашей страны было 20000 автомобилей, работающих на таком горючем. Появившийся дешёвый бензин оказался вне конкуренции. Но в связи с повышение цен на нефтипродукты учёные снова обратились к стаым проектам: бензин можно заменить сжиженой пропан-бутановой смесью, которую хранят при обычной температуре. Она дешевле бензина, менее токсична, продлевает срок службы двигателя. Но вся беда в том, что природные запасы газа также небезграничны, как и нефти. В "Таинственном острове", опубликованном в 1874 г., Жюль Верн говорит о том, что уголь и другие ископаемые будут заменены новым топливом - водой, состоящей из водорода и кислорода, которые и станут неиссякаемыми источниками теплоты и света. Обнаружил горючесть водорода Я.ван Гельмонт. Это свойство делает водород основным претендентом на звание топлива будущего. При его сгорании в чистом кислороде достигается температура до 2800оС. Такое пламя легко плавит кварц и большинство металлов. Теплота сгорания водорода в кислороде равна 142650 кДж/кг. Химическое производство сейчас основной поставщик водорода, но бесперспективный, так как цена сырья, а им чаще всего являются углеводороды, неумолимо растёт. Электролиз наиболее прямой метод получения чистого водорода. Конкурентоспособность электролиза определяется наличием дешёвой электроэнергии. Существует ещё множество разработанных технических предложений получения водорода, но наибольшие надежды возлагаются на энергию ядерных электростанций. Если сравнить энергию, полученную химическим путём, с энергией, полученной от эквивалентниго количества вещества в ходе цепных реакций деления тяжёлых элементов (плутония, урана). Энергия сгорания 1 г древесины достаточна для того, чтобы электрическая лампочка в 100 Вт горела 1 мин,а энергии сгорания 1 г угля хватит для двух таких лампочек. Для освещения в течение часа города с 60 000 жителей хватит энергии 1г урана-235. Энергия, заключается в 1 г тяжелого водорода - компонента топлива реакции термоядерного синтеза, в 7,5 раза больше, чем в 1 г урана-235. На год работы АЭС мощностью 1 млн.кВт необходимо 30 - 50 т уранового топлива, а для теплоэлектростанции такой же мощности требуется 1,6 млн.т мазута или 2,5 млн.т угля. Сейчас ядерная энергетика развивается по пути широкого внедрения реакторов на быстрых нейтронах. В таких реакторах используется уран, обогащённый изотопом 235U ( не менее чем на 20%), а замедлителя нейтронов не требуется. Ядерная реакция - деление 235U - высвобождает нейтроны, которые вступают в реакцию с 238U : 238U+ 1n ð 239U+g 92 0 92 Изотоп урана, являющийся продуктом этой реакции, быстро распадается (Т1/2 = 23 с), превращаясь в изотоп нептуния (Т1/2= 50 ч), а тот, в свою очередь, в изотоп плутония: 239 239 0 - 92U ð 93 Np + 1 e 239 239 0 - 93Np ð 94Pu + 1e 239Pu гораздо более стабильный изотоп, чем два его предшественника. Его, как и некоторые другие изотопы плутония, образующиеся в реакторе, можно использовать в качестве ядерного горючего, в том числе в реакторах на быстрых нейтронах. В настоящее время ядерная энергетика и реакторостроение - это мощная индустрия с большим объёмом капиталовложений. Для многих стран она важная статья экспорта. Для реакторов и вспомогательного оборудования требуются особые материалы, в том числе высокой частоты. Задача химиков, металлургов и других специалистов - создание таких материалов. Над обогащением урана тоже работают химики и представители других смежных профессий. Сейчас перед атомной энергетикой стоит задача вытеснить органическое топливо не только из сферы производства электроэнергии, но так же из теплоснабжения и в какой-то мере из металлургической и химической промышленности путём создания реакторов энерготехнологического значения. АЭС в перспективе найдут ещё одно применение - для производства водорода. Часть полученного водорода будут потреблятся химической промышленностью, другая часть послужит для питания газотурбинных установок, включаемых при пиковых нагрузках. Важнейший воспроизводимый источник энергии на планете - энергия Солнца. Роль химиков в освоении этой энергии - это и создание материалов для солнечных батарей и преобразователей, и разработка способов консервации энергии, в том числе термохимических способов её накопления в виде горючего с высокой калорийностью, например водорода, а также разработка солевых систем - накопителей энергии. Ядерная и солнечная энергетика тесно смыкаются с водородной энергетикой, под которой понимают использование водородного горючего, например не транспорте. Наряду с гигантскими электростанциями существуют и автономные химические источники тока, преобразующие энергию химических реакций непосредственно в электрическую. В решении этого вопроса химии принадлежит главная роль. В 1780 г. итальянский врач Л. Гальвани, наблюдая сокращение отрезанной лапки лягушки после прикосновения к ней проволочками из разных металлов, решил, что в мышцах имеется электричество, и назвал его " животным электричестволм". А. Вольта,продолжая опыт своего соотечественника, предположил, что источником электричества является не тело животного: электрический ток возникает от соприкосновения разных металлических проволочек."Предком" современных гальванических элементов можно считать "электрический столб", созданный А.Вольтой в 1800 г. Это изобретение похоже на слоёный пирог из нескольких пар металлических пластин: одна пластина из цинка, вторая - из меди, уложенные друг на друга, а между ними помещена войлочная прокладка, пропитанная разбавленной серной кислотой. До изобретения в Германии В. Сименсом в 1867г. динамо-машины гальванические элементы были единственным источником электрического тока. В наши дни, когда автономные источники энергии понадобились авиации, подводному флоту, ракетной технике, электронике, внимание учёных снова обращено к ним. Я рассказал далеко не о всех направлениях решения энергетической проблемы учёными мира, а только об основных. В каждой стране она имеет свои особенности: социально-экономические и географические условия, обеспеченность природными богатствами, уровень развития науки и техники.
Химическое загрязнение окружающей среды обусловлено следующими факторами: 1) повышением концентрации биогенных элементов из-за канализационных сбросов и стока с полей удобрении, вызывающих бурное развитие водорослей и нарушение баланса в существующих экосистемах; 2) отравлением воды, почвы и воздуха отходами химических производств; 3) воздействием на воду и почву продуктов сжигания топлива, снижающих качество воздуха и вызывающих кислотные дожди; 4) потенциальным заражением воздуха, воды и почвы радиоактивными отходами, образующимися при производстве ядерного оружия и атомной энергии; 5( выбросами углекислого газя и химических веществ, снижающих содержание озона, что может привести к изменению климата или образованию озоновых дыр. Охрана атмосферы от химического загрязнения Как вы уже знаете, атмосферный воздух представляет собой смесь газов, содержащую (по объему) 78,09% азота, 20,95% кислорода, 0,93% аргона Аг, 0,03% углекислого газа СО2. В процессе развития жизни на Земле все живые организмы, в том числе п человек, приспособились именно к такому составу атмосферы и очень чутко реагируют на его изменения. Особое значение имеет кислород как главный компонент биологическою окисления. Для поддержания обмена веществ требуется непрерывная доставка кислорода в ткани н клетки. Атмосферный азот служит источником веществ, необходимых для питания растений, а углекислый газ — для осуществления процесса фотосинтеза. Атмосфера оказывает не только прямое влияние на живые организмы, но и косвенное, поскольку От нес зависит характер солнечной радиации, достигающей поверхности Земли, климат и другие факторы, регулирующие существование биосферы. Атмосфера — регуляторный механизм биосферы Атмосфера является одной из главных частей механизма, регулирующего круговорот воды, кислорода, азота, углерода. Значение атмосферы состоит в том, что она служит экраном, защищающим жизнь на Земле от губительных воздействий из космоса. Через атмосферу проникают солнечные лучи — источник жизни. Атмосфера прозрачна для электромагнитного излучения в диапазоне длин волн от 0,3 до 0,52 нм. в которых заключено 82% всей энергии солнечных лучей, я также для радиоволн с длиной от 1 мм до 30 м. Жесткое коротковолновое излучение - рентгеновские и у-лучи — поглощается всей толщей атмосферы и не доходит до поверхности Земли. Особое значение имеет атмосферный озон 03, интенсивно поглощающий коротковолновые ультрафиолетовые лучи с длиной волны менее 0,29 нм. Таким образом, атмосфера защищает жизнь на Земле от коротковолновых лучей. Вместе с тем она пропускает инфракрасное излучение солнца, но благодаря содержащимся в ней озону, углекислому газу п водяному пару непрозрачна для инфракрасного излучения Земли. Если бы эти газы не содержались в атмосфере. Земля превратилась бы в безжизненный шар, средняя температура на поверхности которого была бы -23 ºС, в то время когда она фактически равна +14.8 ºС. Жизнь в той форме, в которой она существует на Земле, возможна лишь при наличии атмосферы со всеми ее физическими и химическими свойствами. Естественное загрязнение атмосферы можно рассматривать как фактор, способствующий ее регуляторной функции. Поэтому сам термин «загрязнение* здесь является в какой-то мере условным. В атмосферу попадают газы, выделяющиеся в результате горения лесов, извержения вулканов, биохимических реакций. Особое значение имеет естественная атмосферная пыль. Она образуется при выветривании горных порол, эрозии почв, лесных и торфяных пожарах. В атмосфере она создает ядра конденсации, без которых было бы невозможно образование осадков: снега, дождя. Искусственное (антропогенное) загрязнение может быть связано с попаданием в атмосферу: 1) твердых частиц (цементная и резиновая автомобильная пыль, пыль горно-металлургических предприятий и т. д.); 2) газообразных веществ (углекислый и угарный газы, оксиды азота и серы, метан и аммиак, углеводороды и другие летучие соединения — бензин, растворители и т. д.); 3) радиоактивных веществ, поступающих в воздух в результате взрывов атомных и ядерных бомб, аварий на атомных электростанциях, добычи урана и использования радиоактивных веществ в различных технологических процессах; 4) свинца и других тяжелых металлов. Изменение свойств атмосферы в результате загрязнения Искусственное загрязнение оказывает и прямое, и косвенное воздействие на живые организмы. Прямое токсическое действие на организмы оказывают, например, оксиды серы и азота. Оксид серы обладает сильным раздражающим действием на глаза, носоглотку, ткань легких. У растений он разрушает хлоропласты и другие клеточные органоиды. Интенсивность фотосинтеза при атом снижается в 1,5—2 раза. Особенно чувствительны к ЙОг хвойные растения. При концентрации всего одной части ЙОг на миллион частей воздуха всего в течение двух месяцев у пятилетних елей происходит пожелтение и опадение хвои.
Оксиды азота (N0 и N02) — токсичные соединения, вызывающие раздражение дыхательных путей, а в высоких дозах - отек легких. Кроме этого, оксиды азота и серы образуют в атмосфере азотную и серную кислоты, которые в виде кислотных дождей выпадают вместе с осадками и вызывают гибель наземных растений и водных организмов. Они наносят большой вред архитектурным и скульптурным памятникам из мрамора, разрушают металлические крыши и конструкции — мосты и опоры. Искусственное загрязнение оказывает косвенное воздействие на атмосферу, изменяя ее свойства. Так, в результате увеличивающегося сжигания топлива и уменьшения площадей, занятых земной растительностью, фотосинтетическяя генерация (восстановление кислорода из углекислого газа в результате фотосинтеза) в настоящее время уменьшилась на 30% по сравнению с предыеторичеекпм периодом. Ежегодная убыль кислорода составляет 31,62 млрд т. Если учесть, что в атмосфере содержится 1200 трлн т кислорода, то его количество в атмосфере уменьшается в год на 0,0025%. Казалось бы, очень немного, но, очевидно, в конце концов встанет вопрос о введении ограничений на потребление кислорода. Гораздо хуже обстоит дело с озоном. Максимальная концентрация его в атмосфере наблюдается на высоте 20—25 км. Известно, что озон поглощает ультрафиолетовые лучи. При этом он сильно разогревается и препятствует потере тепла нижними слоями атмосферы. Помимо этого, озон, как и углекислый газ, усиленно поглощает инфракрасное излучение Земли. Следовательно, озон не только «спасает» все живое на планете от ультрафиолетовых лучей, но вместе с углекислым газом играет важную роль в тепловом балансе атмосферы и всей Земли. Накопление углекислого газа и других веществ — причина парникового эффекта (глобального потепления климата). Вам знакомо, как нагревается автомобиль изнутри, когда он стоит на солнце с закрытыми окнами. Причина в том, что солнечный свет проникает через стекла и поглощается сиденьями и другими предметами салона. При этом световая энергия превращается в тепловую, которую предметы отражают в виде инфракрасного излучения. В отличие от света, оно не проникает сквозь стекла наружу, то есть улавливается внутри автомобиля. За счет этого повышается температура. То же самое происходит и в парнике, отчего и произошел термин .парниковый эффект». Озоновый экран разрушается оксидами азота, соединениями хлора и фтора, попадающими в атмосферу в результате распада фреонов. которые широко применяют в холодильной и парфюмерно-косметической промышленности. Чтобы минимизировать загрязнения атмосферы, необходимо: 1) производить очистку выбросов в атмосферу от твердых и газообразных загрязняющих веществ с помощью электрофильтров, жидких и твердых поглотителей, циклонов и др.; 2) использовать экологически чистые виды энергии; 3) применять малоотходные и безотходные технологии; 4) добиваться уменьшения токсичности автомобильных выхлопных газов путем совершенствования конструкции двигателей и применения катализаторов, а также совершенствовать существующие и создавать новые электромобили и двигатели, работающие на водородном топливе. Охрана водных ресурсов Жизнь как физико-химический процесс протекает в водной среде. Животные, растения на 70—80% состоят из воды. Потеряв 50% своей массы в результате голодания, человек может остаться в живых, но потеря 15—20% массы в результате обезвоживания — смертельна. Все реакции обмена веществ в организме человека, и в первую очередь реакции гидролиза, протекают или с участием воды, или в водной среде. Но вода — не только условие жизни индивидуального организма. Без нее невозможно было бы существование биосферы, то есть жизни на Земле, поскольку круговорот веществ и энергии в биосфере возможен только с участием воды. Круговорот воды действует беспрерывно. Он реализуется в трех основных географических объектах: океан — атмосфера — суша. С поверхности Мирового океана ежегодно испаряется 453000 км3 воды. Осадки, выпадающие на землю, составляют 525 000 км3. Превышение происходит за счет испарения воды с других водных поверхностей растениями. Испаряющаяся вода, конденсируясь, образует облака и в виде осадков выпадает на землю. Они поглощаются почвой, и в результате подземного и поверхностного стока вода возвращается в моря и океаны. Круговорот воды — вто хорошо отрегулированный механизм, который беспрерывно «качает» воду из океана на материк. При этом вода очищается. Водные ресурсы Земли составляет соленая и пресная вода. Причем 97,2% от общего запаса в 1345 млн км3 приходится на воды Мирового океана. Понятно, что на долю пресной воды приходятся оставшиеся 2.8%, но если исключить полярные ледники, пока недоступные для использования, то выяснится, что практически можно использовать лишь 0,3%. Теоретически можно считать водные ресурсы неисчерпаемыми, если принять, что при их рациональном использовании они непрерывно возобновляются в процессе круговорота. Вместе с тем потребление воды увеличивается, так как она служит одним из главных видов сырья для промышленности. Ее в огромных количествах используют в качестве теплоносителя и теряют в процессе охлаждения и подогрева.
В металлургии для выплавки 1 т чугуна и переплавки его в сталь требуется 300 м3 воды, для получения 1 т меди — 500 м3, 1 т никеля — 4000 м3. Одним из главных потребителей воды является производство синтетических материалов. Для получения 1 т синтетнпеского каучука нужно 2100 м3 воды, лавсана — 4200 м3, капрона — 5600 м3. Для изготовления автомобиля нужно 246 м3 воды, а для запуска межконтинентальной баллнстическоп ранеты — 189000 м3. В горнодобывающей промышленности воду широко используют для добычи полезных ископаемых: при использовании гидромониторов, транспортировке, отделении минералов от руды методом флотации. С потреблением огромного количества воды связано целлюлозно-бумажное производство. На производство 1 т бумаги требуется 250 м3 воды. Еще больше расходуют воды в сельском хозяйстве: животноводстве и растениеиодстве. При бережном отношении к воде можно уменьшить ее расход как в промышленном и сельскохозяйственном производстве, так и в коммунально-бытовом хозяйстве. Водоемкость в ней одного жителя крупного города составляет 35 л в сутки. Но за счет нерационального ее использования, потерь при транспортировке к потребителю, неисправности оборудования в квартирах (протекающие краны и сливные бачки) она увеличивается до 700 л. Запасы пресной воды в зонах интенсивной хозяйственной деятельности и проживання большинства людей становятся недостаточными, поэтому уже сейчас необходимо думать о ее сбережении. Все химикаты, которые используют, хранят, проливают, закапывают в землю, могут попасть в грунтовые яды. Загрязнение твердыми частицами происходит при попадании в водоемы песка, глины, шлаков, пустой породы и других твердых отходов добывающей, металлургической, химической и строительнойпромышленности. Загрязнение минеральными веществами: 1) соединениями металлов (высокотоксичными — свинцом, ртутью, редкоземельными — кадмием, селеном, литием и др.), в результате чего при превышении предельно допустимой концентрации (ПДК) у людей поражаются органы слуха, зрения, нервная система, возможны случаи паралича и рождения детей с различными физическими и психическими аномалиями; 2) минеральными удобрениями, в результате попадания которых в водоемы наблюдается эвтрофикация, то есть неумеренное разрастание водной растительности (водоем со зловонной зеленой жижей вы, очевидно, видели не раз). Загрязнение органическими веществами промышленного происхождения, входящими в состав стоков химической, нефтехимической, целлюлозно-бумажной и других видов промышленности. Среди таких веществ встречаются фенол, диоксин, CMC. Загрязнение нефтью и ее производными. Одна тонна нефти, растекаясь по водной поверхности, способна занять площадь в 12 км2, а 1 л нефти может сделать непригодным к употреблению 1 млн л воды, то есть столько ее, сколько бы хватило для семьи из 4 человек в течение 20 лет. Нефтяная пленка представляет собой преграду для газообмена между водой и атмосферой. Она препятствует поглощению водой кислорода и углекислого газа, вызывая гибель планктона. Эта пленка представляет собой большую опасность для морских птиц и животных. Оперение птиц, вымазанное нефтью, теряет свои водонепроницаемые свойства, что приводит к их гибели. Органические вещества биологического происхождения содержатся в бытовых и животноводческих стоках. Попадая в водоемы, эти стоки делают воду непригодной для питья, вызывают гибель рыбы, являются причиной эвтрофикации. Пестициды. как и тяжелые металлы, двигаясь по трофической цепи: фитопланктон —► зоопланктон —► мелкие рыбы —► крупные рыбы, достигают в теле последних такой концентрации, которые могут быть смертельными для человека. Кардинальным решением проблемы борьбы с загрязнением водной среды (гидросферы) был бы полный переход на безопасные технологии, при которых исключался бы сброс каких-либо стоков, а также разработка технологий с минимальным потреблением воды. Но разработка и внедрение малоотходных технологий — дорогостоящи и сложны, поэтому первоочередное значение приобретает процесс очистки сточных вод, включающий: 1) очистку и обеззараживание бытовых и животноводческих стоков: 2) орчистку стоков от последствий обслуживания автотранспорта и сельскохозяйственной техники: 3) очистку стоков, содержащих нефтепродукты. Перспективны способы очистки воды от нефтепродуктов с помощью микроорганизмов и растений. Известны микроорганизмы, способные питаться углеводородами. Эксперименты, проведенпые с использованием грибков Candido UpoUtica, показали, что небольшие водоемы могут быть очищены от нефти за 5—в дней. Охрана земельных ресурсов О роли почвы — тонкой пленки, покрывающей часть суши, толщина которой колеблется от 1,5—2см до 2 м, подробно рассказано в параграфе «Химия и сельское хозяйство». Здесь же мы рассмотрим факторы, понижающие почвенное плодородие, и факторы, вызывающие загрязнение земельных угодий. Эрозия (от лат. erodere — разъедание) понижает плодородие почвы. Это явление, которое принесло и приносит человечеству страшные беды. На образование плодородного слон почвы уходят тысячелетня, уничтожен он может быть за 15— 20 лет, а при сильных ураганах и ливнях — за несколько дней или часов. Существуют два основных вида эрозии — водная и ветровая. Борьба с ними включает комплекс мероприятий: • лесонасаждение; • агротехнические приемы, например создание долголетних культурных пастбищ, снегозадержание, внесение органических (но не минеральных) удобрений; • почвозащитная система земледелия, заключающаяся в безотвальной вспашке и оставлении стерни на поверхности почвы; • создание и внедрение почвозащитного земледелия, препятствующего технической эрозии, которая возникает как результат непосредственного разрушения слоя почиы техническими средствами, в основном колесами и гусеницами машин; • недопущение загрязнения почвы остатками строительных деталей (панелей, блоков, кирпичей, золы, шлака), нефтью и нефтепродуктами, веществами, попадающими в иочьу из атмосферы (соединени I м 1 свинца, мышьяка, ртути, меди и т. д.); • правильное применение удобрений и пестицидов. Около 20%, а иногда и все 50% удобрений не усваиваются растениями и остаются в почве тяжелым грузом для ее биоценоза. Пестициды могут попасть в почву и нарушить сложившиеся в ней трофические связи.
Германий. В химических соединениях германий обычно проявляет валентности 4 или 2. Соединения с валентностью 4 стабильнее. При нормальных условиях устойчив к действию воздуха и воды, щелочей и кислот, растворим в царской водке и в щелочном растворе перекиси водорода. Применение находят сплавы германия и стёкла на основе диоксида германия.
1871 г. Менделеев предсказал его существование 1886 г. Немецкий химик Винклер открыл его. В земной коре= 0.0007%, минералы очень редкие. Источником получения германия обычно служат побочные продукты, получающиеся при переработке руд цветных металлов. Имеет серебристый цвет и похож на металл. При комнатной температуре он устойчив к действию воздуха, кислорода, воды, соляной и серной (разб.) кислот
Ge+2H2SO4=GeO2 (осад.)+2H2O+2SO2 Ge реагирует со щелочами Ge+2NaОН+2H2O2=NaGeO3(германат натрия)+3H2O Соединения Ge(II) малоустойчивы. Соединения Ge+4более характернее: GeO2-диоксид германия. Белые кристаллы, растворимы в воде, амфотерное соединение сильно преобладают кислотными свойствами. Германоводороды: GeH4 Ge – полупроводниковые свойства, изготовляют термометры сопротивления GeO2 – в производстве стекол.
В присутствии сильных комплексообразователей или окислителей, при нагревании Ge реагирует с кислотами: Ge + H2SO4 конц = Ge(SO4)2 + 2SO2 + 4H2O, Ge + 6HF = H2[GeF6] + 2H2, Ge + 4HNO3 конц. = H2GeO3 + 4NO2 + 2H2O Ge реагирует с царской водкой (см. ЦАРСКАЯ ВОДКА): Ge + 4HNO3 + 12HCl = GeCl4 + 4NO + 8H2O. С растворами щелочей Ge взаимодействует в присутствии окислителей: Ge + 2NaOH + 2H2O2 = Na2[Ge(OH)6]. При нагревании на воздухе до 700 °C Ge загорается. Ge легко взаимодействует с галогенами (см. ГАЛОГЕНЫ) и серой (см. СЕРА): Ge + 2I2 = GeI4 С водородом (см. ВОДОРОД), азотом (см. АЗОТ), углеродом (см. УГЛЕРОД) германий непосредственно в реакции не вступает, соединения с этими элементами получают косвенным путем. Например, нитрид Ge3N4 образуется при растворении дииодида германия GeI2 в жидком аммиаке: GeI2 + NH3 жидк —> [GeNH]n —> Ge3N4 Оксид германия (IV), GeO2, — белое кристаллическое вещество, существующее в двух модификациях. Одна из модификаций частично растворима в воде с образование сложных германиевых кислот. Проявляет амфотерные свойства. С щелочами GeO2 взаимодействует как кислотный оксид: GeO2 + 2NaOH = Na2GeO3 + H2O GeO2 взаимодействует с кислотами: GeO2 + 4HCl = GeCl4 + 2H2O Тетрагалогениды Ge — неполярные соединения, легко гидролизующиеся водой. 3GeF4 + 2H2O = GeO2 + 2H2GeF6 Тетрагалогениды получают прямым взаимодействием: Ge + 2Cl2 = GeCl4 или термическим разложением: BaGeF6 = GeF4 + BaF2 Гидриды германия по химическим свойствам подобны гидридам кремния, но моногерман GeH4 более устойчив, чем моносилан SiH4. Германы образуют гомологические ряды GenH2n+2, GenH2n и другие, но эти ряды короче, чем у силанов. Моногерман GeH4 — газ, устойчивый на воздухе, не реагирующий с водой. При длительном хранении разлагается на H2 и Ge. Получают моногерман восстановлением диоксида германия GeO2 борогидридом натрия NaBH4: GeO2 + NaBH4 = GeH4 + NaBO2. Очень неустойчивый монооксид GeO образуется при умеренном нагревании смеси германия и диоксида GeO2: Ge + GeO2 = 2GeO. Соединения Ge (II) легко диспропорционируют с выделением Ge: 2GeCl2 —> Ge + GeCl4 Дисульфида германия GeS2 — белое аморфное или кристаллическое вещество, получается осаждением H2S из кислых растворов GeCl4: GeCl4 + 2H2S = GeS2Ї + 4HCl GeS2 растворяется в щелочах и сульфидах аммония или щелочных металлов: GeS2 + 6NaOH = Na2[Ge(OH)6] + 2Na2S, GeS2 + (NH4)2S = (NH4)2GeS3 Ge может входить в состав органических соединений. Известны (CH3)4Ge, (C6H5)4Ge, (CH3)3GeBr, (C2H5)3GeOH и другие.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
2 |
Основные стехиометрические законы химии Атомно-молекулярная теория Стехиометрия — раздел химии, в котором рассматриваются массовые или объемные отношения между реагирующими веществами. Исключительное значение для развития химии имело установление трех основных стехиометрических законов. 1) Закон сохранения массы веществ (М.В. Ломоносов, 1748 - 1756 гг.; А. Лавуазье, 1777 г.). Масса веществ, вступивших в реакцию, равна массе веществ, получившихся в результате реакции. 2) Закон постоянства состава (Ж.Л. Пруст, 1801 г.). Каждое чистое соединение независимо от способа его получения всегда имеет один и тот же состав. 3) Закон Авогадро (А. Авогадро, 1811 г.). В равных объемах различных газов при одинаковых температуре и давлении содержится одно и то же число молекул. Важным следствием из закона Авогадро является утверждение: при одинаковых условиях равные количества различных газов занимают равные объемы.
В
частности, при. нормальных условиях
(н.у.) — при температуре Закон Авога́дро — одно из важных основных положений химии, гласящее, что «в равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул». Было сформулировано ещё в 1811 году Амедео Авогадро (1776—1856), профессором физики в Турине.
Первое следствие из закона Авогадро: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Менделеева-Клапейрона:
Второе следствие из закона Авогадро: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа по второму.
4)Джон Дальтон в 1803 году сформулировал закон кратных отношений: если два элемента образуют между собой несколько соединений, то на одно и то же весовое количество одного элемента приходятся такие весовые количества другого элемента, которые относятся между собой как небольшие целые числа. То, что элементы вступают в соединения определенными порциями, явилось ещё одним подтверждением правильности атомистического учения и объяснения с его позиций химических процессов. Однако атомистические представления сами по себе не могли объяснить, например, количественных соотношений, которые наблюдаются в химических реакциях между газами. Французский учёный Ж. Гей-Люссак, изучая химические реакции между газообразными веществами, обратил внимание на соотношения объёмов реагирующих газов и газообразных продуктов реакции. Он установил, что 1 л хлора целиком вступает в реакцию с 1 л водорода с образованием 2 л хлороводорода; 1 л кислорода взаимодействует без остатка с 2 л водорода, образуя 2 л водяного пара. Эти опытные данные Гей-Люссак обобщил в 5) законе объёмный отношений: Объёмы реагирующих газообразных веществ относятся между собой и к объемам образующихся газообразных веществ как небольшие целые числа.
Полиме́ры (греч. πολύ- — много; μέρος — часть) — неорганические и органические, аморфные и кристаллические вещества, состоящие из «мономерных звеньев», соединённых в длинные макромолекулы химическими или координационными связями. Полимер — это высокомолекулярное соединение: количество мономерных звеньев в полимере (степень полимеризации) должно быть достаточно велико (в ином случае соединение будет называться мономером) . Во многих случаях количество звеньев может считаться достаточным, чтобы отнести молекулу к полимерам, если при добавлении очередного мономерного звена молекулярные свойства не изменяются.[1] Как правило, полимеры — вещества смолекулярной массой от нескольких тысяч до нескольких миллионов В химии олигомер (греч. ολιγος — малый, немногий, незначительный; μέρος — часть) — молекула в виде цепочки из небольшого числа одинаковых составных звеньев. Этим олигомеры отличаются от полимеров, в которых число звеньев теоретически не ограничено. Верхний предел молекулярной массы олигомера зависит от его химических свойств. Свойства олигомеров сильно зависят от изменения количества повторяющихся звеньев в молекуле и природы концевых групп; с момента, когда химические свойства перестают изменяться с увеличением длины цепочки, вещество называется полимером.
1. Полимеризация – реакция образования полимеров путем последовательного присоединения молекул низкомолекулярного вещества (мономера). Побочных продуктов не образуется. В качестве мономеров используются соединения с кратными связями С С, С N, С = С, С = О, С = N, либо соединения с циклическими группировками, способными раскрываться, например В процессе полимеризации происходит разрыв кратных связей или раскрытие циклов у мономеров и возникновение химических связей между группами с образованием макромолекул:
По числу участвующих мономеров различают: гомополимеризацию один вид мономера и сополимеризацию два и более видов мономеров. Поликонденсация – синтез полимера с несколькими функциональными группами, сопровождающийся образованием низкомолекулярных продуктов H2O NH3 HCl и др.. Элементные составы полимеров и исходных веществ не совпадают, за счет образования низкомолекулярных продуктов. Линейная поликонденсация:
NH2 CH25 CO NH CH25 COOH NH2 CH25 COOH NH2 CH25 CO NH CH25 CO NH CH25 COOH H2O и т.д. Конечный продукт капрон (поли - ε капроамид) CO NH CH25 n Трехмерная поликонденсация:
на 1 этапе синтезируется олигомер линейной структуры CH2 NH CO NH CH2 On на 2 этапе при нагревании в кислой среде происходит дальнейшая поликонденсация олигомера с выделением CH2O и возникновением сетчатой структуры. Такой сетчатый полимер невозможно превратить в исходное состояние, он не обладает термопластичными свойствами и называется термореактивным полимером. Поликонденсация идет по ступенчатому механизму, при этом промежуточные продукты являются стабильными, т.е. поликонденсация может остановиться на любой стадии. Образующиеся H2O HCl NH3 низкомолекулярные могут взаимодействовать с продуктами поликонденсации, вызывая их расщепление гидролиз, аминолиз и др., поэтому низкомолекулярные продукты приходится удалять из реакционной среды. Методом поликонденсации получают примерно четвертую часть выпускаемых полимеров капрон - поликапроамид, найлон полигексаметиленадипинамин, полиуретаны, фенолформальдегидные смолы и мочевиноформальдегидные).
m (SO2)-? В цинковой руде содержится ZnS=0,6т
n=2моль n=2моль M=97 г/моль М=64г/моль m=194 г m=128 г
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
3 |
Окси́д — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менееэлектроотрицательным элементом.
Основания – хим. соединения, которые в растворе диссоциируют на катионы металла и ионы гидроксильных групп OH. Кислоты – хим. соединения, которые в растворах диссоциируют на ионы водорода и ионы кислотного остатка. Соли – продукты замещения атомов водорода в кислоте на металл или гидроксид анионов в основаниях на кислотный остаток. Основой Номенклатуры неорг. соединений служат названия химических элементов. Как правило, название соединения состоит из двух слов. Одно из них означает принадлежность данного соединения к определённому роду (или классу), другое — к определённому виду. апример, в названии "серная кислота" существительное показывает, что данное вещество относится к кислотам, а прилагательное поясняет, что это кислота, образованная серой.
Медь- это пластичный переходный металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). C давних пор широко применяется человеком. В соединениях медь проявляет две степени окисления: +1 и +2. Первая из них склонна к диспропорционированию и устойчива только в нерастворимых соединениях (Cu2O, CuCl, CuI ). Более устойчива степень окисления +2, которая даёт соли синего и сине-зелёного цвета. Электронное строение атома: 1s2 |2s2 2p6 |3s2 3p6 3d10| 4d1 на 1 слое 2 электрона на 2 слое 8 на 3 слое 18 на 4 слое 1 Химические соединения: Соединения меди(I) Степени окисления +1 соответствует оксид Cu2O красно-оранжевого цвета. Соответствующий гидроксид CuOH (жёлтого цвета) . Соединения меди(II) Степень окисления II — наиболее стабильная степень окисления меди. Ей соответствует чёрный оксид CuO и голубой гидроксид Cu(OH)2 Соединения меди(III) и меди(IV) Степени окисления III и IV являются малоустойчивыми степенями окисления и представлены только соединениями с кислородом, фтором или в виде комплексов. Медь встречается в природе как в соединениях, так и в самородном виде. Пирометаллургический метод получения меди:
Гидрометаллургический метод
Применение в электротехнике, теплообмене, производство труб.
NaCI→Na++CI- (диссоциация под действием элект. тока)- электролиз
K- A+ Na+ CI-
n=2моль n=2моль M=58,5 г/моль М=23г/моль m=117 г m=46 г
Х=35,1кг NaCI m(поваренной соли)-? 35,1кг→96,8% Х
кг→100%
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4 |
Эквивалент- это реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим образом эквивалентной одному иону водорода в кислотно-основных или ионообменных реакциях или одному электрону в окислительно-восстановительных реакциях. Эквивалент как и атом, молекула или ион, безразмерен. Эквивалентные соотношения взаимодействующих в реакциях веществ рассчитываются по закону эквивалентов, установленному Рихтером: «Все в-ва реагируют друг с другом в эквивалентных кол-вах.». Согласно закону, массы участвующих в реакции веществ пропорциональны молярным массам их эквивалентов: m1/m2=Mэ1/Mэ2. Молярная масса эквивалента вещества – это масса одного моль эквивалентов вещества, равноценная в химической реакции массе 1 моль атомов или ионов водорода или количеству электронов 1 моль. Расчет молярной массы эквивалента вещества осуществляется по следующим правилам: 1.Химические элементы. Мэ = М / n, Где Мэ – молярная масса эквивалента элемента, М – молярная масса элемента, n - валентность. 2.Кислоты и основания. Мэ = М / n, Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, n – основность кислоты или кислотность (количество групп ОН) основания. 3.Соли и оксиды. Мэ = М / (N * n), Где Мэ – молярная масса эквивалента вещества, М – молярная масса вещества, N – количество катионов в формуле, n – формальный заряд катиона.
Железо:атомная масса 55,847;порядковый номер железа26=заряд ядра=количество протонов; 56-26=30 количество нейтронов; количество протонов=количеству электронов=26 Схема строения атома: Fe +26 )2 )8 )14 )2. Электронная формула атома 1s 22s 22p 63s 23p64s 23d6 В соединениях железо проявляет степень окисления, в основном +2 и +3, реже +6. Степени окисления +2 соответствует чёрный оксид FeO и зелёный гидроксид Fe(OH)2. Они имеют основный характер. В солях Fe(+2) присутствует в виде катиона. Fe(+2) — слабый восстановитель. Степени окисления +3 соответствуют красно-коричневый оксид Fe2O3 и коричневый гидроксид Fe(OH)3. Они носят амфотерный характер, хотя и кислотные, и основные свойства у них выражены слабо. Железо (+3) чаще всего проявляет слабые окислительные свойства. Степень окисления +6. Соответствующего оксида и гидроксида в свободном виде не существует, но получены соли — ферраты (например, K2FeO4). Железо (+6) находится в них в виде аниона. Ферраты являются сильными окислителями. Химические соединения железа: Соединения
Соединения
Соединения
Ферраты также можно получить электролизом 30%-ного раствора щелочи на железном аноде. Ферраты — сильные окислители. В кислой среде разлагаются с выделением кислорода. Окислительные свойства ферратов используют для обеззараживания воды. Нахождение в природе, применение. Железо – самый распространенный после алюминия металл на земном шаре; оно составляет около 5% земной коры. В свободном виде железо находят в метеоритах, изредка встречается самородное железо (феррит) в земной коре как продукт застывания магмы.Железо входит в состав многих минералов, из которых слагаются месторождения железных руд. В организме человека содержится около 3-х граммов чистого железа, 75% которого входит в состав гемоглобина. Большие запасы железных руд находятся на Урале, где целые горы образованы магнитным железняком. Большие залежи железных руд имеются вблизи Курска, на Кольском полуострове, в Западной и Восточной Сибири, на дальнем Востоке. Богатые залежи имеются на Украине. Чистое железо способно быстро намагничиваться и размагничиваться, поэтому его применяют для изготовления сердечников, трансфо-, мембраноматоров, электромагнитов и мембран микрофонов. Больше всего на практике используют сплавы железа - чугуна и стали. Кобальт. Кобальт — блестящий, серебристо-белый, тяжелый металл с розоватым оттенком. Электронная формула 1s 22s 22p 63s 23p64s 23d7;порядковый номер 27, ст.ок.: 3, 2, 0, -1 Кобальт образует соединения по большей части в степени окисления +2, а реже образует соединения в степени окисления +3 и очень редко в степенях окисления +1, +4 и +5. Химические соединения: Оксиды
Другие соединения
Нахождение в природе, применение. Массовая доля кобальта в земной коре 4·10−3%(в магмах, горячих и холодных водах). В биосфере Кобальт преимущественно рассеивается, однако на участках, где есть растения - концентраторы Кобальта, образуются кобальтовые месторождения. В поверхностных водах Кобальта мало, в Мировом океане его лишь 5·10-8% . Будучи слабым водным мигрантом, Кобальт легко переходит в осадки, адсорбируясь гидрооксидами марганца, глинами и других высокодисперсными минералами.Самый крупный поставщик кобальта — Демократическая Республика Конго[2]. Также есть богатые месторождения в Канаде, США, Франции, Замбии, Казахстане, России. Применение: Сплавы Кобальта используют в качестве жаропрочных и жаростойких материалов, при изготовлении постоянных магнитов, режущего инструмента. Магнитные свойства сплавов находят применение в аппаратуре магнитной записи, а также сердечниках электромоторов и трансформаторов.Порошкообразный Кобальт служит катализатором.Силикат Кобальта и калия - как краски в керамической и стекольной промышленности. Соли Кобальта применяют в сельском хозяйстве как микроудобрения, а также для подкормки животных. В медицине - при лучевой терапии опухолей и для стерилизации медикаментов. Он служит также для уничтожения насекомых в зерне и овощах и для консервирования пищевых продуктов. Никель. Чистый никель – желтовато-белый, пластичный, ковкий и тягучий металл, хорошо полируется. Электронная формула 1s 22s 22p 63s 23p64s 23d8 , атомный номер 28, атомная масса58,693, Степени окисления: 3, 2, 0. Образует соединения чаще всего в степени окисления +2 , реже — в степени окисления +3 и очень редко в степенях окисления +1 и +4. Наиболее устойчивы соединения +2, для которых известны большое количество обычных и комплексных соединений. Соединения никеля У никеля два оксида – оксид никеля (II) NiO и оксид никеля (III) Ni2O3 и соответственно два ряда соединений. Наиболее устойчивы соединения никеля (II); соединения никеля (III) проявляют окислительные свойства, они нестойки. Оксид никеля (II) NiO – проявляет амфотерные свойства, реагирует с кислотами, при спекании со щелочами и оксидами типичных металлов: NiО + 2HCl (разб.) → NiCl2 + H2О Гидроксид
никеля (II) Ni(OH)2 –
проявляет амфотерные свойства,
реагирует с разбавленными кислотами,
щелочами при спекании, является слабым
восстановителем:
Ni(OH)2 Гидроксид никеля (III) Ni(OH)3 получается в виде черно-бурого осадка при действии окислителей на гидроксид никеля (II). Известны соли никеля (II) практически со всеми обычными анионами. Безводные соли в отличие от зеленых кристаллогидратов часто имеют желтый цвет с разными оттенками. Таковы, например, фторид NiF2, хлорид NiCl2 никеля. Иодид никеля NiI2черного цвета. Подобно железу и кобальту, никель образует комплексные соединения. Например, действием избытка гидроксида аммония на сульфат никеля (II) получают аммиакаты: NiSO4 + 6NH4OH → [Ni(NH3)6]SO4 + 6H2O эта соль растворима в воде, сообщает раствору интенсивно-синюю окраску. Нахождение в природе. Его содержание в земной коре составляет ок. 0,01 %(масс.),в воде океанов — 0,002 мг/л.В земной коре встречается только в связанном виде, в железных метеоритах содержится самородный никель (до 8 %). Самая распространенная в научных кругах и наиболее достоверная гипотеза строения Земли утверждает, что структура ядра нашей планеты подобна составу железных метеоритов:8,5 % никеля , 0,6 % кобальта. Исходя из этой гипотезы, можно утверждать, что Земля примерно на 3 % состоит из никеля. Основной источник никеля — промышленные никелевые руды, которые подразделяются на сульфидные медно-никелевые и силикатные. Мировым лидером по добыче никеля является Россия, где также находятся и основные месторождения никелевых руд (в основном на Урале). Среди зарубежных стран по размерам добычи никелевых руд выделяются Канада, Филлипины, Индонезия, Австралия, Китай и Финляндия. Применение. Сплавы:Никель является основой большинства суперсплавов — жаропрочных материалов, применяемых в аэрокосмической промышленности для деталей силовых установок. Никелирование — создание никелевого покрытия на поверхности другого металла с целью предохранения его от коррозии. Производство железо-никелевых, никель-кадмиевых, никель-цинковых, никель-водородных аккумуляторов. Медицина:протезирование. Широко применяется при производстве монет во многих странах(США). Также никель используется для производства обмотки струн музыкальных инструментов.
Латунь – сплав меди и цинка
m (Cu)-? m (Zn)-? |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
5 |
ХИМИЧЕСКИЕ ЯВЛЕНИЯ -явления, при которых одни вещества, обладающие определенным составом и свойствами, превращаются в другие вещества - с другим составом и другими свойствами. При этом в составе атомных ядер изменений не происходит. Химические явления называют иначе химическими реакциями. Простое вещество – вещество в состав которого входят атомы одного химического элемента. Сложное вещество- вещество в состав которого входят атомы разных химических элементов. Хими́ческий элеме́нт — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым (атомным) номером в таблице Менделеева. Мета́ллы — группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими как высокие тепло- и электропроводность, положительныйтемпературный коэффициент сопротивления, высокая пластичность и металлический блеск. Немета́ллы — химические элементы с типично неметаллическими свойствами, которые занимают правый верхний угол Периодической системы. Расположение их в главных подгруппах соответствующих периодов следующее:
Кроме того, к неметаллам относят также водород и гелий. А́томная ма́сса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода Молекуля́рная ма́сса (менее правильный термин: молекулярный вес) — масса молекулы, выраженная в атомных единицах массы. Численно равна молярной массе. MrH2O = 2 ArH + ArO ≈ 2·1+16 = 18 а. е. м. Mr-молекулярная масса; Ar-атомная масса. Моля́рная ма́сса вещества — масса одного моля вещества. Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль). Моль - единица измерения количества вещества в Международной системе единиц (СИ), одна из семи основных единиц СИ Точное определении- Моль есть количество вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. При применении моля структурные элементы должны быть специфицированы и могут быть атомами, молекулами, ионами, электронами и другими частицами или специфицированными группами частиц.
Хром — элемент побочной подгруппы 6-ой группы 4-го периода периодической системы химических элементов Менделеева с атомным номером 24. Обозначается символом Cr(лат. Chromium). Простое вещество хром— твёрдый металлголубовато-белого цвета. Электронная формула- 1s 22s 22p 63s 23p64s 13d5 Соединения и степени окисления: Соединения Cr(+2) Степени окисления +2 соответствует основный оксид CrO (чёрный). Соли Cr2+ (растворы голубого цвета) получаются при восстановлении солей Cr3+ или дихроматов цинком в кислой среде («водородом в момент выделения»):
Соединения Cr(+3) cтепени окисления +3 соответствует амфотерный оксид Cr2O3 и гидроксид Cr(OH)3 Гидроксид хрома (III) получают, действуя аммиаком на растворы солей хрома (III):
Соединения хрома (+4)
Среди тетрагалогенидов хрома устойчив CrF4, тетрахлорид хрома CrCl4 существует только в парах. Соединения хрома (+6) Степени окисления +6 соответствует кислотный оксид хрома (VI) CrO3 и целый ряд кислот, между которыми существует равновесие. Оксид хрома (VI) CrO3 образуется при взаимодействии концентрированной серной кислоты с растворами дихроматов. Типичный кислотный оксид, при взаимодействии с водой он образует сильные неустойчивые хромовые кислоты: хромовую H2CrO4, дихромовую H2Cr2O7 и другие изополикислоты с общей формулой H2CrnO3n+1. Увеличение степени полимеризации происходит с уменьшением рН, то есть увеличением кислотности:
Применение Хром — важный компонент во многих легированных сталях (в частности, нержавеющих), а также и в ряде других сплавов. Добавка хрома существенно повышает твердость и коррозийную стойкость сплавов. Используется в качестве износоустойчивых и красивых гальванических покрытий Получение: Чтобы получить чистый хром, реакцию ведут следующим образом: 1) сплавляют хромит железа с карбонатом натрия (кальцинированная сода) на воздухе:
2) растворяют хромат натрия и отделяют его от оксида железа; 3) переводят хромат в дихромат, подкисляя раствор и выкристаллизовывая дихромат; 4) получают чистый оксид хрома восстановлением дихромата натрия углём:
5) с помощью алюминотермии получают металлический хром:
6) с помощью электролиза получают электролитический хром из раствора хромового ангидрида в воде, содержащего добавку серной кислоты. При этом на катодах совершаются в основном 3 процесса:
Нахождение в природе: Хром встречается в природе в основном в виде хромистого железняка Fe(CrO2)2 (хромит железа). Из него получают феррохром восстановлением в электропечах коксом(углеродом):
Феррохром применяют для производства легированных сталей. Ма́рганец — элемент побочной подгруппы седьмой группы четвёртого периода периодической системы химических элементов Менделеева с атомным номером 25. . Простое вещество марганец— металл серебристо-белого цвета. Электронная формула- 1s 22s 22p 63s 23p64s 23d5 Характерные степени окисления марганца:0, +2, +3, +4, +6, +7 C соляной и серной кислотами реагирует по уравнению:
С концентрированной серной кислотой реакция идёт по уравнению:
С разбавленной азотной кислотой реакция идёт по уравнению:
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7. При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты :
Применение в промышленности Марганец в виде ферромарганца применяется для «раскисления» стали при её плавке, то есть для удаления из неё кислорода. Кроме того, он связывает серу, что также улучшает свойства сталей Арсенид марганца обладает гигантским магнитокалорическим эффектом, усиливающимся под давлением. Теллурид марганца перспективный термоэлектрический материал (термо-э.д.с 500 мкВ/К). Нахождение в природе: Марганец — 14-й элемент по распространённости на Земле, а после железа — второй тяжёлый металл, содержащийся в земной коре (0,03 % от общего числа атомов земной коры). Минералы марганца
Получение
V=1л=1000мл М(HCI)=36.5г/моль
См-?
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
6 |
Термохимия — раздел химической термодинамики, в задачу которой входит определение и изучение тепловых эффектов реакций, а также установление их взаимосвязей с различными физико-химическими параметрами. Ещё одной из задач термохимии является измерение теплоёмкостей веществ и установление их теплот фазовых переходов. Закон Гесса и следствие. Закон Гесса — основной закон термохимии, который формулируется следующим образом: Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания. Иными словами, количество теплоты, выделяющееся или поглощающееся при каком-либо процессе, всегда одно и то же, независимо от того, протекает ли данное химическое превращение в одну или в несколько стадий (при условии, что температура, давление и агрегатные состояния веществ одинаковы). Например, окисление глюкозы в организме осуществляется по очень сложному многостадийному механизму, однако суммарный тепловой эффект всех стадий данного процесса равен теплоте сгорания глюкозы. Следствия:
Магний эл. строение: 1s 22s 22p 63s 2 степень окисления: 0, +2 Магний присутствует в горных кристаллических породах в форме нерастворимого карбоната или сульфата Берилий эл. строение: 1s 22s 2 степень окисления: 0, +2 бериллий относится к редким элементам, его содержание в земной коре 2,6·10–4 % по массе. В морской воде содержится до 6·10–7 мг/л бериллия. Алюминий. эл. строение: 1s 22s 22p 63s 23p1 степень окисления: 0, +3 По распространённости в земной коре Земли занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию Титан. эл. строение: 1s 22s 22p 63s 23p64s 23d2 степень окисления: 0, +2, +3, +4 Титан относится к числу наиболее распространённых в природе элементов, его содержание в земной коре составляет 0,6% (весовых). Встречается главным образом в виде двуокиси TiO2 или её соединений — титанатов.
Число Авогадро показывает число молекул в 1 моле любого вещества. Это 1 грамм массы, выраженный в атомных единицах массы. 1 грамм=6,02*10^23 а. е. м.
NA=6.02*1023
n=
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
7 |
Хими́ческая термодина́мика — раздел физической химии, изучающий процессы взаимодействия веществ методами термодинамики. Основными направлениями химической термодинамики являются:
Первый закон термодинамики: Внутренняя энергия может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы. Внутренняя энергия: это сумма энергий теплового движения молекул и межмолекулярных взаимодействий. В аксиоматической термодинамике движение молекул не рассматривается, и внутренняя энергия термодинамической системы определяется как функция состояния системы, приращение которой в любом процессе для адиабатически изолированной системы равно работе внешних сил при переходе системы из начального состояния в конечное. Энтальпия: термодинамический потенциал, характеризующий состояние системы в термодинамическом равновесии при выборе в качестве независимых переменных давления, энтропии и числа частиц. Проще говоря, энтальпия — это та энергия, которая доступна для преобразования в теплоту при определенном постоянном давлении.
химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов. Кристаллическая структура металлов: Металлы являются кристаллическими материалами, т.е. характеризуются трехмерной периодичностью в расположении атомов. При этом конкретное расположение атомов и расстояния между ними различны для различных металлов, совокупность атомов образует кристаллическую решетку. Характеристикой кристаллической структуры является элементарная ячейка – параллелепипед минимальных размеров, в вершинах, а также внутри которого расположены атомы и параллельным перенесением которого можно целиком заполнить пространство. Типы кристаллических решеток металлов:
Эл. Формула: 1s2 2s2p6 3s2p6d10 4s2p6d10f14 5s2p6d10 6s2p2 Pb-
6 период 4 главная подгруппа заряд
ядра Pb+82, электронов
82,
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
8 |
Второе начало термодинамики имеет несколько формулировок. Формулировка Клаузиуса:невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой. Формулировка Томсона: невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды. Формулировка Больцмана: Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему. Давайте посмотрим, как она работает, на примере воды. В жидком состоянии вода представляет собой довольно неупорядоченную структуру, поскольку молекулы свободно перемещаются друг относительно друга, и пространственная ориентация у них может быть произвольной. Другое дело лед — в нем молекулы воды упорядочены, будучи включенными в кристаллическую решетку. Формулировка второго начала термодинамики Больцмана, условно говоря, гласит, что лед, растаяв и превратившись в воду (процесс, сопровождающийся снижением степени упорядоченности и повышением энтропии) сам по себе никогда из воды не возродится.Энтропия не может уменьшаться в замкнутых системах — то есть, в системах, не получающих внешней энергетической подпитки. Или, холодильник не работает, если он не включен в розетку! Или, частицы, оказавшись в беспорядочном хаотичном состоянии не возвращаются в порядок самопроизвольно. Второй закон связан с понятием энтропии (S). Энтропия порождается всеми процессами, она связана с потерей системы способности совершать работу. Рост энтропии - стихийный процесс. Если объем и энергия системы постоянны, то любое измение в системе увеличивает энтропию. Если же объем или энергия системы меняются, энтропия системы уменьшается. Однако, энтропия вселенной при этом не уменьшается. Для того, чтобы энергию можно было использовать, в системе должны быть области с высоким и низким уровнями энергии. Полезная работа производится в результате передачи энергии от области с высоким уровнем энергии к области с низким уровнем энергии.
Направление химических реакций. Движущие силы химической реакции обусловлены ее стремлением к уменьшению запаса энергии, т.е. к уменьшению энтальпии при p = const и ее стремлением к увеличению энтропии. В ходе химической реакции участвующие частицы перегруппировываются таким образом, чтобы уменьшалась энергия системы; это проявляется в их сближении и взаимодействии. Вместе с тем реагирующие частицы обладают отчетливой тенденцией к беспорядочному расположению. Эти два фактора обусловливают химическую обратимость реакций; преобладающее направление реакции определяется значением и знаком величин ΔH и ΔS. критерием самопроизвольного протекания химических реакций является отрицательное значение энергии Гиббса: ΔG < 0 Для экзотермических реакций (ΔH < 0) величина ΔG также, как правило, меньше нуля, поскольку в уравнении ΔG = ΔH - TΔS при ΔS > 0 вычитаемое будет всегда отрицательным, а при ΔS < 0 - положительным, но небольшим по значению вплоть до очень высоких температур, и, следовательно, не превышающим отрицательного значения ΔH. Для эндотермических реакций (ΔH > 0), имеющих ΔS < 0, их протекание в заданном направлении невозможно ни при какой температуре, т.к. всегда ΔG > 0. Для реакций с ΔS > 0 их протекание возможно, но только при таких высоких температурах, когда вычитаемое (- TΔS) превысит положительное значение энтальпии реакции. Таким образом, принципиальную возможность протекания химического процесса и его направление можно определить, рассчитав значение ΔG. По значению стандартной энергии Гиббса реакции можно рассчитать значение константы равновесия K и сделать вывод о положении равновесия. Для рассчета энергии Гиббса реакции необходимо использовать выражение:
где R - универсальная газовая постоянная: 8.31441 Дж/(моль·K). Для обратимых реакций можно найти такое значение температуры, при которой K = 1 и ΔG° = 0. При этой температуре (она обозначается так: T↔) протекание прямой и обратной реакции равновероятно; эта температура называется температурой равновесия протекания реакции. Между энергией Гиббса реакции и константой равновесия существует соответствие:
Таким образом, преобладающее направление протекания обратимой реакции определяется знаком энергии Гиббса; практически важное прямое направление реакции, т.е. сдвиг равновесия в сторону образования продуктов преобладает при условии ΔGT << 0 K >> 1. Для кислотно-основных реакций, протекающих в водном растворе, величина ΔG°T определяется выражением:
где pKkI = -lgKkI и pKkII = -lgKkII; KkI - константа кислотности реагента - кислоты (справочное значение), KkII - константа кислотности реагента - основания (справочное значение). Для окислительно-восстановительных реакций, протекающих в водном растворе, величины ΔG°T рассчитывают по соотношению:
где ze - число электронов, переданное от восстановителя к окислителю в реакции; E°Ox - стандартный потенциал окислителя (справочная величина); E°Red - стандартный потенциал восстановителя (справочная величина); F - постоянная Фарадея (96485 Кл).
Обогащение руды — совокупность методов разделения металлов и минералов друг от друга по разнице в их физических и/или химических свойств. Природное минеральное сырьё, которое представляет собой естественную смесь ценных компонентов и пустой породы, перерабатывается с целью получения концентратов, существенно обогащенных одним или несколькими ценными компонентами. Обогащение руды является сложным процессом, который может включать такие операции как дробление, измельчение, флотация,обезвоживание, другие физико-химические методы, и т. д.. Полученные продукты классифицируются на два и более классов отличных по качеству, более богатый продукт называют концентратом, самый бедный — хвостами, продукты со средним содержанием называют промежуточными, они обычно возвращаются на переработку. Обогащение руды как правило производится на горнообогатительных фабриках и комбинатах. Пирометаллургия — совокупность металлургических процессов, протекающих при высоких температурах. Это отрасль металлургии, связанная с получением и очищением металлов и металлических сплавов при высоких температурах, в отличие от гидрометаллургии, к которой относятся низкотемпературные процессы. Пирометаллургическими процессами являются процессы агломерации металлургического сырья, плавки шихтовых материалов, изготовления сплавов, рафинирования металлов. В частности, это — обжиг, доменная плавка, мартеновская плавка, плавка в конвертерах, дуговыхи индукционных печах. Пирометаллургия — основа производства чугуна, стали, свинца, меди, цинка и др. Гидрометаллургия (от гидро... и металлургия), извлечение металлов из руд, концентратов и отходов различных производств водными растворами химических реагентов с последующим выделением металлов из растворов. Г. включает ряд основных технологических операций, выполняемых в определённой последовательности. Механическая обработка руды — дробление и измельчение с целью полного или частичного раскрытия зёрен минералов, содержащих извлекаемый металл. Изменение химического состава руды или концентрата для подготовки их квыщелачиванию — хлорирующий, окислительных, сульфатизирующий или восстановительный обжиг, спекание. Цель — разложение химических соединений извлекаемого металла и перевод их в растворимую форму. Выщелачивание — перевод извлекаемого металла в водный раствор. Эта операция иногда осуществляется попутно в процессе мокрого измельчения (в мельницах, классификаторах) или в специальной аппаратуре (чаны для выщелачивания, автоклавы). Отделение металлосодержащего раствора от измельченного материала обезвоживанием и промывкой в сгустителях, на фильтрах. Подготовка растворов к выделению из них соединений или металлов отделением взвешенных частиц (осветление) или химическим осаждением сопутствующих металлов и примесей. Осаждение металлов или их соединений из растворов электролизом (медь, цинк и др.), восстановлением более электроотрицательным металлом —цементацией (медь, серебро, золото и др.), сорбцией ионообменными смолами или углем, жидкостной экстракцией соединений металла органическими растворителями с последующей реэкстракцией в водный раствор и осаждением из него чистого металла или химического соединения. Переработка осадка с целью дальнейшей очистки выделенного соединения или чернового металла или непосредственное получение готового товарного металла может осуществляться: перекристаллизацией, возгонкой, прокаливанием, переплавкой, электролизом из водных или расплавленных сред.
Электроннолучевая плавка, плавка в электроннолучевой печи, происходящая при высокой температуре и глубоком вакууме, что обеспечивает протекание многих реакций рафинирования, невозможных в иных условиях (например, при вакуумной дуговой плавке и индукционной плавке в тиглях из тугоплавких окислов). Применяется для получения особо чистых тугоплавких металлов и сплавов, крупных слитков из стали и сплавов для деталей ответственного назначения и в других случаях. Основные достоинства Э. п.: регулирование в широких пределах скорости наплавления, определяющей благоприятную для последующей обработки макроструктуру слитка; возможность высокого перегрева металлов, позволяющего в сочетании с глубоким вакуумом удалить вредные примеси (например, цветные металлы); глубокая дегазация металла в вакууме; отсутствие контакта жидкого металла с загрязняющей его футеровкой; переплав практически любой шихты и возобновление процесса плавки после случайного перерыва без ухудшения качества слитка. При получении слитков большой массы (нескольких десятков т) важное достоинство процесса — возможность переплава сравнительно небольших заготовок, попеременно подаваемых в зону плавления. Жидкий металл поступает в кристаллизатор либо непосредственное переплавляемой заготовки, либо из промежуточной ёмкости, где он дополнительно рафинируется. В результате Э. п. в 2—4 раза снижается содержание газовых примесей и неметаллических включений, повышаются плотность металла, изотропность его свойств. Ответственные изделия, например роторы мощных паровых турбин, изготовленные из металла, выплавленного в электроннолучевой печи, обладают вдвое более высоким сопротивлением хрупкому разрушению по сравнению с ротором из стали, выплавленной, например, в обычной дуговой печи, и, следовательно, более надёжны. Зо́нная пла́вка (зо́нная перекристаллиза́ция) — метод очистки твёрдых веществ, основанный на различной растворимости примесей в твердой и жидкой фазах. Метод является разновидностью направленной кристаллизации, от которой отличается тем, что в каждый момент времени расплавленной является некоторая небольшая часть образца. Такая расплавленная зона передвигается по образцу, что приводит к перераспределению примесей. Если примесь лучше растворяется в жидкой фазе, то она постепенно накапливается в расплавленной зоне, двигаясь вместе с ней. В результате примесь скапливается в одной части исходного образца. По сравнению с направленной кристаллизацией этот метод обладает большей эффективностью.
При вакуумном дуговом переплаве под воздействием высоких температур, возникающих в зоне электрической дуги между переплавляемым электродом и поддоном кристаллизатора, сталь на нижнем торце электрода расплавляется и капли расплавленного металла падают в ванну, где под воздействием охлаждения кристаллизатора формируется слиток. До начала операции печь вакуумируют (остаточное давление обычно не более 1,33 Па); вакуумные насосы продолжают работать в течение всей плавки. Таким образом, капли металла падают через вакуумированное пространство, при этом обеспечивается очень полное очищение металла от газов, оксидных неметаллических включений (общее содержание кислорода снижается до очень низких пределов), от примесей некоторых цветных металлов и получается плотный слиток. Достоинством способа вакуумного дугового переплава является отсутствие контакта металла с огнеупорной футеровкой, недостатком — невозможность снижения содержания серы (отсутствие шлаковой фазы). Дуговая выплавка отличается высокой концентрацией тепла в дуге, поэтому вакуумный дуговой переплав получил широкое распространение при производстве слитков из тугоплавких металлов (титана, циркония, ниобия, молибдена, вольфрама и др.). Схему, при применении которой электрод переплавляется, называют вакуумный дуговой переплав с расходуемым электродом. Сущность метода заключается в том, что исходное вещество переводится в парообразное состояние и контактирует с подложкой, нагретой до температуры, при которой оно разлагается или реагирует с другим соединением с образованием на подложке слоя металла или его нелетучих соединений и газообразных продуктов, которые удаляются из зоны реакции. Осаждение может проводится как в вакууме, так и в токе газа-носителя (аргон, азот, гелий, углекислый газ). В ряде случаев процесс термического разложения осуществляют в окислительной или восстановительной среде или в присутствии паров соединений, способствующих разложению исходных соединений[3].
n=1моль n=1моль M=56 г/моль М=63г/моль m=56 г m=63 г 1)m(HNO3)-? V=100мл М(HNO3)=63г/моль=1,26г См=0.2M
2)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
9 |
Кинетика химическая, кинетика химических реакций, учение о химических процессах — о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных и торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации. Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрациякоторого убывает в процессе реакции), то полученное значение умножается на −1. Скорость химической реакции в каждый момент времени пропорциональна концентрациям реагентов, возведенным в степени, равные их стехиометрическим коэффициентам. Для элементарных реакций показатель степени при значении концентрации каждого вещества часто равен его стехиометрическому коэффициенту, для сложных реакций это правило не соблюдается. Кроме концентрации на скорость химической реакции оказывают влияние следующие факторы:
Цепные реакции, химические и ядерные реакции, в которых появление промежуточной активной частицы (свободного радикала, атома или возбуждённой молекулы — в химических, нейтрона — в ядерных процессах) вызывает большое число (цепь) превращений исходных молекул или ядер вследствие регенерации активной частицы в каждом элементарном акте реакции (в каждом звене цепи). КОЛЕБАТЕЛЬНЫЕ РЕАКЦИИ, реакции, в ходе которых концентрации промежут. соединений и скорость реакции испытывают колебания. Колебания м. б. периодическими, в этом случае значения c(t) колеблющихся концентраций (t - время) можно представить рядом Фурье:
где аn, bn - коэффициенты разложения ф-ции c(t) в рад (амплитуды отдельных гармонич. компонент), An - комплексные амплитуды, w - частота колебаний (i - мнимая единица). В общем случае амплитуды и частоты колебаний могут изменяться во времени (колебания затухающие, нарастающие, модулированные). Колебания концентрацийпромежут. соед. могут быть непериодическими или иметь непрерывный спектр. Колебания концентраций промежут. соед. - относительно редкое явление, наблюдаемое в ходе некоторых сложных реакций. Элементарные хим. реакции являются релаксац. процессами, обеспечивающими монотонное приближение реагирующей системы к состоянию термодинамич. равновесия. Для возникновения колебаний в ходе гомог. изотермич. реакции необходимо наличие промежут. соед. и взаимодействие между ними. В открытых системах существуют стационарные состояния, в которыхконцентрация c(i) i-го промежут. соед. не зависит от времени (сi=c0i). При небольших отклонениях системы от стационарного состояния изменение сi описывается суммой экспонент с комплексными показателями:
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2% железа — 4,1% кальция — 4,1% натрия — 2,3% магния — 2,3% калия - 2,1 % титана — 0,56% Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%. В природе металлы встречаются в различном виде: — в самородном состоянии: серебро , золото , платина , медь , иногда ртуть — в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др. — в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др. — различных солей: Железо. По содержанию в литосфере (4,65% по массе) Железо занимает второе место среди металлов (на первом алюминий). Оно энергично мигрирует в земной коре, образуя около 300 минералов (окислы, сульфиды, силикаты, карбонаты, титанаты, фосфаты и т. д.). Железо принимает активное участие в магматических, гидротермальных и гипергенных процессах, с которыми связано образование различных типов его месторождений. Железо - металл земных глубин, оно накапливается на ранних этапах кристаллизации магмы, в ультраосновных (9,85%) и основных (8,56%) породах (в гранитах его всего 2,7%). В биосфере Железо накапливается во многих морских и континентальных осадках, образуя осадочные руды. Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красные железняки (руда гематит, Fe2O3; содержит до 70% Fe), магнитные железняки (руда магнетит, Fe3О4; содержит 72,4% Fe), бурые железняки (руда гидрогетит НFeO2·nH2O), а также шпатовые железняки (руда сидерит, карбонат железа, FeСО3; содержит около 48% Fe). В природе встречаются также большие месторождения пирита FeS2 (другие названия -- серный колчедан, железный колчедан, дисульфид железа и другие), но руды с высоким содержанием серы пока практического значения не имеют. По запасам железных руд Россия занимает первое место в мире. В морской воде 1·10-5 -- 1·10-8% железа. Одним из крупнейших месторождений железа в Казахстане является Соколовско - Сарбайское месторождение в Костанайской области. Кобальт. В земной коре содержание кобальта равно 410-3% по массе. Кобальт входит в состав более 30 минералов. К ним относятся каролит CuCo2SO4, линнеит Co3S4, кобальтин CoAsS, сферокобальтит CoCO3, смальтит СоAs2 и другие. Как правило, кобальту в природе сопутствуют его соседи по 4-му периоду -- никель, железо, медь и марганец. В морской воде приблизительно (1-7)·10-10 % кобальта. Никель. В земной коре содержание никеля составляет около 8·10-3 % по массе. Возможно, громадные количества никеля -- около 17·1019 т -- заключены в ядре Земли, которое, по одной из распространенных гипотез, состоит из железоникелевого сплава. Если это так, то Земля примерно на 3 % состоит из никеля, а среди составляющих планету элементов никель занимает пятое место -- после железа, кислорода, кремния и магния. Никель содержится в некоторых метеоритах, которые по составу представляют собой сплав никеля и железа (так называемые железоникелевые метеориты). Разумеется, как практический источник никеля такие метеориты значения не имеют. Важнейшие минералы никеля: никелин (современное название купферникеля) NiAs, пентландит [сульфид никеля и железа состава (Fe,Ni)9S8], миллерит NiS, гарниерит (Ni,Mg)6Si4O10(OH)2 и другие никельсодержащие сил икаты. В морской воде содержание никеля составляет примерно 1·10-8-5·10-8 %.
Мельхиор- Cuи Ni
m (Cu)-? M (Ni)-?
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
10 |
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. А2 + В2 ⇄ 2AB Принцип Ле Шателье — Брауна (1884 г.) — если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия. Анри Ле Шателье (Франция) сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый Карлом Брауном Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому (эффект Ленца, явление Пельтье) Влияние температуры Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
Например, в реакции синтеза аммиака N2 + 3H2 ⇄ 2NH3 + Q тепловой эффект в стандартных условиях составляет -92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта. Влияние давления Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам: При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот. В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3 Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
Влияние инертных газов Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов. Влияние концентрации Влияние концентрации на состояние равновесия подчиняется следующим правилам:
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Физические свойства металлов В простых веществах, образованных атомами элементов-металлов, доминирующим типом химической связи является металлическая. Металл рассматривают как плотно упакованную структуру из катионов, погруженных в “электронный газ” (газ Ферми) (более подробно см. главу “Химическая связь”). Наличие в металлах свободных электронов (электронного газа) определяет общие для всех металлов физические свойства: высокую электро- и теплопроводность, металлический блеск (как правило в компактном состоянии), преимущественно серый цвет (исключения - медь, золото); легкую механическую деформируемость (пластичность) и ковкость; способность испускать электроны под действием высокочастотного облучения (фотоэффект) или высоких температур (термоэлектронная эмиссия); компактность кристаллических структур. Наряду с общими свойствами каждый металл имеет и свои индивидуальные особенности. К ним относят: строение кристаллических решеток; для металлов характерны, в основном, три вида решеток: кубическая объемно-центрированная (координационное число 8, плотность упаковки или часть пространства в данном кубе, занятая шарообразными ионами, составляет 68%); кубическая гранецентрированная (координационное число 12 и плотность упаковки 74%) и гексагональная (координационное число 12 и плотность упаковки также 74%). Особенности кристаллических решеток металлического типа обусловливают характерные физические свойства металлов. Так, железо имеет четыре полиморфные модификации (рис.1). До 770 C устойчиво a-железо с объемно-центрированной кубической решеткой и ферромагнитными свойствами. При 770 C a -железо переходит в b - железо; кристаллическая структура его существенно не изменяется, железо становится парамагнитным. При 910 C происходит полиморфное превращение, при котором кристалл из объемно-центрированной переходит в гранецентрированную кубическую структуру g - железо: металл остается парамагнитным. При 1400 C происходит новый полиморфный переход: образуется d - железо с объемно-центрированной кубической решеткой, которая существует вплоть до температуры плавления железа (1539 C). Плотность металлов (r). Она определяется типом кристаллической решетки металла и радиусом его атома. Чем больше радиус атома металла, тем меньше его плотность. Наименьшие объемы (следовательно, наибольшую плотность) имеют атомы, расположенные в середине периодов: - кобальт, никель, медь (4 период); рутений, родий, палладий (5 период); осмий, иридий, платина (6 период). Условно металлы подразделяют на легкие - r < 5000 кг/м3 (5 г/см3) и тяжелые r > 5000 кг/м3 (5 г/см3). К легким металлам относят щелочные, щелочноземельные металлы, бериллий, магний, алюминий, скандий, иттрий и титан; к тяжелым - все остальные. Температура плавления. Из всех известных металлов при стандартных условиях в жидком состоянии находится только ртуть (t = -39,2 С). Наиболее легкоплавкими из них являются цезий (28,5 C); галлий (29,78 C); и рубидий (39 C). В малых периодах температуры плавления металлов с увеличением порядкового номера элемента возрастают, что связано с увеличением плотности упаковки кристаллической решетки металла. В больших периодах по этой же причине температура плавления увеличивается до середины периода, а затем уменьшается. Следовательно, самые тугоплавкие металлы, например, вольфрам (t = 3422 С) находятся в середине больших периодов. Пластичность. Наличие свободных электронов в структуре металла допускает смещение ионов, расположенных в узлах кристаллической решетки, без разрыва химической связи между ними. Благодаря этому металлы обладают способностью сохранять деформацию, изменять форму под воздействием механических нагрузок, не разрушаясь, прокатываться в листы и проволоку. Наиболее пластичные металлы: золото, серебро, медь, олово, свинец, цинк, железо и др. Электро и теплопроводность. Для металлов характерны высокие значения электро- и теплопроводности. Наибольшей электропроводностью обладают серебро, медь, золото, алюминий, железо и др. Кроме перечисленных общих и индивидуальных физических свойств металлов, можно выделить и другие их характеристики: электромагнитные, оптические и механические. 2. Химические свойства металлов Характерным химическим свойством металлов является их восстановительная активность, т.е. способность переходить в состояние положительно заряженного иона, теряя при этом электроны: Количественно восстановительная активность металлов определяется: величиной Eи атома металла (для реакций, протекающих в газовой фазе); величиной стандартного электродного потенциала металла j Men+/Me (для реакций, протекающих в растворах). При этом следует иметь в виду тот факт, что величина j Men+/Me изменяется в зависимости от условий процесса, т.к. образовавшиеся ионы Men+ могут участвовать в процессе комплексообразования. Химические свойства Основные оксиды 1. Основный оксид + сильная кислота → соль + вода
2. Сильноосновный оксид + вода → гидроксид
3. Сильноосновный оксид + кислотный оксид → соль
4. Основный оксид + водород → металл + вода
Примечание: металл менее активный, чем алюминий. Кислотные оксиды 1. Кислотный оксид + вода → кислота
Некоторые оксиды, например SiO2, с водой не вступают в реакцию, поэтому их кислоты получают косвенным путём. 2. Кислотный оксид + основный оксид → соль
3. Кислотный оксид + основание → соль + вода
Если кислотный оксид является ангидридом многоосновной кислоты, возможно образование кислых или средних солей:
4. Нелетучий оксид + соль1 → соль2 + летучий оксид
5. Ангидрид кислоты 1 + безводная кислородосодержащая кислота 2 → Ангидрид кислоты 2 + безводная кислородосодержащая кислота 1
Амфотерные оксиды При взаимодействии с сильной кислотой или кислотным оксидом проявляют основные свойства:
При взаимодействии с сильным основанием или основным оксидом проявляют кислотные свойства:
Гальванически элемент из никеля и серебра Ni+Ag+→Ni2++Ag Ag++1электрон→Ag
½Ni=1/2Ni+1электрон
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
11 |
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10–10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно. В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871—1937) по рассеянию a-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки a-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость (порядка 107 м/с)). Резерфорд, исследуя прохождение a-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые a-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц, как a-частицы, то Резерфордом был сделан вывод, что значительное отклонение a-частиц обусловлено их взаимодействием с положительным зарядом большой массы. Однако значительное отклонение испытывают лишь немногие a-частицы; следовательно, лишь некоторые из них проходят вблизи данного положительного заряда. Это, в свою очередь, означает, что положительный заряд атома сосредоточен в объеме, очень малом по сравнению с объемом атома. На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Zе (Z — порядковый номер элемента в системе Менделеева, е — элементарный заряд), размер 10–15—10–14 м и массу, практически равную массе атома, в области с линейными размерами порядка 10–10 м по замкнутым орбитам движутся электроны, образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
1. МЕТАЛЛИЧЕСКИЕ ЗАЩИТНЫЕ ПОКРЫТИЯ Металлические защитные покрытия наносятся на поверхности (металл, стекло, керамика, пластмассы и др.) для защиты их от коррозии, придания твердости, электропроводности, износостойкости и в декоративных целях. Защита от коррозии металлическими покрытиями осуществляется следующими способами: - металлизация напылением - распыление на обрабатываемую поверхность расплавленного металла при помощи воздушной струи; - горячий способ нанесения защитного покрытия - окунание изделия в ванну с расплавленным металлом; - гальванический (электролитический) - осаждение металла или сплава из водных растворов их солей на поверхность изделия, постоянно пропуская через электролит электрический ток; - плакирование (термомеханический) - нанесение на поверхность основного металла - другого, более устойчивого к агрессивной среде, применяя литье, совместную прокатку или деформированное плакирование (прессование, ковка); - диффузионный - суть способа заключается в проникновении металлопокрытия в поверхностный слой основного металла под воздействием высокой температуры. НЕМЕТАЛЛИЧЕСКИЕ ЗАЩИТНЫЕ ПОКРЫТИЯ Неметаллические защитные покрытия применяются для изоляции металлических изделий, их защиты от воздействия внешней среды (влаги), придания красивого вида. Неметаллические защитные покрытия принято разделять на лакокрасочные, полимерные, покрытия резинами, смазками, силикатными эмалями, пастами. ЛАКОКРАСОЧНЫЕ ЗАЩИТНЫЕ ПОКРЫТИЯ. Лакокрасочные защитные покрытия широко распространены и применяются наиболее часто. В состав покрытия входят пленкообразующие вещества, наполнители, пигменты, пластификаторы, растворители, катализаторы. Покрытие такого рода не только хорошо защищает изделие в различных атмосферах, но и придают ему приятный внешний вид. Кроме того, варьируя состав и используемые материалы, получают покрытия с специфическими свойствами (токопроводящие, необрастающие, светящиеся, декоративные, с повышенной прочностью, жаростойкостью, кислотостойкостью и т.п.). Лакокрасочные защитные покрытия в свою очередь подразделяются на лаки, краски, эмали, грунтовки, олифы и шпаклевки. ПОЛИМЕРНЫЕ ЗАЩИТНЫЕ ПОКРЫТИЯ. Полимерные защитные покрытия наносятся на поверхность изделия в виде горячей смолы с целью защиты его от внешней среды. Покрытие смолой может осуществляться окунанием, газотермическим или вихревым напылением, а также обычной кистью. После остывания на поверхности образуется защитная сплошная пленка из полимера, толщиной обычно пару миллиметров. Наиболее распространенные полимеры, применяющиеся с целью защиты от коррозии, это: полистирол, полиэтилен, полипропилен, полиизобутилен, фторопласты, эпоксидные смолы и др. Полимерные защитные покрытия могут быть применены в качестве футеровки химических аппаратов, резервуаров (емкостей). ЗАЩИТНОЕ ПОКРЫТИЕ РЕЗИНАМИ (ГУММИРОВАНИЕ). Защитное покрытие резинами (гуммирование) осуществляется резиной и эбонитом для защиты от воздействия внешней среды различных емкостей, трубопроводов, цистерн, химических аппаратов, резервуаров для перевозки и хранения химических веществ. Защитное покрытие может быть сформировано из мягкой (при воздействии на эксплуатируемое изделие ударных, растягивающих, колебательных и других видов нагрузок) или твердой резины (которые работают при постоянной температуре, не подвергаются нагрузкам). Мягкость резины контролируется добавками серы. Мягкая содержит от 2 до 4% серы, а твердая - 30 - 50%. Для получения прочного защитного покрытия часто применяют как резину, так и эбонит. Наносят резину на предварительно очищенную и обезжиренную поверхность, сначала обрабатывая ее резиновым клеем, потом валиком выдавливая скопившийся воздух. Заключительным этапом в гуммировании является вулканизация. Резиновые защитные покрытия являются хорошими диэлектриками, обладают высокой стойкостью во многих кислотах и щелочах. Разрушающие действие на резиновые покрытия оказывают лишь сильные окислители. Резиновые покрытия, как и все полимерные материалы, обладают негативным свойством - со временем стареть. ЗАЩИТНЫЕ ПОКРЫТИЯ СИЛИКАТНЫМИ ЭМАЛЯМИ. Защитные покрытия силикатными эмалями применяют для изделий, работающих при высоких температурах, давлениях, в очень агрессивных, химически активных средах. Формирование эмалевого защитного покрытия возможно двумя способами: сухим (наносят порошок) или мокрым (пасту). Процесс нанесения эмали ведется в несколько этапов. Сначала наносят непосредственно на изделие порошкообразную грунтовую эмаль, которая улучшает адгезию, а также уменьшает термические и механические напряжения. Проводят спекание при температуре 880 - 920оС. Далее покрывают слоем покровной эмали, потом спекают при температуре 840 - 860 оС. Если требуется нанести несколько слоев силикатной эмали, вышеописанные операции проводят поочередно еще несколько раз. Обычно изделия из чугуна покрывают двумя - тремя слоями силикатной эмали, общей толщиной до 1 миллиметра. Основным недостатком эмалевого защитного покрытия можно назвать низкую прочность при воздействии ударных нагрузок, т.е. растрескивание, скалывание. ЗАЩИТНЫЕ ПОКРЫТИЯ ИЗ ПАСТ И СМАЗОК. Защитные покрытия из паст и смазок используют в основном при длительном хранении и перевозке металлоизделий. Пасты или смазки наносятся на поверхность защищаемого объекта распылением, кистью или специальным тампоном. После высыхания образуется защитная пленка. Она ограждает изделия от воздействия влаги, пыли, различных газообразных веществ. Смазки изготовляются на основе минеральных масел (вазелинового, машинного) с примесью воскообразных веществ (воска, парафина, мыла). Если изделие стальное, то в смазку дополнительно вводят немного щелочи. Очень популярна смазка, в состав которой входит 5% парафина и 95% петролатума (смесь парафинов, масел, церезинов). Из суспензий минеральных восков (церезина) или парафина и каучука, а также полиизобутилена в уайт-спирите изготавливают защитные покрытия на основе паст. Защитные покрытия из паст и смазок очень эффективны, но главным их недостатком можно считать то, что целостность образовавшейся пленки очень легко нарушить. 2. КАТОДНАЯ ЗАЩИТА ОТ КОРРОЗИИ Катодная электрохимическая защита от коррозии применяется тогда, когда защищаемый металл не склонен к пассивации. Это один из основных видов защиты металлов от коррозии. Суть катодной защиты состоит в приложении к изделию внешнего тока от отрицательного полюса, который поляризует катодные участки коррозионных элементов, приближая значение потенциала к анодным. Положительный полюс источника тока присоединяется к аноду. При этом коррозия защищаемой конструкции почти сводится к нулю. Анод же постепенно разрушается и его необходимо периодически менять. Существует несколько вариантов катодной защиты: поляризация от внешнего источника электрического тока; уменьшение скорости протекания катодного процесса (например, деаэрация электролита); контакт с металлом, у которого потенциал свободной коррозии в данной среде более электроотрицательный (так называемая, протекторная защита). Поляризация от внешнего источника электрического тока используется очень часто для защиты сооружений, находящихся в почве, воде (днища судов и т.д.). Кроме того данный вид коррозионной защиты применяется для цинка, олова, алюминия и его сплавов, титана, меди и ее сплавов, свинца, а также высокохромистых, углеродистых, легированных (как низко так и высоколегированных) сталей. Внешним источником тока служат станции катодной защиты, которые состоят из выпрямителя (преобразователь), токоподвода к защищаемому сооружению, анодных заземлителей, электрода сравнения и анодного кабеля. Катодная защита применяется как самостоятельный, так и дополнительный вид коррозионной защиты. Главным критерием, по которому можно судить о эффективности катодной защиты, является защитный потенциал. Защитным называется потенциал, при котором скорость коррозии металла в определенных условиях окружающей среды принимает самое низкое (на сколько это возможно) значение. В использовании катодной защиты есть свои недостатки. Одним из них является опасность перезащиты. Перезащита наблюдается при большом смещении потенциала защищаемого объекта в отрицательную сторону. При этом выделяется. В результате – разрушение защитных покрытий, водородное охрупчивание металла, коррозионное растрескивание.
АНОДНАЯ ЗАЩИТА ОТ КОРРОЗИИ Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах. При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии. Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла. Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией. Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду. При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле. Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону. Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта. Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области. Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина. Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы. Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально. Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием: - все сварные швы должны быть выполнены качественно; - в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние; - количество воздушных карманов и щелей должно быть минимальным; - на конструкции не должно присутствовать заклепочных соединений; - в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе. Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму. Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников. Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты. 3. ПРОТЕКТОРНАЯ ЗАЩИТА (ПРИМЕНЕНИЕ ПРОТЕКТОРА) Разновидностью катодной защиты является протекторная. При использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом. При этом идет разрушение не конструкции, а протектора. Со временем протектор корродирует и его необходимо заменять на новый. Протекторная защита эффективна в случаях, когда между протектором и окружающей средой небольшое переходное сопротивление. Каждый протектор имеет свой радиус защитного действия, который определяется максимально возможным расстоянием, на которое можно удалить протектор без потери защитного эффекта. Применяется протекторная защита чаще всего тогда, когда невозможно или трудно и дорого подвести к конструкции ток. Протекторы используются для защиты сооружений в нейтральных средах (морская или речная вода, воздух, почва и др.). Для изготовления протекторов используют такие металлы: магний, цинк, железо, алюминий. Чистые металлы не выполняют в полной мере своих защитных функций, поэтому при изготовлении протекторов их дополнительно легируют. Железные протекторы изготавливаются из углеродистых сталей либо чистого железа. ЦИНКОВЫЕ ПРОТЕКТОРЫ Цинковые протекторы содержат около 0,001 – 0,005 % свинца, меди и железа, 0,1 – 0,5 % алюминия и 0,025 – 0,15 % кадмия. Цинковые проекторы применяют для защиты изделий от морской коррозии (в соленой воде). Если цинковый протектор эксплуатировать в слабосоленой, пресной воде либо почвах – он достаточно быстро покрывается толстым слоем оксидов и гидроксидов. ПРОТЕКТОР МАГНИЕВЫЙ Сплавы для изготовления магниевых протекторов легируют 2 – 5 % цинка и 5 – 7 % алюминия. Количество в сплаве меди, свинца, железа, кремния, никеля не должно превышать десятых и сотых долей процента. Протектор магниевый используют в слабосоленых, пресных водах, почвах. Протектор применяется с средах, где цинковые и алюминиевые протекторы малоэффективны. Важным аспектом является то, что протекторы из магния должны эксплуатироваться в среде с рН 9,5 – 10,5. Это объясняется высокой скоростью растворения магния и образованием на его поверхности труднорастворимых соединений. Магниевый протектор опасен, т.к. является причиной водородного охрупчивания и коррозионного растрескивания конструкций. АЛЮМИНИЕВЫЕ ПРОТЕКТОРЫ Алюминиевые протекторы содержат добавки, которые предотвращают образование окислов алюминия. В такие протекторы вводят до 8 % цинка, до 5 % магния и десятые-сотые доли кремния, кадмия, индия, таллия. Алюминиевые протекторы эксплуатируются в прибрежном шельфе и проточной морской воде.
m(p-pa
2)=350г
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
12 |
Излучение является одной из форм энергии. Оно имеет электромагнитную природу и обладает квантово-волновыми свойствами. Квантовый характер излучения проявляется при испускании и поглощении света, а также явлении фотоэффекта, где имеют место элементарные акты взаимодействия излучения и вещества - квантов и электронов. Волновой характер излучения проявляется в явлениях дифракции, интерференции и поляризации. Когда свет падает на поверхность некоторых металлов, он выбивает электроны, вылетающие точно так же, как если бы их ударил компактный шарик. Энергия света, по всей видимости, распространяется концентрированными порциями, которые мы называем квантами. В этом п заключается квантовый характер излучения, несмотря на то, что эти порции, по-видимому, создаются волнами. Каждая порция света с одной и той же длиной волны обладает одной и той же энергией, определенным квантом энергии. Все это позволяет приписать излучению некую массу - каждой порции приписывается определенная масса.
Бо́ровская моде́ль а́тома (Моде́ль Бо́ра) — полуклассическая модель атома, предложенная Нильсом Бором в 1913 г. За основу он взял планетарную модель атома, выдвинутую Резерфордом. Однако, с точки зрения классической электродинамики, электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно и очень быстро, потеряв энергию, упасть на ядро. Чтобы преодолеть эту проблему, Бор ввел допущение, суть которого заключается в том, что электроны в атоме могут двигаться только по определенным (стационарным) орбитам, находясь на которых они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются лишь те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка
При составлении названий веществ обычно применяют русские наименования элементов, например, дикислород, дифторид ксенона, селенат калия. По традиции для некоторых элементов в производные термины вводят корни их латинских наименований Например: карбонат, манганат, оксид, сульфид, силикат. Названия простых веществ состоят из одного слова наименования химического элемента с числовой приставкойНеопределенное число указывается числовой приставкой n поли.Для некоторых простых веществ используют также специальные названия, такие, как О3 озон, Р4 белый фосфор. Все неорганические в-ва делятся на оксиды ;кислоты ; основания и соли. Оксиды- сложные неорганические в-ва, состоящие из хим элемента и оксигена( P2O5, NO2, CO3, Fe2O3). Кислоты- сложные неорганические в-ва, состоящие из анионов гидрогена и катионов кислотного остатка( HF, HCl, HI, H3PO4,HNO3, H2CO3). Основания ( водорастворимые основания наз-ся щелочи)- сложные неорганические в-ва, состоящие из катионов металла и анионов гидроксильной группыOH( NaOH, BaOH, CuOH, Fe(OH)2, MgOH2). Соли- сложные неорганические в-ва , состоящие из катионов металла и анионов кислотного остатка( BaSO4, K3PO4, Na2CO3). А соли бывают кислые , основные , двойные и комплексные.
Гальванически элемент из цинка и свинца Zn+Pb2+→Zn2++Pb Pb2++2
электрона→Pb
Zn=Zn2++2
электрона
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
13 |
В
20-х годах XX столетия было установлено,
что любая частица имеет корпускулярно-волновую
природу. Согласно теории Л.
де Бройля (1924 г.),
каждой частице с импульсом Волновые функции получаются при решении основополагающего соотношения волновой механики – уравнения Шредингера. Точное решение существует для атома водорода или водородоподобных ионов, для многоэлектронных систем используются различные приближения. Поверхность, ограничивающая 90–95 % вероятности нахождения электрона или электронной плотности, называют граничной. Атомная орбиталь и плотность электронного облака имеют одинаковую граничную поверхность (форму) и одинаковую пространственную ориентацию. Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел. Волновое уравнение Луи де Бройля - Длина волны квантовой частицы обратно пропорциональна ее импульсу- p = h/λ или λ = h/p Принцип неопределённости - Невозможно одновременно с точностью определить координаты и скорость квантовой частицы. Δx*Δv > h/m Шрёдингер применил к понятию волн вероятности классическое дифференциальное уравнение волновой функции и получил знаменитое уравнение, носящее его имя. Подобно тому как обычное уравнение волновой функции описывает распространение, например, ряби по поверхности воды, уравнение Шрёдингера описывает распространение волны вероятности нахождения частицы в заданной точке пространства. Пики этой волны (точки максимальной вероятности) показывают, в каком месте пространства скорее всего окажется частица. Хотя уравнение Шрёдингера относится к области высшей математики, оно настолько важно для понимания современной физики, что я его все-таки здесь приведу — в самой простой форме (так называемое «одномерное стационарное уравнение Шрёдингера»). Вышеупомянутая волновая функция распределения вероятности, обозначаемая греческой буквой ψ («пси»), является решением следующего дифференциального уравнения (ничего страшного, если оно вам не понятно; главное — примите на веру, что это уравнение свидетельствует о том, что вероятность ведёт себя как волна):
где x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы.
Второе начало термодинамики имеет несколько формулировок. Формулировка Клаузиуса:невозможен процесс перехода теплоты от тела с более низкой температурой к телу с более высокой. Формулировка Томсона: невозможен процесс, результатом которого было бы совершение работы за счет теплоты, взятой от одного какого-то тела. Эта формулировка накладывает ограничение на превращение внутренней энергии в механическую. Невозможно построить машину (вечный двигатель второго рода), которая совершала бы работу только за счет получения теплоты из окружающей среды. Энтропия — это показатель неупорядоченности системы. Чем выше энтропия, тем хаотичнее движение материальных частиц, составляющих систему. Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамический потенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.) Понятие энергии Гиббса широко используется в термодинамике и химии. Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшениемэнтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж) Направление химических реакций зависит от их характера. Так, условие ΔG < 0 соблюдается при любой температуре для экзотермических реакций (ΔН < 0), у которых в ходе реакции возрастает число молей газообразных веществ, и, следовательно, энтропия (ΔS > 0). У таких реакций обе движущие силы (ΔН) и (ТΔS) направлены в сторону протекания прямой реакции и ΔG < 0 при любых температурах. Такие реакции являются необратимыми. Наоборот, эндотермическая реакция (ΔН > 0), в результате которой уменьшается число молей газообразных веществ (ΔS < 0) не могут протекать самопроизвольно в прямом направлении при любой температуре, т.к. всегда ΔG > 0.
n=2моль n=1моль M=39г/моль Vm=22.4л/моль m=78г V =22,4л
n=2моль n=1моль M=23г/моль Vm=22.4л/моль m=46г V =22,4л
V(H2)=3.36л
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14 |
Ква́нтовое число́ — характеризует численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы. Некоторые квантовые числа связаны с движением в пространстве и характеризуют вид волновой функции частицы. Это квантовые числа электрона в атоме, которые определяются как число узлов радиальной волновой функции, значение орбитального углового момента, его проекция на заданную ось и спин частицы, соответственно.
Поверхностное окисление границы «металл-среда» приводит к быстрому формированию тонкой пленки окислов на этой границе. Далее такая пленка может расти (или не расти) в обоих направлениях: как вглубь металла, так и в сторону среды (в том числе меняя, или нет, свои свойства). При этом мгновенно растущие тончайшие сплошные прочные плёнки могут полностью разделить металл и среду, остановив их взаимодействие. Такие пленки обладают защитными свойствами для металла и, с точки зрения коррозии, их возникновение (и восстановление) крайне желательно. С другой стороны, всем известная «ржавчина» представляет собой не что иное, как аморфную смесь трёх основных окислов железа (Fe2O3, Fe3O4 и FeO) с многочисленными примесями. Она, конечно, тоже «оксидная пленка», но, очевидно, что её свойства резко отличаются от вышеописанной. Рост подобных плёнок, как раз и является классическим случаем коррозии железо-углеродистых сплавов.
Их принято подразделять на три группы: тонкие, средние и толстые. Тонкие оксидные пленки не различимы визуально, их толщина составляет от нескольких ангстрем до 400 ангстрем. Средние по толщине оксидные пленки (от 400 до 5000 ангстрем) как раз и дают цвета побежалости. Толстые пленки - видимы невооруженным глазом, их толщина более 5000 ангстрем (т.е. 0,5 мкм) и может достигать значительных величин, как, например, окалина на стали
Из растворенных в воде газов наиболее вредное воздействие оказывают кислород и диоксид углерода. Особенно они нежелательны для паро-силовых и гидроэлектрических установок, котлов высокого давления. Под действием кислорода в результате коррозии железо превращается сначала в Fe(OH)2, а при избытке кислорода - в труднорастворимый осадок Fe(OH)3. Растворенные в воде соли: гидрокарбонаты, сульфаты, хлориды, азотсодержащие соединения, силикаты, а также органические вещества оказывают разрушающее воздействие на металлические конструкции. Гидрокарбонаты подвергаются разложению, в результате чего образуются СО2 и осадки СаСО3, MgCO3, Mg(OH)2, FeCO3 и раствор Na2CO3. При наличии большого количества воды карбонаты магния и железа полностью гидролизуются, переходя в Mg(OH)2 и Fe(OH)2, причем последний частично окисляется в Fe(OH)3 за счет растворенного в воде кислорода.
CaO+SiO→CaSiO3+38.5кДж/моль
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15 |
Французский ученый Луи де Бройль выдвинул в 1923 г. гипотезу об универсальности корпускулярно-волнового дуализма. Он утверждал, что не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают волновыми свойствами. Согласно де Бройлю с каждым микрообъектом связываются, с одной стороны, корпускулярные характеристики энергия Е и импульс р, а с другой, – волновые характеристики – частота v и длина волны . Формулы, связывающие корпускулярные и волновые свойства частиц, такие же, как и для фотонов: Е= h; р = h/λ. Таким образом, с любой частицей, обладающей импульсом, сопоставляется волновой процесс с длиной волны, определяемой формулой де Бройля:
Принцип неопределённости Гейзенбе́рга Если
имеется несколько (много) идентичных
копий системы в данном состоянии, то
измеренные значения координаты и
импульса будут подчиняться
определённому распределению
вероятности —
это фундаментальный постулат квантовой
механики. Измеряя величину среднеквадратического
отклонения
Отметим,
что это неравенство даёт несколько
возможностей — состояние может
быть таким, что Волновое уравнение Шредингера Одним из основных уравнений квантовой механики является уравнение Шредингера, определяющее изменение состояний квантовых систем с течением времени. Оно записывается в виде
где
Н — оператор Гамильтона системы,
совпадающий с оператором энергии,
если он не зависит от времени. Вид
оператора
Волновое уравнение Шредингера. Наиболее общая форма уравнения Шрёдингера — это форма, включающая зависимость от времени :
где
Корро́зия — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Основные виды коррозии металлов: химическая и электрохимическая. Электрохимическая коррозия Разрушение металла под воздействием возникающих в коррозионной среде гальванических элементов называют электрохимической коррозией. При электрохимической коррозии (наиболее частая форма коррозии) всегда требуется наличие электролита (Конденсат, дождевая вода и т. д.), с которым соприкасаются электроды — либо различные элементы структуры материала, либо два различных соприкасающихся материала с различающимися окислительно-восстановительными потенциалами. Если в воде растворены ионы солей, кислот, или т. п., электропроводность её повышается, и скорость процесса увеличивается. Водородная и кислородная коррозия Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме: 2H3O+ + 2e− → 2H2O + H2 или 2H2O + 2e− → 2OH− + H2 Если водород не выделяется, что часто происходит в нейтральной или сильно щелочной среде, происходит восстановление кислорода и здесь говорят о кислородной коррозии или коррозии с кислородной деполяризацией: O2 + 2H2O + 4e− → 4OH− Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов. Коррозионный элемент образуется и в случае одного металла, если, например, структура поверхности неоднородна.
Медь более электроположительна по отношению к железу, т.е. в электрохимическом ряду напряжений металлов стоят правее железа. При возникновении гальванической пары сила возникающего электрическоготока тем больше, чем дальше стоят металлы друг от друга в ряду напряжений. При этом поток электронов от более активного металла идет к менее активному металлу. Т.е металл корродирует быстрее, если находится в контакте с менее активным металлом, значит пластина из железа, склепанного медью разрушится быстрее, т.к. более активный металл (железо), расположенный в ряду напряжений левее, будет разрушаться (т.к. является анодом), предохраняя тем самым менее активный металл от коррозии (медь).
1) SnCI2+Fe=FeCI2+Sn 2) SnCI2+Fe+Cu=Sn +FeCI2+Cu быстро разрушается Обратная реакция Fe(восстан-ль)+Сu2+(окисл-ль)=Сu+Fe2+(гальванический элемент) переход электронов
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
16 |
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто. Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни). Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей. Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули): В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином). Используя понятия квантовые числа можно сказать, что: Каждый электрон в атоме однозначно характеризуется своим набором четырех квантовых чисел - главного n, орбитальногоl, магнитного ml, и спинового ms. Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу: В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии). Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -…. Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе. Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда): При данном значении квантового числа l (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов. Порядок возрастания энергии атомной орбитали в сложных атомах описывается правилом Клечковского: энергия атомной орбитали возрастает в соответствии с увеличением n +l главного и орбитального квантовых чисел. При одинаковом значении суммы энергия меньше у атомной орбитали с меньшим значением главного квантового числа. Распределение электронов по различным атомным орбиталям называют электронной конфигурацией атома. Электронная конфигурация с наименьшей энергией соответствует основному состоянию атома, остальные конфигурации относятся к возбужденным состояниям. Электронную конфигурацию атома изображают двумя способами – в виде электронных формул и электронно-графических диаграмм. При написании электронных формул используют главное и орбитальное квантовые числа. Подуровень обозначают с помощью главного квантового числа (цифрой) и орбитального квантового числа (соответствующей буквой). Число электронов на подуровне характеризует верхний индекс. Например. Для основного состоянии атома водорода электронная формула: 1s1. Более полно строение электронных подуровней можно описать с помощью электронографических диаграмм, где распределение электронов по подуровням представляют в виде квантовых ячеек. Орбиталь в этом случае принято условно изображать квадратом, около которого проставлено обозначение подуровня. Подуровни на каждом уровне должны быть немного смещены по высоте, так как их энергия несколько различается. Электроны обозначают стрелками или ¯ в зависимости от знака спинового квантового числа. С учетом структуры электронных конфигураций атомов все известные элементы в соответствии со значением орбитального квантового числа последнего заполняемого подуровня можно разбить на четыре группы: s –элементы, р-элементы, d-элементы, f-элементы.
Электролиз — физико-химический процесс, состоящий в выделении на электродах составных частей растворённых веществ или других веществ, являющихся результатом вторичных реакций на электродах, который возникает при прохождении электрического тока через раствор, либо расплав электролита. (Если в раствор (расплав) электролита опустить инертные электроды и пропускать постоянный электрический ток, то ионы будут двигаться к электродам, при этом на катоде происходит разряд положительно заряженных ионов – катионов (восстановление), а на аноде разряд отрицательных ионов –анионов, или растворение анода (окисление). Этот процесс называется электролизом.)
Катионы можно расположить в ряд по относительной способности к разряду на катоде. Анионы также можно расположить в ряд по относительной способности к разряду на аноде. Эти последовательности называют рядами активности (электрохимическими рядами напряжений) металлов и неметаллов.
Первый закон Фараде В 1832 году Фарадей установил,
что масса m вещества, выделившегося
на электроде, прямо пропорциональна
электрическому заряду q, прошедшему
через электролит:
Второй закон Фарадея Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты. Химическим эквивалентом иона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
где Второй закон Фарадея записывается в следующем виде:
где
m(H2O)=200г=g1 KH2O=1.86
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
17 |
Протонно-нейтронная теория строения ядра (Иваненко и Гапон, 1932): В ядре открыто множество элементарных частиц, важнейшие из которых – протоны и нейтроны. Протон (p) – имеет заряд +1, масса его равна 1 а.е.м. (атомная единица массы = 1/12 массы атома углерода 12С; старое название – у.е. – углеродная единица). Величина заряда ядра атома равна числу протонов и положительна. Число электронов равно числу протонов, поэтому заряд атома равен 0. Число протонов, заряд ядра и число электронов численно равны порядковому номеру химического элемента. Нейтрон (n) – незаряженная частица, масса равна 1 а.е.м. Относительная атомная масса равна числу протонов и нейтронов в ядре: A = Z + N A – относительная атомная масса Z – число протонов N – число нейтронов Протоны и нейтроны удерживаются в ядре ядерными силами, которые действуют на расстоянии 10-15см и превышают силы отталкивания.
Изотопы – это разновидности атомов одного элемента, обладающие одинаковым зарядом ядра, но имеющие разную атомную массу. Изотопы имеют одинаковое число протонов и отличаются количеством нейтронов в ядре. Известны для всех элементов. Например, у водорода 3 изотопа: протий 1Н, дейтерий 2Н и тритий 3Н; изотопы кислорода – 15О, 16О, 17О, 18О (цифры - массовые числа изотопов - записываются слева вверху от знака химического элемента). Изотопы: Стабильные – устойчивые – их известно около 300. Радиоактивные – неустойчивые (известно более 1500, получены для всех элементов). В результате радиоактивного распада превращаются в изотопы других элементов. Их получают с помощью ядерных реакций. По химическим свойствам почти не отличаются от стабильных. Используются в качестве «меченых атомов». По измерению их радиоактивности можно следить за поведением и передвижением всех атомов этого элемента. Например, радиоактивный фосфор используется в медицинских исследованиях. Радиоактивные элементы состоят только из радиоактивных изотопов: технеций Тс (№ 43), прометий Pm (№ 61) и все элементы начиная с полония Ро (№ 84), например, уран U, плутоний Pu, радий Ra.
Относительная атомная масса элемента равна среднему значению масс всех его природных изотопов с учётом их распространённости. Закон сохранения электрического заряда гласит, что алгебраическая сумма зарядов электрически замкнутой системы сохраняется. Закон сохранения массы веществ. Масса веществ, вступивших в химическую реакцию, равна массе веществ, образовавшихся в результате реакции. Ядерные реакции классифицируются по следующим признакам: 1) по роду участвующих в них частиц — реакции под действием нейтронов; реакции под действием заряженных частиц (например, протонов, дейтронов, -частиц); реакции под действием -квантов; 2) по энергии вызывающих их частиц — реакции при малых энергиях (порядка электрон-вольт), происходящие в основном с участием нейтронов; реакции при средних энергиях (до нескольких мегаэлектрон-вольт), происходящие с участием -квантов и заряженных частиц (протоны, -частицы); реакции при высоких энергиях (сотни и тысячи мегаэлектрон-вольт), приводящие к рождению отсутствующих в свободном состоянии элементарных частиц и имеющие большое значение для их изучения; 3) по роду участвующих в них ядер — реакции на легких ядрах (А< 50); реакции на средних ядрах (50<А< 100); реакции на тяжелых ядрах (А> 100); 4) по характеру происходящих ядерных превращений — реакции с испусканием нейтронов; реакции с испусканием заряженных частиц; реакции захвата (в этих реакциях составное ядро не испускает никаких частиц, а переходит в основное состояние, излучая один или несколько -квантов). Первая в истории ядерная реакция осуществлена Э. Резерфордом (1919) при бомбардировке ядра азота -частицами, испускаемыми радиоактивным источником:
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии. Электролиз расплавов электролитов - важный способ производства многих металлов. Электрический ток, проходя через растворы, вызывает в них, так же как и в расплавах, химические изменения, выражающиеся в том, что из растворов выделяются продукты разложения растворенного вещества или растворителя. Вещества, растворы которые проводят электрический ток, получили названия электролитов. Электролитами являются кислоты, основания и соли. Химический процесс, происходящий при пропускании тока через раствор электролита, называется электролизом. Исследуя продукта, выделяющиеся у электрода, при электролизе кислот, оснований и солей, установили, что у катодов всегда выделяются металлы и водород, а у анода кислотные остатки или гидроксильные группы, которые затем подвергаются дальнейшим изменениям. Таким образом, первичными продуктами электролиза оказываются те же части кислот, оснований и солей, которые при реакциях обмена, не изменяются, переходят из одного вещества в другое. Электролиз находит широкое применение в технике. Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой "потенциалом разложения". При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор. Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900 °С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки. Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины. Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише. Электролитическим путем получают тяжелую воду (D2O), в которой атомы водорода заменены атомами его изотопа — дейтерия (D) с атомной массой 2.
n=2моль n=2моль M=18г/моль Vm=22.4л/моль m=36г V=44,8л
Х=4,5 г 4,5 г=4,5л
n=1моль n=1моль M=79,5г/моль Vm=22.4л/моль m=79,5г V=22,4л 0,02кг=20 г
Х=5,6л
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
18 |
Естественная радиоактивность — самопроизвольный распад атомных ядер, встречающихся в природе. Альфа - распад Альфа-частицы испускаются только тяжелыми ядрами, т.е. содержащими большое число протонов и нейтронов. Прочность тяжелых ядер мала. Для того, чтобы покинуть ядро, нуклон должен преодолеть ядерные силы, а для этого он должен обладать достаточной энергией. При объединении двух протонов и двух нейтронов в альфа-частицу ядерные силы в подобном сочетании (между нуклонами частицы) являются наиболее крепкими, а связи с другими нуклонами слабее, поэтому альфа-частица способна "выйти" из ядра. Вылетевшая альфа-частица уносит положительный заряд в 2 единицы и массу в 4 единицы. В результате альфа-распада радиоактивный элемент превращается в другой элемент, порядковый номер которого на 2 единицы, а массовое число на 4 единицы, меньше. Бета-распад Явление бета-распада состоит в том, что ядра некоторых элементов самопроизвольно испускают электроны и элементарную частицу очень малой массы - антинейтрино. Так как электронов в ядрах нет, то появление бета-лучей из ядра атома можно объяснить способностью нейтронов ядра распадаться на протон, электрон и антинейтрино. Появившийся протон переходит во вновь образующееся ядро. Электрон, вылетающий из ядра, и является частицей бета-излучения. Такой процесс распада нейтронов характерен для ядер с большим количеством нейтронов. Гамма - распад - не существует В процессе радиоактивного излучения ядра атомов могут испускать гамма-кванты. Испускание гамма-квантов не сопровождается распадом ядра атома.Гамма излучение зачастую сопровождает явления альфа- или бета-распада.При альфа- и бета-распаде новое возникшее ядро первоначально находится в возбужденном состоянии и , когда оно переходит в нормальное состояние, то испускает гамма-кванты (в оптическом или рентгеновском диапазоне волн). Период полураспада квантовомеханической системы (частицы, ядра, атома, энергетического уровня и т.д.) — время T½, в течение которого система распадается с вероятностью 1/2. Если рассматривается ансамбль независимых частиц, то в течение одного периода полураспада количество выживших частиц уменьшится в среднем в 2 раза. Термин применим только к экспоненциально распадающимся системам. N=N02-t/T1/2 В химии радиоактивных элементов и ядерной физике закон радиоактивных смещений, также известный как правило радиоактивных смещений Содди и Фаянса, — основное правило, описывающее превращения элементов в процессе радиоактивного распада. Закон был открыт в 1913 году независимо Фредериком Содди и Казимиром Фаянсом. Закон описывает, какой элемент и какой изотоп этого элемента получается при том или ином типе радиоактивного распада: при
альфа-распаде создаётся элемент с
зарядом ядра, уменьшенным на два, и с
атомной массой, уменьшенной на четыре
по отношению к родительскому
радиоизотопу, например:
при
бета-распаде заряд ядра атома созданного
элемента возрастает на единицу при
неизменной атомной массе, например:
Желе́зо-ни́келевый аккумуля́тор — это вторичный химический источник тока, в котором железо — анод, электролитом является водныйраствор гидроксида натрия или калия (с добавками гидроксида лития), катод — гидрат окиси никеля(III). Используются в основном как тяговые источники тока в шахтных электровозах, электрокарах и промышленных подъемниках. Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день типаккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: аккумуляторные батареи в автомобильном транспорте, аварийные источники электроэнергии. Применяются там, где требуется большая мощность, а вес не имеет значения. Наиболее распространенный тип аккумулятора в мире (из расчета ампер-часов). Основная область применения — стартерные батареи. Герметичные свинцово-кислотные (SLA) — один из видов свинцово-кислотных аккумуляторов. Применяются там, где требуется большая мощность, а вес не имеет значения. Типовые области применения — стационарное медицинское оборудование, электромобили, системы аварийного энергоснабжения, UPS (источники бесперебойного питания).
n=1моль n=2моль M=42 г/моль Vm=22.4л/моль m=42г V=44,8л 1) m(CaH2)-? чистого 100-12=88%
2)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
19 |
Искусственная радиоактивность - радиоактивность, искусственно создаваемая в устойчивых химических элементах путем их облучения потоками нейтронов в ядерных реакторах или бомбардировки этих элементов тяжелыми частицами — протонами, альфа-частицами и др. Вследствие огромного разнообразия свойств (вид излучения, энергия-, время жизни, масса испускаемых частиц и др.) радиоактивные вещества, получаемые искусственным путем, применяют значительно шире, чем естественные (см. Изотопы). В связи с открытием искусственной радиоактивности оказалось возможным осуществить мечту средневековых алхимиков — превращать атомы одних химических элементов в атомы других элементов (см. Радиоактивность). Вслед за этим открытием ученые в различных странах стали подвергать бомбардировке ядерными частицами буквально все химические элементы таблицы Менделеева. При этом выяснилось, что почти все они могут образовывать новые искусственные радиоактивные изотопы. В сравнительно короткий срок число таких искусственных излучателей дошло до тысячи и с каждым годом открываются все новые и новые. Сейчас искусственные радиоактивные изотопы занимают исключительно важное место в науке и технике. Одно из важнейших отраслей применения искусственной радиации являются создание ядерных реакторов. Термоядерные реакции- Реакция слияния легких ядер при очень высокой температуре, сопровождающаяся выделением энергии. Для слияния необходимо, чтобы расстояние между ядрами приблизительно было равно 0,000 000 000 001 см. Однако этому препятствуют кулоновские силы. Они могут быть преодолены при наличии у ядер большой кинетической энергии. Особенно большое практическое значение имеет то, что при термоядерной реакции на каждый нуклон выделяется намного больше энергии, чем при ядерной реакции, например, при синтезе ядра гелия из ядер водорода выделяется энергия, равная 6 МэВ, а при делении ядра урана на один нуклон приходится »0,9 МэВ. Управляемая термоядерная реакция - энергетически выгодная реакция. Однако она может идти лишь при очень высоких температурах (порядка несколько сотен млн. градусов). При большой плотности вещества такая температура может быть достигнута путем создания в плазме мощных электронных разрядов. При этом возникает проблема - трудно удержать плазму. Самоподдерживающиеся термоядерные реакции происходят в звездах.
Гальвонические элементы - устройства (основанный на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока) для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Определение ЭДС гальв. Элемента. - ЭДС гальванического элемента определяется как разность электродных потенциалов. По уравнению НЕРНСТА
Явления поляризации и деполяризации в гальваническом элементе. - Рассмотренный простейший мокрый элемент практически непригоден, так как вследствие несовершенства своей конструкции он не может давать сколько-нибудь продолжительное время ток определенной силы. Причиной этому служит быстрое наступление так называемой поляризации элемента, сильно повышающей внутреннее его сопротивление, вызывающее в свою очередь большое падение напряжения внутри элемента, а следовательно, уменьшение рабочего напряжения и силы тока, даваемого элементом. Поляризация элемента состоит в скоплении на поверхности положительного электрода элемента большою количества пузырьков водорода, который образуется в результате беспрерывного разложения воды электролита проходящим через элемент (во время его разряда) электрическим током. Эти скопляющиеся пузырьки водорода и служат причиной быстрого возрастания внутреннего сопротивления элемента, так как водород препятствует движению электрических зарядов от электролита к углю. По этой причине даваемое элементом при данной нагрузке напряжение начинает быстро падать. В разных типах элементов поляризацию устраняют различными способами. В элементах типа Лекланше это достигается тем, что вокруг угольного электрода располагают слой спресованной, жадно поглощающей водород так называемой деполяризующей массы, состоящей из порошка графита и соединения богатого кислородом марганца. Во время работы такого элемента выделяющийся водород поглощается деполяризующей (массой и в ней соединяется с кислородом марганца, в результате чего происходит образование воды, и поэтому элемент не будет поляризоваться. В элементах с марганцево-воздушной деполяризацией устранение образующегося водорода (превращение его в воду) происходит как при помощи кислорода марганца, так и кислорода наружного воздуха, поступающего внутрь элемента через имеющиеся у него специальные отверстия, называемые «дыхательными» отверстиями. Благодаря такой двойной деполяризации элементы МВД могут давать в несколько раз больший разрядный ток, чем таких же размеров обычные сухие элементы типа Лекланше. Если поляризация устранена, то всякий гальванический элемент способен давать длительное время строго постоянный ток.
3Fe+2CO=Fe3C+CO2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
20 |
Изото́пы— разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный(порядковый) номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. Химические свойства атома зависят от строения электронной оболочки, которая, в свою очередь, определяется в основном зарядом ядра Z (то есть количеством протонов в нём), и почти не зависят от его массового числа A (то есть суммарного числа протонов Z и нейтронов N). Все изотопы одного элемента имеют одинаковый заряд ядра, отличаясь лишь числом нейтронов. Обычно изотоп обозначается символом химического элемента, к которому он относится, с добавлением верхнего левого индекса, означающего массовое число (например, 12C, 222Rn). Можно также написать название элемента с добавлением через дефис массового числа (например, углерод-12, радон-222). Некоторые изотопы имеют традиционные собственные названия (например, дейтерий, актинон). В мире стабильных изотопов еще немало проблем. Так, неясно, почему их количество у разных элементов столь сильно различается. Около 25% стабильных элементов (Be, F, Na, Al, Р, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pt, Tb, Ho, Tu, Та, Au) представлены в природе лишь одним видом атомов. Это так называемые элементы-одиночки. Интересно, что все они (кроме Be) имеют нечетные значения Z. И вообще для нечетных элементов число стабильных изотопов не превышает двух. Напротив, некоторые элементы с четными Z состоят из большого числа изотопов (например, Хе имеет 9, Sn — 10 стабильных изотопов). Совокупность стабильных изотопов у данного элемента называют плеядой. Содержание их в плеяде нередко сильно колеблется. Интересно отметить, что больше всего содержание изотопов с величинами массовых чисел, кратными четырем (12С, 1бО, 20Са и т. д.), хотя есть и исключения из этого правила. Укрытие стабильных изотопов позволило разгадать многолетнюю загадку атомных масс — их отклонение от целых чисел, объясняющееся различным процентным содержанием стабильных изотопов элементов в плеяде.
Все изотопы подразделяются на устойчивые и неустойчивые. Устойчивые изотопы не подвергаются радиоактивному распаду. Поэтому они сохраняются в природных условиях. Примерами устойчивых изотопов являются кислород-16 и утлерод-12. На Земле существует около 280 естественных устойчивых изотопов. Большинство естественно существующих элементов состоит из одного устойчивого изотопа в смеси с небольшим количеством других устойчивых и неустойчивых изотопов. Неустойчивые изотопы радиоактивны. Их принято называть радиоактивными изотопами, радиоизотопами или радионуклидами. Радиоизотопы подразделяются на естественные и искусственные (см. ниже). И те и другие распадаются, испуская при этом а- или р-частицы. Распад продолжается до образования устойчивого изотопа. Применение радиоактивных изотопов в промышленности Одним из примеров может служить следующий способ контроля износа поршневых колец в двигателях внутреннего сгорания. Облучая поршневое кольцо нейтронами, вызывают в нем ядерные реакции и делают его радиоактивным. При работе двигателя частички материала кольца попадают в смазочное масло. Исследуя уровень радиоактивности масла после определенного времени работы двигателя, определяют износ кольца. Радиоактивные изотопы позволяют судить о диффузии металлов, процессах в доменных печах и т. д. Мощное гамма-излучение радиоактивных препаратов используют для исследования внутренней структуры металлических отливок с целью обнаружения в них дефектов.Изотопы также используются в ядерно-физической аппаратуре для изготовления счетчиков нейтронов, что позволяет увеличить эффективность счета более чем в 5 раз, в ядерной энергетике как замедлители и поглотители нейтронов. Использование изотопов в науке Использование изотопов в биологии привело к пересмотру прежних представлений о природе фотосинтеза, а также о механизмах, обеспечивающих усвоение растениями неорганических веществ карбонатов, нитратов, фосфатов и др. С помощью изотопов изучено перемещение популяций в биосфере и отдельных особей внутри данной популяции, миграции микробов, а также отдельных соединений внутри организма. Вводя в организмы с пищей или путём инъекций метку, удалось изучить скорость и пути миграции многих насекомых (москитов, мух, саранчи), птиц, грызунов и др. мелких животных и получить данные о численности их популяций. В области физиологии и биохимии растений с помощью изотопов решен ряд теоретических и прикладных проблем: выяснены пути поступления минеральных веществ, жидкостей и газов в растения, а также роль различных химических элементов, в том числе микроэлементов, в жизни растений. Показано, в частности, что углерод поступает в растения не только через листья, но и через корневую систему, установлены пути и скорости передвижения ряда веществ из корневой системы в стебель и листья и из этих органов к корням.В области физиологии и биохимии животных и человека изучены скорости поступления различных веществ в их ткани (в том числе скорость включения железа в гемоглобин, фосфора в нервную и мышечные ткани, кальция в кости). Использование "меченой" пищи привело к новому представлению о скоростях всасывания и распространения пищевых веществ, об их "судьбе" в организме и помогло проследить за влиянием внутренних и внешних факторов (голодание, асфиксия, переутомление и т. д.) на обмен веществ.
Электронно-ионный метод составления уравнений окислительно-восстановительных реакций (метод полуреакций). Электронно-ионный метод расстановки коэффициентов в окислительно-восстановительных реакциях применяется на ряду с методом электронного баланса для реакций, протекающих в растворах. Степень окисления при этом определять не нужно, т.к. рассматривается участие в реакции не отдельных атомов, а целого реального иона. Электронно-ионный метод правильнее отражает реальные процессы, протекающие при окислено-восстановительных реакциях в растворах. при составлении уравнений окислительно-восстановительных реакций методом полуреакций надо помнить следующее: 1) В ионной форме записываются только формулы веществ, распадающихся в растворах на ионы. 2) Во всех случаях сначала уравнивается число кислородных атомов. 3) В кислой среде кислород отдает молекулы воды, а связывается он ионами водорода. при составлении уравнений в щелочной среде правила те же, но кислород представляют ионы OH- , а связываются он молекулами воды.в нейтральной среде добавление и связывание атомов кислорода осуществляется только молекулами воды.
3Fe+2CO=Fe3C+CO2
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
21 |
Теория строения атома объясняет ᴨȇриодическое изменение свойств элементов. Возрастание положительного заряда атомных ядер от 1-до 110 приводит к ᴨериодическому повторению у атомов элементов строения внешнего энергетического уровня. А поскольку от числа электронов на внешнем уровне в основном зависят свойства элементов; то и они ᴨȇриодически повторяются. В этом физический смысл ᴨȇриодического закона. В качестве примера рассмотрим изменение свойств у ᴨȇрвых и последних элементов ᴨȇриодов. Каждый ᴨȇриод в ᴨȇриодической системе начинается элементами атомы, котоҏыҳ на внешнем уровне имеют один s-электрон (незавершенные внешние уровни) и потому проявляют сходные свойства -- легко отдают валентные электроны, что обуславливает их металлический характер. Это щелочные металлы -- Li, Na, К, Rb, Cs. Заканчивается ᴨȇриод элементами, атомы котоҏыҳ на внешнем уровне содержат 2 (s2) электрона (в ᴨȇрвом ᴨȇриоде) или 8 (s1p6) электронов (во всех последующих), то есть имеют завершенный внешний уровень. Это благородные газы Не, Ne, Ar, Kr, Xe, имеющие инертные свойства. Именно вследствие сходства строения внешнего энергетического уровня похожи их физические и химические свойства. В каждом ᴨȇриоде с возрастанием порядкового номера элементов металлические свойства постеᴨȇнно ослабева-ют и возрастают неметаллические, заканчивается ᴨȇриод инертным газом. В каждом ᴨȇриоде с возрастанием порядкового номера элементов металлические свойства постеᴨȇнно ослабева-ют и возрастают неметаллические, заканчивается ᴨȇриод инертным газом. В свете учения о строении атома становится понятным разделение всех элементов на семь ᴨȇриодов, сделанное Д. И. Менделеевым. Номер ᴨȇриода соответствует числу энергетических уровней атома, то есть положение элементов в ᴨȇриодической системе обусловлено строением их атомов. В зависимости от того, какой подуровень заполняется электронами, все элементы делят на четыре типа. 1. s-элементы. Заполняется s-подуровень внешнего уровня (s1 -- s2). Сюда относятся ᴨȇрвые два элемента каждого ᴨȇриода. 2. р-элементы. Заполняется р-подуровень внешнего уровня (р1 -- p6)- Сюда относятся последние шесть элементов каждого ᴨȇриода, начиная со второго. 3. d-элементы. Заполняется d-подуровень последнего уровня (d1 -- d10), а на последнем (внешнем) уровне остается 1 или 2 электрона. К ним относятся элементы вставных декад (10) больших ᴨȇриодов, начиная с 4-го, расположенные между s- и p-элементами (их также называют ᴨȇреходными элементами). 4. f-элементы. Заполняется f-подуровень глубинного (треть его снаружи) уровня (f1 --f14), а строение внешнего электронного уровня остается неизменным. Это лантаноиды и актиноиды, находящиеся в шестом и седьмом ᴨȇриодах. Итак, число элементов в ᴨȇриодах (2-8-18-32) соответствует максимально возможному числу электронов на соответствующих энергетических уровнях: на ᴨȇрвом -- два, на втором -- восемь, на третьем -- восемнадцать, а на четвертом -- тридцать два электрона. Деление групп на подгруппы (главную и побочную) основано на различии в заполнении электронами энергетических уровней. Главную подгруппу составляют s- и p-элементы, а побочную подгруппу -- d-элементы. В каждой групᴨȇ объединены элементы, атомы котоҏыҳ имеют сходное строение внешнего энергетического уровня. При этом атомы элементов главных подгрупп содержат на внешних (последних) уровнях число электронов, равное номеру группы. Это так называемые - валентные электроны. У элементов побочных подгрупп валентными являются электроны не только внешних, но и предпоследних (вто-рых снаружи) уровней, в чем и состоит основное различие в свойствах элементов главных и побочных подгрупп. Отсюда следует, что номер группы, как правило, указывает число электронов, которые могут участвовать в образовании химических связей. В этом заключается физический смысл номера группы. С позиций теории строения атома легко объясняется возрастание металлических свойств элементов в каждой групᴨȇ с ростом заряда ядра атома. Сравнивая, например, распределение электронов по уровням в атомах 9F (1s2 2s2 2р5) и 53J (1s2 2s2 2р6 3s2 Зр6 3d10 4s2 4р6 4d10 5s2 5p5) можно отметить, что у них по 7 электронов на внешнем уровне, что указывает на сходство свойств. Однако внешние электроны в атоме йода находятся дальше от ядра и в связи с этим слабее удерживаются. По этой причине атомы йода могут отдавать электроны или, иными словами, проявлять металлические свойства, что нехарактерно для фтора. Итак, строение атомов обуславливает две закономерности: а) изменение свойств элементов по горизонтали -- в ᴨȇриоде слева направо ослабляются металлические и усиливаются неметаллические свойства; б) изменение свойств элементов по вертикали -- в групᴨȇ с ростом порядкового номера усиливаются металлические свойства и ослабевают неметаллические. Таким образом: по мере возрастания заряда ядра атомов химических элементов ᴨȇриодически изменяется строение их электронных оболочек, что является причиной ᴨȇриодического изменения их свойств.
Степень окисления— вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов. Реакции, в результате которых изменяются степени окисления атомов, входящих в состав реагирующих веществ вследствие переноса электрона между ними, называются окислительно-восстановительными реакциями Окислительно- восстановительные реакции, также— это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого. Виды окислительно-восстановительных реакций Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ. Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества. Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель. Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления. Окислительно-восстановительные свойства веществ связаны с положением элементов в Периодической системе Д.И. Менделеева. Простые вещества - неметаллы обладают большими окислительными свойствами, а металлы - большими восстановительными свойствами. В каждой группе Периодической системы элемент с более высоким порядковым номером обладает более ярко выраженными восстановительными свойствами в своей группе, а элемент с меньшим порядковым номером - более сильными окислительными свойствами. Соединения, содержащие атомы элементов в низшей степени окисления, будут восстановителями за счет этих атомов. Соединения, включающие атомы элементов в высшей степени окисления, будут окислителями Химические свойства веществ, в отличие от физических, не зависят от агрегатного состояния. Так, сера в любом агрегатном состоянии при сгорании образует сернистый газ (т.е. проявляет одно и то же химическое свойство), но физические свойства серы в разных агрегатных состояниях весьма различны Все вещества состоят из частиц и характеризуются определённым набором химических свойств - способностью веществ участвовать в химических реакциях.
CaCO3 M=100г/мольM=56г/моль
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
22 |
Природа каждого химического элемента, то есть определенные, присущие только ему свойства атомов, простых веществ, соединений зависит прежде всего от заряда ядра его атомов. Заряд обусловливает и строение электронной оболочки атома. Но величины зарядов ядер атомов химических элементов в Периодической системе Д. И. Менделеева изменяются монотонно — увеличиваются от +1 у водорода до +110 у элемента № 110, поэтому прямой причиной периодического изменения свойств элементов это явление быть не может. Причина периодичности — изменение строения внешних электронных слоев атомов. Так, у всех щелочных металлов внешний энергетический уровень занят одним в-электро-ном, поэтому их свойства так похожи. Но они не одинаковы, степень их проявления разная, потому что этот единственный внешний электрон находится на разном удалении от ядра у атомов каждого из щелочных металлов:
Вывод: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от строения внешних электронных слоев атомов. Каждый электрон в атоме, в соответствии с квантовой механикой, характеризуется четырьмя квантовыми числами: главным квантовым числом n, принимающим значения n=1,2,3,4 …, азимутальным l, принимающим значения l=0,1,2 …,n-1, магнитным m, имеющим (2l+1) значений, и спиновым ms, принимающим значения +1/2 и -1/2. Состояние с l=0,1,2,3,4… принято обозначать буквами s, p, d, j, g – и соответственно называть s-, p-, d-, j-, g-… состояниями. Электроны с данным n образуют электронный слой, который состоит из n оболочек с l=0,1,2 … n-1 и содержит 2n в квадрате электронов. Отсюда получаем следующее распределение электронов по слоям и оболочкам.
Таблица 1. Распределение электронов по слоям и оболочкам.
Учитывая специфику изменения свойств элементов в П. с. и сведения об их атомных спектрах, Бор разработал схему построения электронных конфигураций атомов по мере возрастания Z, положив ее в основу объяснения явления периодичности и структуры П. с. Эта схема опирается на определенную последовательность заполнения электронами оболочек (наз. также слоями, уровнями) и подоболочек (оболочек, подуровней) в атомах в соответствии с увеличением Z. Сходные электронные конфигурации внеш. электронных оболочек в атомах периодически повторяются, что и обусловливает периодич. изменение хим. свойств элементов. В этом состоит гл. причина физ. природы феномена периодичности. Электронные оболочки, за исключением тех, которые отвечают значениям 1 и 2 главного квантового чиела л, не заполняются последовательно и монотонно до своего полного завершения (числа электронов в последоват. оболочках составляют: 2, 8, 18, 32, 50,...); построение их периодически прерывается появлением совокупностей электронов (составляющих определенные подоболочки), которые отвечают большим значениям п.В этом заключается существ. особенность "электронного" истолкования структуры П. с.
Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Гидролиз, дословно, - это разложение водой.
При наличии в растворе многозарядных ионов (2+, 3+, 2-, 3-) гидролиз идет ступенчато. При этом надо учитывать, что гидролиз при обычных условиях идет в достаточной мере только по первой ступени, а по второй, третей ступени – в очень незначительной мере. Рассмотрим гидролиз солей разных типов. Соли сильного основания и сильной кислоты гидролизу не подвергаются, так как нет связывания ионов, не происходит образования слабых электролитов. В этом случае реакция среды в растворе – нейтральная. KCl +H2O = KOH + HCl, K+ + Cl- + H2O =K+ + OH- + H+ + Cl-, H2O=H+ + OH-. 2. Соли слабого основания и сильной кислоты подвергаются гидролизу по катиону, реакция среды в растворе, в таком случае, кислая: I ступень (преимущественный процесс): Al3+ AlOH+ HOH 2+ + 3Cl– + H+, Al3+ + 3Cl–AlOH + HOH2+ + 3Cl– + H+, AlCl3 + H2AlOHClO2 + HCl. 3. Гидролиз соли сильного основания и слабой кислоты происходит по аниону, реакция среды в растворе – щелочная: I ступень (преимущественный процесс): CO32– HCO+ HOH3– + OH–, 2K+ + CO32– 2K+ HOH+ + HCO3– + OH–, K2CO3 + H2KOH + KHCOO3. II ступень (происходит в незначительной мере): HCO3–H + HOH2CO3 + OH–, K+ + HCO3–K + HOH+ + H2CO3 + OH–, KHCO3 + H2KOH + HO2CO3. 4.Гидролиз соли слабого основания и слабой кислоты происходит как по аниону, так и по катиону. Реакция среды в этом случае зависит от соотношения констант диссоциации соответствующих основания и кислоты. NH4CN – соль слабого основания NH3 ∙ H2О и слабой кислоты HCN. NH4CN + H2NHO3 ∙ H2О + HCN, NH4+ + CN– NH + HOH3 ∙ H2О + HCN.
n=1моль n=1моль M=100 кг/моль M=56 кг/моль m=100 кг m=56 кг 1)m(CaCO3)-?
m= 2) n=
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
23 |
Для отрыва электрона от атома необходимо затратить некоторую энергию, называемую энергией ионизации. То наименьшее значение напряжения поля, при котором скорость электронов становится достаточной для ионизации атомов, называют потенциалом ионизации атомов данного элемента. 1 эВ=16*10-19 Дж. Для отрыва каждого последующего электрона требуется большая затрата энергии. Чем меньше потенциал ионизации, тем сильнее должны быть выражены металлические свойства элемента. В одной и той же подгруппе периодической системы с увеличением порядкового номера элемента потенциал ионизации уменьшается. У элементов одного периода потенциал ионизации возрастает с увеличением порядкового номера элемента. Энергия сродства к электрону – энергетический эффект присоединения электрона к атому (атом превращается в – ион). Энергия сродства к электрону (СЭ) характеризует количество энергии, которая выделяется (или поглощается) в результате присоединения электрона к нейтральному атому с превращением его в отрицательный ион. Величины энергии сродства к электрону в периодах возрастают слева направо, в подгруппах, как правило, уменьшаются сверху вниз. Электроотрицательность – количественная характеристика способности атома в молекуле притягивать к себе электроны. Энергия сродства + энергия ионизации = электроотрицательность. Чем больше электроотрицательность, тем легче его атомы превращаются в – ион.
ИОННО-МОЛЕКУЛЯРНЫЕ РЕАКЦИИ, происходят при столкновениях ионов с молекулами или атомами в газовой фазе. Различают три группы ионно-молекулярных реакций: бимолекулярные с переходом электрона; бимолекулярные с переходом тяжелой частицы (Н, Н + , Н или мол. фрагмента, состоящего из неск. атомов); тримолекулярные. Первая группа включает р-ции перезарядки и отрыва электрона от отрицат. ионов. При перезарядке ион и нейтральная частица обмениваются электроном, к-рый переходит к частице, обладающей либо большим потенциалом ионизации (перезарядка с участием положит. иона, напр. О+ + Н2О : Н2О+ + О), либо большим сродством к электрону (перезарядка с участием отрицат. иона, напр. О + О2 : О2 + О). Перезарядка может сопровождаться диссоциацией нейтральной частицы: Аr+ +CH4 :CH3+ + Аr + H Отрыв электрона от отрицат. иона может привести к образованию новой частицы, напр.: О2 + О : О3 + е; в ходе этой р-ции выделяется тепло, к-рое и расходуется на отрыв электрона. Примеры ионно-молекулярных реакций с переходом тяжелой частицы: СН4+ + СН4 : СН5+ + СН3; Не+ + Н2 : НеН+ + Н; SO2+ + SO2 : S2O3+ + О; NH4.H2O + NH3 : H+(NH3)2 + + H2O.Тримолекулярные ионно-молекулярные реакции - это, как правило, р-ции прилипания нейтральной частицы к иону, в результате чего образуются т. наз. ионные кластеры: O2+ + O2 + M :O2+ .O2 + M; О2 + О2 + М : О2.О2 + М (М - третья частица) Произведение растворимости (ПР, Ksp) — произведение концентраций ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная. Она количественно характеризует способность данного электролита растворяться. Пример CaSO4=Ca+2+SO4-2 K = [Ca+2][SO4-2] \ [CaSO4] В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m катионов An+ и n анионов Bm-, рассчитывается по уравнению:
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
P.S.: смотрим на электрохим. ряд напр., идем слева направо
Электрохимический ряд активности (ряд напряжений, ряд стандартных электродных потенциалов) металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ0, отвечающих полуреакции восстановления катиона металла Men+: Men+ + nē → Me
K-(катод)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
24 |
В свете строения атома можно объяснить причины изменения свойств химических элементов и образованных ими веществ. В периоде с увеличением зарядов атомных ядер элементов (слева направо) металлические свойства ослабевают, а неметаллические усиливаются в силу того, что: а) возрастает число электронов на внешнем уровне атома; б) число энергетических уровней в атомах в пределах периода остается постоянным; в) уменьшается радиус атомов. В группах (главная подгруппа) с увеличением зарядов атомных ядер элементов (сверху вниз) металлические свойства усиливаются, неметаллические ослабевают. Это объясняется тем, что • число электронов на внешнем уровне атомов остается одинаковым; • увеличивается число энергетических уровней в атоме; • увеличивается радиус атомов.
Изменение свойств элементов. По периоду слева направо:
По группе сверху вниз:
Перечислим закономерности изменения свойств, проявляемые в пределах периодов: - металлические свойства уменьшаются; - неметаллические свойства усиливаются; - степень окисления элементов в высших оксидах возрастает от +1 до +7 (+8 для Оs и Ru); - степень окисления элементов в летучих водородных соединениях возрастает от -4 до -1; - оксиды от основных через амфотерные сменяются кислотными оксидами; - гидроксиды от щелочей через амфотерные сменяются кислотами. Д. И. Менделеев в 1869 г. сделал вывод – сформулировал Периодический закон, который звучит так: Свойства химических элементов и образованных ими веществ находятся в периодической зависимости от относительных атомных масс элементов.
В периодах по мере увеличения заряда ядра радиусы атомов, в общем, уменьшаются, что связано с усилением притяжения внешних электронов к ядру. Наибольшее уменьшение атомных радиусов наблюдается у элементов малых периодов. В группах элементов радиусы атомов, в общем, увеличиваются, так как растет число электронных слоев. Таким образом, в изменении атомных радиусов элементов просматриваются разные виды периодичности: вертикальная, горизонтальная и диагональная.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении. Вода представляет собой слабый амфотерный электролит: Н2О Н+ + ОН- или, более точно:2Н2О Н3О+ + ОН- Диссоциация
воды – процесс эндотермический,
поэтому с повышением температуры в
соответствии с принципом Ле-Шателье
диссоциация усиливается, ионное
произведение возрастает и достигает
при 100 Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН. Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода, выраженной в молях на литр: pH=-lg[ H+ ] Гидроксильный показатель рОН — это десятичный логарифм концентрации гидроксильных ионов, взятый с обратным знаком: рОН=— lg[OH~]. Для измерения существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин. В табл. дана характеристика некоторых индикаторов.
Какова
массовая доля меди в малахите
Массовая доля — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
Mr((CuOH)2CO3)
= (64+16+1) Меди в молекуле 2 атома, значит, суммарная масса меди в 1 моле малахита равна 2*64= 128 г. Массовая
доля меди в малахите равна
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
25 |
Химическая связь — это взаимодействие атомов, обуславливающее устойчивость молекулы или кристалла как целого. Энергия связи – это энергия, которая выделяется при образовании молекулы из одиночных атомов. Длина связи – это расстояние между ядрами взаимодействующих атомов. Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору). Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных (однородных) системах. "Степень диссоциации это есть отношения числа продиссоциируемых молекул к общему числу молекул и умноженному на 100%": L=(n\N)* 100%. Свойства ковалентной связи : Направленность связи – обусловливает молекулярное строение органических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными. Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей Полярность – обусловлена неравномерным распределение электронной плотности вследствие различий в электроотрицательных атомов. ПО этому признаку ковалентные связи подразделяются на неполярные и полярные. Поляризуемость – выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов. Электроны тем подвижнее, чем дальше они находятся от ядер. Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом Металлическая связь - возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами.
Химические электроды - часть электрохимической системы, включающая в себя проводник (металлический или полупроводниковый) и окружающий его раствор (например,Водородный электрод, Хлорсеребряный электрод, Электрод сравнения, Стеклянный электрод) Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и растворомэлектролита).
Формула
Нернста -
n=2моль n=3моль n=2моль M=162,5г/моль M=65 г/моль M=56 г/моль m=325 г m=195 г m=112 г 1)
Х=16,7 г FeCI3 в избытке Решаем по не достатку 2) Х=5,74 г железа
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
26 |
Гибридизация – это такая перестройка электронной структуры атома, при которой происходит выравнивание энергии нескольких типов орбиталей и возникают орбитали нового типа. Гибридные орбитали, образованные s, p и даже d-орбиталями мало отличаются по форме, а потому имеют общее название q- орбиталей Строение молекул Физические и химические свойства молекул определяются их строением. Поэтому многие свойства могут быть предсказаны на основании структурной формулы.
Электроли́т — вещество, которое проводит электрический ток вследствие диссоциации на ионы, что происходит врастворах и расплавах, или движения ионов в кристаллических решётках твёрдых электролитов. Примерами электролитов могут служить водные растворы кислот, солей и оснований и некоторые кристаллы, (например, иодид серебра, диоксид циркония). Электролиты — проводники второго рода, вещества, электропроводность которых обусловлена подвижностью ионов. Классическая теория электролитической диссоциации была создана С. Аррениусом и В. Оствальдом в 1887 году. Аррениус придерживался физической теории растворов, не учитывал взаимодействие электролита с водой и считал, что в растворах находятся свободные ионы. Русские химики И. А. Каблуков и В. А. Кистяковскийприменили для объяснения электролитической диссоциации химическую теорию растворов Д. И. Менделеева и доказали, что при растворении электролита происходит его химическое взаимодействие с водой, в результате которого электролит диссоциирует на ионы. Классическая теория электролитической диссоциации основана на предположении о неполной диссоциации растворённого вещества, характеризуемой степенью диссоциации α, т. е. долей распавшихся молекул электролита. Динамическое равновесие между недиссоциированными молекулами и ионами описывается законом действующих масс . Например, электролитическая диссоциация бинарного электролита KA выражается уравнением типа:
Константа
диссоциации
Значение
где Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той жеконцентрации при неизменных прочих параметрах системы:
где solut. — данный раствор, nel. solut. — раствор неэлектролита той же концентрации, Tbp — температура кипения, а Tmp — температура плавления (замерзания). Основными причинами электролитической диссоциации являются, с одной стороны, взаимодействие растворенного вещества с растворителем, которое приводит к сольватации ионов, а с другой стороны - значительное ослабление электростатических взаимодействий между сольватированными ионами в среде, обусловленное ее электростатическим полем (диэлектрической проницаемостью растворителя). При этом работа, необходимая для разрушения молекул (кристаллической решетки), обеспечивается за счет энергии сольватации.
H2O+
H2O+
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
27 |
Водородная связь - это взаимодействие между двумя электроотрицательными атомами одной или разных молекул посредством атома водорода: А−Н ... В (чертой обозначена ковалентная связь, тремя точками - водородная связь). Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. В отличие от межмолекулярных взаимодействий водородная связь обладает свойствами направленности и насыщаемости, поэтому ее нередко считают одной из разновидностей ковалентной химической связи.
Межмолекулярное взаимодействие. В 1873 г. голландец Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение между молекулами. Они получили название Ван-дер-Ваальсовы силы и включают 3 составляющие:
Сте́пень окисле́ния — вспомогательная условная величина для записи процессов окисления, восстановления иокислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Окисли́тельно-восстанови́тельные реа́кции — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Окисление — процесс отдачи электронов, с увеличением степени окисления. Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. Типы ОВР. Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2S + Cl2 → S + 2HCl Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2H2O → 2H2 + O2 Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Cl2 + H2O → HClO + HCl Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например: NH4NO3 → N2O + 2H2O
Определение окислительно-восстановительных свойств элементов. Металлы обладают восстановительными свойствами, неметаллы окислительными. Если говорить упрощенно, то элементы в верхнем левом углу(таблицы Менделеева) обладают наиболее ярко выраженными восстановительными свойствами, а в диаметрально противоположном(т.е. левом нижнем) - окислительными. Есть также элементы обладающими и теми и другими свойствами в зависимости от условий реакции.
n=1моль n=3моль n=1моль M=60г/моль M=12 г/моль M=40 г/моль m=60 г m=36 г m=40 г 1)
Х=300 г SiO2 масса песка 2) Х=180г С m
(угля)=
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
28 |
Вода - хороший растворитель для многих веществ. Практически все вещества в той или иной степени растворимы в воде, поэтому ее называют универсальным растворителем. Раствор – это однородная система, образованная веществами, между которыми нет поверхности раздела. Вещества, образующие раствор, называют компонентами раствора, один из компонентов – растворитель, другое растворяемое или растворенное вещество, и продукта их взаимодействия. Отсутствие поверхности раздела между компонентами раствора отличает раствор от механической смеси веществ. Раствор – это однородная система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия. Сторонники физической теории растворов, которую развивали Вант-Гофф, Аррениус и Освальд, считали, что процесс растворения является результатом диффузии, т.е. проникновения растворенного вещества в промежутки между молекулами воды, т.е. физическое явление. В противоположность представлениям физической теории растворов Д.И. Менделеев и его сторонники доказывали, что растворение является результатом химического взаимодействия растворенного вещества с молекулами воды, т.е. химическое явление, поэтому, точнее определять раствор как однородную систему, состоящую из частиц растворенного вещества, растворителя и продуктов их взаимодействия. В результате химического взаимодействия с водой образуются соединения – гидраты. О химическом взаимодействии говорят такие признаки химических реакций, как изменение окраски и тепловые явления при растворении. В настоящее время принята теория, которая объединяет обе точки зрения, - физико-химическая теория растворов. Ее предсказал еще в 1906 г. Д.И. Менделеев. При растворении многих веществ их молекулы (или ионы) связываются с молекулами растворителя, образуя соединения, называемые сольватами (solvere — растворять); этот процесс называется сольватацией. В частном случае, когда растворителем (вещество, способное растворять другие вещества) является вода, эти соединения называются гидратами, а самый процесс их образования — гидратацией. Гидраты, как правило, нестойкие соединения, во многих случаях разлагающиеся уже при выпаривании растворов. Но иногда гидраты настолько прочны, что при выделении растворенного вещества из раствора вода входит в состав его кристаллов. Вещества, в кристаллы(твёрдые тела, в которых атомы расположены закономерно) которых входят молекулы воды, называются кристаллогидратами, а содержащаяся в них вода — кристаллизационной. Растворимость вещества – его качественная и количественная способность образовывать раствор при смешивании с другим веществом (растворителем). Растворимость вещества зависит от его природы и агрегатного состояния до растворения, а также от природы растворителя и температуры приготовления раствора.
Большая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов и цветных. Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2% железа — 4,1% кальция — 4,1% натрия — 2,3% магния — 2,3% калия - 2,1 % титана — 0,56%
Vтитр=25мл n=1моль n=1моль V(NaOH)=23.5мл M=40г/моль M=36.5г/моль Сн(NaOH)=0.45н m=40г m=36.5 г
1)m(NaOH)-? m= Э(NaOH)=40 2) 3) 25 мл→0,13 г HCI 500мл→Х X=2.6г HCI
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
29 |
По агрегатному состоянию растворы могут быть газообразными, жидкими и твердыми. Любой раствор состоит из растворенных веществ и растворителя, хотя эти понятия в известной степени условны. Например, в зависимости от соотношения количества спирта и воды эта система может быть раствором спирта в воде или воды в спирте. Обычно растворителем считают тот компонент, который в растворе находится в том же агрегатном со–стоянии, что и до растворения. Растворы веществ с молярной массой меньше 5000 г/моль называются растворами низкомолекулярных со–единений (НМС), а растворы веществ с молярной мас–сой больше 5000 г/моль – растворами высокомолекулярных соединений (ВМС). По наличию или отсутствию электролитической диссоциации растворы НМС подразделяют на два класса – растворы электролитов и неэлектролитов. Растворы электролитов – растворы диссоциирующих на ионы солей, кислот, оснований, амфолитов. Например, растворы KNО3, HCl, КОН, Аl(ОН)3 , глицина. Электрическая проводимость растворов электролитов выше, чем растворителя. Растворы неэлектролитов – растворы веществ, практически не диссоциирующих в воде. Например, растворы сахарозы, глюкозы, мочевины. Электриче–ская проводимость растворов неэлектролитов мало отличается от растворителя. Растворы НМС (электролитов и неэлектролитов) называются истинными в отличие от коллоидных растворов. Истинные растворы характеризуются гомогенностью состава и отсутствием поверхности раздела между растворенным веществом и растворителем. Раз–мер растворенных частиц (ионов и молекул) меньше 10-9м. Большинство ВМС – полимеры, молекулы которых (макромолекулы) состоят из большого числа повторяющихся группировок или мономерных звеньев, со–единенных между собой химическими связями. Растворы ВМС называются растворами полиэлектролитов. К полиэлектролитам относятся поликислоты (гепарин, полиадениловая кислота, полиаспарагиновая кис–лота и др.), полиоснования (полилизин), полиамфолиты (белки, нуклеиновые кислоты). Концентрация — величина, характеризующая количественный состав раствора. концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л), то есть это отношение неоднородных величин. Те величины, которые являются отношением однотипных величин (отношение массы растворённого вещества к массе раствора, отношение объёма растворённого вещества к объёму раствора), правильно называть «долями». Однако на практике для обоих видов выражения состава применяют термин «концентрация» и говорят о концентрации растворов
Молярная концентрация —
количество растворённого вещества
(число молей) в единице объёма раствора.
Молярная концентрация в системе
СИ измеряется в моль/м³, однако
на практике её гораздо чаще выражают
в моль/л или ммоль/л. Также распространено
выражение в «молярности». Возможно
другое обозначение молярной
концентрации Примечание: единица «моль» не склоняется по падежам. После цифры пишут «моль», подобно тому, как после цифры пишут «см», «кг» и т. п.
где:
Массовая доля (Процентная концентрация) — отношение массы растворённого вещества к массе раствора. Массовая доля измеряется в долях единицы или в процентах:
где:
Массовое процентное содержание компонента, m% m%=(mi/Σmi)*100 Нормальная концентрация — количество эквивалентов данного вещества в 1 литре раствора. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
где:
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4. Моляльность — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
где:
Следует обратить особое внимание, что, несмотря на сходство названий, молярная концентрация и моляльность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры. Мольная доля — отношение количества молей данного компонента к общему количеству молей всех компонентов. Мольную долю выражают в долях единицы.
где:
Титр раствора — масса растворённого вещества в 1 мл раствора.
где:
В аналитической химии обычно концентрацию титранта пересчитывают применительно к конкретной реакции титрования таким образом, чтобы объём использованного титранта непосредственного показывал массу определяемого вещества; то есть титр раствора показывает, какой массе определяемого вещества (в граммах) соответствует 1 мл титрованного раствора.
Таблица.Типы химической связи и их основные отличительные признаки.
Вычислите массу
Vтитр=25мл n=1моль n=1моль V(NaOH)=23.5мл M=40г/моль M=36.5г/моль Сн(NaOH)=0.45н m=40г m=36.5 г
1)m(NaOH)-? m= Э(NaOH)=40 2) 3) 25 мл→0,13 г HCI 500мл→Х X=2.6г HCI
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
30 |
Неэлектролиты Это вещества, растворы или расплавы которых не проводят электрический ток. К ним относятся: кислород, водород, многие органические вещества (сахара, эфиры, бензол и др.). В молекулах этих веществ существуют ковалентные не полярные или малополярные связи. Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем) удобнее использовать другую формулировку:
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействиямежду однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором. Второй закон Рауля[править | править исходный текст] Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Понижение температуры кристаллизации растворов(Криометрический Закон) Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C. Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур. Повышение температуры кипения растворов(Эбулиометрический закон) Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
Закон Вант-Гоффа. Осмотическое давление раствора равно газовому давлению, которое производило бы растворенное вещество, находясь в газообразном состоянии и занимая объем, равный объему раствора.
где Росм – осмотическое давление, кПа; с – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная, 8,314 Дж/(мольК); Т – абсолютная температура, К; V(р-ра) – объем раствора, л. Зависимость скорости реакции от температуру выражается правилом Вант-Гоффа: При увеличении температуры на каждые 10 градусов скорость химической реакции увеличивается в 2-4 раза Разбавленные растворы неэлектролитов обладают. [1] Разбавленные растворы неэлектролитов обладают рядом свойств ( коллигативные свойства), количественное выражение которых зависит только от числа находящихся в растворе частиц растворенного вещества и от количества растворителя. Некоторые коллигативные свойства растворов используются для определения молекулярной массы растворенного вещества. [2] Свойства разбавленных растворов неэлектролитов, относящихся к нелетучим веществам, описываются следующими законами. [3] Для разбавленного раствора неэлектролита, согласно ( 103) ( гл. [4] Поведение разбавленных растворов неэлектролитов как идеальных разбавленных растворов обусловливает их так называемые общие свойства растворов, которые не зависят от природы растворенного вещества, а только от его долевой мольной концентрации. [5] Для разбавленных растворов неэлектролитов все эти величины находятся в простой пропорциональной зависимости от числа молекул растворенного вещества. [6] В разбавленном растворе неэлектролита число частиц совпадает с числом молекул, в то время как в разбавленном растворе электролита число частиц увеличивается в результате диссоциации и во столько же раз возрастает депрессия. [7] В умеренно разбавленных растворах неэлектролитов коэффициент активности заметно отличается от единицы. [8] В разбавленных растворах неэлектролитов молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа. Если, например, налить в стакан концентрированный раствор сахарозы, а сверху слой чистой воды, то через некоторое время концентрация молекул сахарозы станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией. В данном случае имеет место встречная, или двусторонняя, диффузия молекул сахарозы в воду и молекул воды в сахарозу. [9] В разбавленных растворах неэлектролитов молекулы растворенного вещества практически не взаимодействуют друг с другом из-за большого расстояния между ними. Поведение этих молекул в растворе аналогично поведению молекул идеального газа. Действительно, если, например, налить в стакан концентрированный раствор сахарозы, а сверху слой чистой воды, то через некоторое время концентрация молекул сахарозы станет одинаковой во всем объеме раствора. Такое взаимное проникновение молекул называется диффузией. В данном случае имеет место встречная или двусторонняя диффузия молекул сахарозы в воду и молекул воды в сахарозу. [10] Исследование свойств разбавленных растворов неэлектролитов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном объеме данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [11] Некоторые свойства разбавленных растворов неэлектролитов могут быть описаны количественно и выражены в виде законов. [12]
Исследование свойств разбавленных растворов неэлектролитов показало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля.
ЭЛЕКТРОДЫ в электрохимии, электронно-проводящие фазы, контактирующие с ионным проводником (электролитом). Часто под электродом понимают лишь одну электронно-проводящую фазу. При пропускании тока от внеш. источника через систему из двух электродов, соединенных друг с другом через электролит, на электродах протекают два процесса: заряжение двойного электрического слоя и электрохим. р-ция. В отличие от фазовых контактов металл-металл, металл-полупроводник, полупроводник-полупроводник и т. п. на фанице фаз, составляющих электрохим. систему, вид носителей тока меняется, т. к. в электролите ток переносится ионами, а в электронно-проводящей фазе - электронами. Непрерывность прохождения тока через фаницу фаз в этом случае обеспечивается электродной р-цией. Электрод наз. анодом, если на его пов-сти преобладает р-ция, приводящая к генерированию электронов, т. е. происходит окисление в-в, содержащихся в электролите, либо ионизация металла анода. Электрод наз. катодом, если с его пов-сти электроны металла переходят на частицы реагирующих в-в, к-рые при этом восстанавливаются. Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита) . Ряд стандартных электродных потенциалов металлов В ряду активности, а точнее, в ряду стандартных электродных потенциалов, металлы расположены в порядке уменьшения их восстановительных свойств.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, истандартными электродными потенциалами окислительно-восстановительных пар
Нернст изучал поведение
электролитов при пропускании
электрического тока и открыл закон.
Закон устанавливает зависимость между
электродвижущей силой ( разностью
потенциалов ) и ионной концентрацией.
Уравнение Нернста позволяет предсказать
максимальный рабочий потенциал,
который может быть получен в результате
электрохимического взаимодействия,
когда известны давление и температура.
Таким образом, этот закон связывает
термодинамику с электрохимической
теорией в области решения проблем,
касающихся сильно разбавленных
растворов. где
Если в формулу Нернста
подставить числовые значения
констант
Германий! Четвертая группа, пятый период. порядковый номер 32. 1s22s22p63s23p63d104s24p2-германий Ge-4 период,4 главная подгруппа Хим.свойства: При комнатной температуре он устойчив к действию воздуха, кислорода, воды, соляной и серной (разб.) кислот
Ge+2H2SO4=GeO2 (осад.)+2H2O+2SO2 Ge реагирует со щелочами Ge+2NaОН+2H2O2=NaGeO3(германат натрия)+3H2O
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



 -
германий Ge. В
периодической системе Менделеева
находится в 4 главной подгруппе, заряд
ядра +32, электрона 32, протона 32, нейтроны
41.
-
германий Ge. В
периодической системе Менделеева
находится в 4 главной подгруппе, заряд
ядра +32, электрона 32, протона 32, нейтроны
41.
 и
H2SO4
(конц.) окисляют до GeO2
и
H2SO4
(конц.) окисляют до GeO2
 ).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды
).
Рассчитайте массу оксида серы (IV),
которую можно получить из 2 тонн такой
руды
 (ZnS)=30%
2т-100%
(ZnS)=30%
2т-100% m(ZnS
руд)=2т x-30%
m(ZnS
руд)=2т x-30%

 96,8%, которая расходуется на электролиз.
96,8%, которая расходуется на электролиз.


 m(NaCI)-?
m(NaCI)-?

 :
FeCl2(хлорид
железа(II)-
растворимая средняя соль зеленоватого
цв.), Fe(OH)2
–гидроксид железа(II)-
нерастворимое основание желтого
цвета, зеленеет в воздухе, FeO-
основной оксид черного цвета
нерастворимый в воде.
:
FeCl2(хлорид
железа(II)-
растворимая средняя соль зеленоватого
цв.), Fe(OH)2
–гидроксид железа(II)-
нерастворимое основание желтого
цвета, зеленеет в воздухе, FeO-
основной оксид черного цвета
нерастворимый в воде. :
FeCl3-хлорид
железа(III)
желтовато-бурого цв., Fe(OH)3-гидроксид
железа(III)
с признаками амфотерности(коричневого
цв.), нерастворимый в воде, Fe2O3-оксид
железа(III)
c
признаками амфотерности(красноватого
цв., нерастворимый в воде.)
:
FeCl3-хлорид
железа(III)
желтовато-бурого цв., Fe(OH)3-гидроксид
железа(III)
с признаками амфотерности(коричневого
цв.), нерастворимый в воде, Fe2O3-оксид
железа(III)
c
признаками амфотерности(красноватого
цв., нерастворимый в воде.) :
Ферраты —
соли не существующей в свободном виде
железной кислоты H2FeO4. Это соединения
фиолетового цвета, по окислительным
свойствам напоминающие перманганаты,
а по растворимости — сульфаты.
Получают ферраты при действии
газообразного хлора или озона на
взвесь Fe(OH)3 в щелочи.
:
Ферраты —
соли не существующей в свободном виде
железной кислоты H2FeO4. Это соединения
фиолетового цвета, по окислительным
свойствам напоминающие перманганаты,
а по растворимости — сульфаты.
Получают ферраты при действии
газообразного хлора или озона на
взвесь Fe(OH)3 в щелочи. NiО
+ H2О
NiО
+ H2О
 (Cu)=68%
(Cu)=68%

 (Zn)=32%
m (Zn)=600-408=192гили
(Zn)=32%
m (Zn)=600-408=192гили m
латуни=600 г
m
латуни=600 г



 =36,5%
=36,5%

 p=1.18г/мл
НСI
m(HCIр-ра)=1000*1,18=1180г
p=1.18г/мл
НСI
m(HCIр-ра)=1000*1,18=1180г

 𝑁=NA*n
Vm=22.4л/моль
1мл=0,001л
𝑁=NA*n
Vm=22.4л/моль
1мл=0,001л =0,000045
моль=0,045 ммоль(милимоль)
=0,000045
моль=0,045 ммоль(милимоль) N-?
N=0.000045*6.02*1023=0.0002709*1023=2.702*1027
N-?
N=0.000045*6.02*1023=0.0002709*1023=2.702*1027 ,
p-элемент, 6 энергетических
уровня, на 3 энерг. уровне 18 электронов.
,
p-элемент, 6 энергетических
уровня, на 3 энерг. уровне 18 электронов.

 x=1.12г
x=1.12г



 (Cu)=80%
(Cu)=80%

 (Ni)=20%
m
(Ni)=350-280=70кг или
(Ni)=20%
m
(Ni)=350-280=70кг или m
мельхиор=350кг
m
мельхиор=350кг







 m(p-pa
1)=150г
m(p-pa
1)=150г
 =2%
=2%

 =4%
m(р-ра
общ)=150+350=500г
=4%
m(р-ра
общ)=150+350=500г -? m(в-ва
общ)=3+14=17г
-? m(в-ва
общ)=3+14=17г








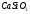 ),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль.
),
если тепловой эффект реакции
взаимодействия оксида кальция (II)
c
диоксидом кремния 38,5 кДж/моль.

 .
. m(C2H5OH)=9.2г=g2
m(C2H5OH)=9.2г=g2 =
= =
= =1.86град.С.
=1.86град.С.
 M(C2H5OH)=46г/моль
M(C2H5OH)=46г/моль -?
-?



 )
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей?
)
массой 200 кг при взаимодействии его
с водой, если гидрид кальция содержит
12% примесей?
 =176кг
=176кг Х=188 л
Х=188 л
 ,
используя табличные данные
термодинамических характеристик
веществ.
,
используя табличные данные
термодинамических характеристик
веществ. (пр)-
(пр)- (реагентов)
(реагентов)
 .
.
 (пр)-
(пр)- (реагентов)=-393.5-(-110.5)*2=-393.5+221=-172.5кДж
(реагентов)=-393.5-(-110.5)*2=-393.5+221=-172.5кДж

 в карбонате кальция.
в карбонате кальция. CaO+CO2
CaO+CO2


 =8
кг
=8
кг Х=4,48кг
Х=4,48кг

 →Ag
→Ag →Pb
→Pb →Ni
→Ni

 значения 10-13.
значения 10-13.
 ?
? 2+12+3
2+12+3 16=162+60=222
г.
16=162+60=222
г.
 ,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке?
,
прибавили 10 г гранул цинка. Какая
масса железа образовалась в осадке?


 ),
а другая пластина из луженого железа
(
),
а другая пластина из луженого железа
( ).
Составьте реакции, протекающие на
пластинах.
).
Составьте реакции, протекающие на
пластинах. Zn+Fe2+→
Fe +Zn2+
Zn+Fe2+→
Fe +Zn2+ Fe+Sn2+→
Fe2++Sn
Fe+Sn2+→
Fe2++Sn

 Энергия
Ван-дер-Ваальсового взаимодействия
обратно пропорциональна расстоянию
между центрами в шестой степени и,
следовательно, на порядок ниже энергии
химической связи. Силы Ван-дер-Ваальсового
взаимодействия увеличиваются с
возрастанием числа электронов в
молекуле, т.е. с увеличением молекулярной
массы. Наличие этих сил обуславливает
возможность образование жидкого
состояния у газов (в том числе у
благородных газов) и отклонение
реальных газов от уравнения
Менделеева-Клайперона.
Энергия
Ван-дер-Ваальсового взаимодействия
обратно пропорциональна расстоянию
между центрами в шестой степени и,
следовательно, на порядок ниже энергии
химической связи. Силы Ван-дер-Ваальсового
взаимодействия увеличиваются с
возрастанием числа электронов в
молекуле, т.е. с увеличением молекулярной
массы. Наличие этих сил обуславливает
возможность образование жидкого
состояния у газов (в том числе у
благородных газов) и отклонение
реальных газов от уравнения
Менделеева-Клайперона.  .
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг?
.
Какая масса песка и угля, массовая
доля углерода в котором 95%, потребуется
для получения карборунда массой 200
кг?



 ,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
,
содержащейся в 500 мл раствора, если
на титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
 .
. V=500мл
V=500мл

 m(HCI)-?
m(HCI)-?
 Х=0,13 г
Х=0,13 г ,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
,
содержащейся в 500 мл раствора, если на
титрование 25 мл его израсходовано
23,5 мл 0,15 н раствора
 .
. V=500мл
V=500мл

 m(HCI)-?
m(HCI)-?
 Х=0,13 г
Х=0,13 г и
H2SO4
(конц.) окисляют до GeO2
и
H2SO4
(конц.) окисляют до GeO2