
- •Типы межатомных связей в твердых телах. Строение и свойства кристаллических тел с различными межатомными связями.
- •Атомно-кристаллическое строение металлов
- •4.Анизотропия металлов
- •5. Строение реальных металлов
- •6. Кристаллизация металлов
- •7. Строение слитка
- •8. Полиморфные превращения в металлах
- •9. Пластическая деформация и механические свойства металлов.
- •10. Наклеп, возврат, рекристаллизация
- •11. Химические соединения, твердые растворы, механические смеси.
- •12. Построение диаграмм состояния двойных систем. Правило фаз.
- •13. Диаграмма состояния для сплавов, образующих механические смеси из чистых компонентов.
- •14. Правило отрезков.
- •15. Диаграмма состояния для сплавов с неограниченной растворимостью в твердом состоянии.
- •16. Диаграмма состояния для сплавов с ограниченной растворимостью в твердом состоянии(с эвектикой, перитектикой).
- •17. Диаграмма состояния для сплавов, образующих устойчивое химическое соединение.
- •18. Диаграммы состояния для сплавов с неустойчивым химическим соединением.
- •19. Диаграмма состояния железо - цементит.
- •20. Углеродистые стали.
- •20. Влияние постоянных примесей на свойства сталей.
- •22. Нагартованная сталь.
- •23. Чугуны(белый, серый, высокопрочный, ковкий). Получение, стр-ра, маркировка, область применения.
- •24. Основные виды термической обработки сталей.
- •25. Превращения в стали при нагреве.
- •26. Рост зерна аустенита при нагреве.
- •27. Распад аустенита.
- •28. Мартенситное превращение.
- •29. Превращение мартенсита и а ост.При нагреве(отпуск стали).
- •30. Обратимая и необратимая отпускная хрупкость.
Типы межатомных связей в твердых телах. Строение и свойства кристаллических тел с различными межатомными связями.
Ионная связь – присуща химическим соединениям, образованным элементами с резко различающейся валентностью. Так металлы, имея 1 или 2 электрона на внешней орбите, которые не прочно связаны с ядром, вступая в реакцию с неметаллами, металлы отдают электроны и превращаются в ионы. Неметаллы принимают эти электроны, превращаясь в отрицательные ионы => ионная связь обеспечивает электро – статическое притяжение. Na + Cl2 => NaCl -1 +7 + - Ионная связь жесткая и направленная => все химические соединения прочные, твердые, но очень хрупкие (низкая пластичность). Ионная связь характерна для окислов различных элементов. Ковалентная связь – устанавливается в результате образования устойчивых соединений, путем обобществления электронов группой атомов. Обобществление электронов зависит от валентности элемента и определяется по следующей зависимости: C = 9 – M, где C – число атомов обобществляющих электрон, 9 – устойчивая электронная конфигурация, M – валентность элемента. Ковалентная связь возникает между атомами соседей, которые обобществляют один из электронов соседа. Ковалентная связь характерна для кристаллических тел. Пример: алмаз - кристаллическая модификация углерода с ковалентной связью. Образование алмаза возникает при обобществлении по одному электрону четырех атомов. Ковалентная связь – жесткая, направленная => прочная. Она характерна для пластмасс. Металлическая связь обусловлена строением атома, на внешней орбите у металла 1-2 электрона, они слабо связаны с ядром. Для металла характерны кристаллические решетки с плотным расположением атомов => внешние оболочки соприкасаются и пересекаются. Все валентные электроны обобществляются (общие в пределах твердого тела) и образуют электронный газ. Возникают пары атомов превращающихся в разнозаряженных атомов, которые связаны силами электростатического напряжения. Металлическая связь – гибкая, нежесткая. Свойства металлов: высокая прочность, пластичность, электропроводность, теплопроводность. Металлическая связь характерна всем металлам и их сплавам => металлы широко применяются в производстве. В металлах можно повысить прочность: 1. Изменением химического состава 2. Изменением строением металла в результате термической обработки Силы Ван-дер-Вальса - они основаны на том, что все атомы являются диполями. Это связано с тем, что при сближении атомов происходит поляризация, что приводит к появлению сил притяжения. Диполи возникают при смещении центров отрицательно заряженных электронов относительно центров положительно заряженных электронов. Силы Ван-дер-Вальса направленные. Связь слабая и незаметна, она присутствует в полимерах.
Атомно-кристаллическое строение металлов
Каждый металл (вещество) может находиться в четырех агрегатных состояниях: газообразном, жидком, твердом и в виде плазмы. В газообразном состоянии расстояние между атомами (частицами) велико, силы взаимодействия малы и атомы хаотично пере- мещаются в пространстве, отталкиваясь друг от друга. Атомы газообразного вещества обладают большой кинетической энергией. В жидком металле атомы сохраняют лишь ближний порядок, т.е. в небольшом объеме упорядоченно и закономерно расположено небольшое количество атомов. Ближний порядок неустойчив, он может возникать и исчезать под действием тепловых колебаний.
В металлах, находящихся в твердом состоянии, порядок расположения атомов строго определен и закономерен, силы взаимодействия уравновешены, тело сохраняет свою форму. Металлы имеют кристаллическое строение с правильным закономерным расположением атомов в пространстве. Закономерное расположение атомов (точнее, положительно заряженных ионов) приведено на рис. 2.1. Воображаемые линии, проведенные через центры атомов, расположенных в одной плоскости, образуют решетку, в узлах которой располагаются атомы.
Такая конфигурация называется кристаллографической плоскостью. Многократное повторение кристаллографических плоскостей в пространстве позволяет получить пространственную кристаллическую решетку (рис. 2.2). Пространственная кристаллическая решетка сложна в изображении, поэтому представление об атомном строении кристаллов дается в виде элементарных кристаллических ячеек. Под элементарной кристаллической ячейкой понимают минимальный объем, дающий представление об атомной структуре металла в целом, его повторение в пространстве образует кристаллическую решетку. Элементарные кристаллические ячейки характеризуются следующими основными параметрами: периодом решетки, координационным числом, атомным радиусом, базисом(атомной плотностью).
Периодом решетки называется расстояние между центрами двух соседних частиц (атомов, ионов) в элементарной ячейке решетки (рис. 2.3).
Периоды решетки измеряют в нанометрах (нм) или пикометрах (пм).
К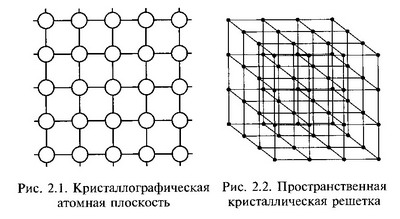 оординационное
число К показывает количество атомов,
находящихся на самом близком расстоянии
от любого выбранного атома в решетке.
Под атомным радиусом понимают половину
межатомного расстояния между центрами
ближайших атомов в кристаллической
решетке элемента при равновесных
условиях. Базисом решетки называется
количество атомов, приходящихся на одну
элементарную ячейку решетки.
оординационное
число К показывает количество атомов,
находящихся на самом близком расстоянии
от любого выбранного атома в решетке.
Под атомным радиусом понимают половину
межатомного расстояния между центрами
ближайших атомов в кристаллической
решетке элемента при равновесных
условиях. Базисом решетки называется
количество атомов, приходящихся на одну
элементарную ячейку решетки.
Простейшим типом кристаллического строения является кубическая решетка, в которой атомы расположены в углах куба (см. рис. 2.3). На ее примере покажем основные параметры решетки:
• период решетки равен 6;
• координационное число К= 6;
• базис решетки равен 1, каждый из атомов, расположенных в углах куба, принадлежит одной из восьми элементарных ячеек, т.е. на одну ячейку приходится ⅛ атома).
В простой кубической решетке атомы уложены (упакованы) недостаточно плотно. Стремление атомов занять места, наиболее близкие друг к другу, приводит к образованию новых типов решеток.
Металлы, описываемые пространственной кристаллической решеткой, под которой понимают наименший комплекс атомов, при многократной трансляции которых по всем направлениям воспроизводится пространственная кристаллическая решетка.
В узлах кристаллической решетки располагаются атомы.
Пространственную кристаллическую решетку легче всего представить в виде элементарной кристаллической ячейки. Ячейка – это та часть решетки, при многократной трансляции которой она и воспроизводится.
Три основные вектора элементарной ячейки называются трансляционными плоскими осевыми единицами.
Абсолютная величина трансляции – это период кристаллической решетки.
Период кристаллической решетки измеряют в анкстреммах
1А=10-8 см или в кХ (килоиксах), так называемых кристаллографических анкстреммах.
1кХ=1,00202 А
На одну элементарную ячейку приходится различное количество атомов; при чем атомы занимают определенные места в ячейке.
В зависимости от расположения атомов в ячейке различают простые, кубические, объемно-центрированные кубические, гранецентрированные кубические, гексагональные решетки.
1.Простая решетка представляется в виде куба, в узлах которой располагаются атомы.
Простейшая решетка описывается одним параметром, которым является ребро куба а.
2.Объемно-центрированная кубическая решетка (ОЦК) представляет собой также куб, внутри которого дополнительно расположен еще один атом.
Параметры решетки определяются длиной ребра куба а.
3.Гранецентрированная кубическая решетка (ГЦК) представляет собой куб, В центре каждой грани которого расположены дополнительно по одному атому.
4.Гексагональная плотно упакованная решетка. В отличие от кубической характеризуется двумя параметрами а и с.
В случае, если отношение с/а=1,666, то решетка считается плотноупакованной, а иначе – неплотно упакованной.
Примеры:
ОЦК – вольфрам, молибден, железо Fe;
ГЦК – алюминий, медь, никель, железо Fe;
ГПУ – бериллий … .
Некоторые металлы, например индий, имеют тетрагональную решетку.
Свойства металлов при прочих равных условиях определяются типом кристаллической решётки, т.е. количеством атомов, приходящихся на одну элементарную ячейку. На простую ячейку приходит с один полный атом.
На ОЦК ячейку приходится два атома: один атом вносится атомом и один принадлежит только этой ячейке.
Для ВЦК на одну ячейку приходится четыре атома.
Плотность кристаллической решетки определяется, так называемым координатным числом. Под координатным числом понимается число атомов, находящихся на кратчайшем расстоянии от данного атома. Для ОЦК решетки К=8, для ГЦК – К=12 и для ГПУ – К=12.
От величины координатного числа зависит компактность (плотность укладки) кристаллической решетки. Так в простой кристаллической решетки плотность укладки атомов в ячейке составляет менее 50%. В ОЦК – 50%, в решетках с координатным числом 12 – порядка 75%. 3. Кристаллографические обозначения атомных плоскостей и направлений.
Под кристаллографическими плоскостями понимается 3 целых взаимно простых числа обратно пропорциональных числу осевых единиц, отсекаемых данной плоскостью по координатным осям x,y,z.
ABCD (100), AFKB (001), BKLD (010)
Под индексами кристаллографических плоскостей и направлений было вызвано потребностью объяснить зависимость свойств металлов от направлений кристаллографических плоскостей. Иными словами, дать объяснение с точки зрения техники понятие влияния анизотропии.
По различным направлениям в кристалле располагаются различные количества атомов: физические, химические, механические при прочих равных условиях и определяются числом атомов, расположенным в данном направлении; чем больше количество атомов расположено в данном направлении, тем выше уровень свойств.
Неодинаковость свойств по различным направлениям в кристалле и называется анизотропией.
Любой кристалл – анизотропен. Однако, поскольку реальные металлы состоят из большого числа зерен (на 1 см2 – десятки тыс. зерен) создается впечатление, что металл изотропен, т.к. каждое из зерен ориентировано по-своему – это явление получило название квазианизотропией (ложной).
Поэтому, если испытывать металл по различным направлениям, то свойства его будут одинаковы. Деформирование металлов приводит к ориентации зерен, а также кристаллографических плоскостей в направлении деформации. Закономерная ориентация кристаллографических плоскостей в направлении действующих нагрузок называется текстурой.
