
- •Вопрос 2. Криволинейное движение
- •Вопрос 3. Кинематика вращательного движения
- •Вопрос 4. Законы динамики Ньютона
- •Вопрос 5. Закон сохранения импульса
- •Вопрос 6. Работа, мощность.
- •Вопрос 8. Момент инерции твердого тела
- •Вопрос 9. Работа и кинетическая энергия вращения.
- •Вопрос 7. Энергия
- •Вопрос 10. Основной закон динамики вращения
- •Вопрос 12. Механические колебания
- •Вопрос 11. Закон сохранения момента импульса
- •Вопрос 18. Теплоемкость.
- •Вопрос 17. Первое начало термодинамики.
- •Вопрос 19. Применение первого закона термодинамики к изопроцессам.
- •Вопрос 21. Второе начало термодинамики.
- •Вопрос 20. Адиабатический процесс.
- •Кпд тепловой машины Карно Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
- •Вопрос 24. Напряженность электрического поля в вакууме.
- •Вопрос 23. Свойства физических зарядов.
- •Вопрос 27. Связь напряженности эл. Поля с потенциалом.
- •Вопрос 28. Проводники в электрическом поле.
- •Вопрос 30. Энергия электростатического поля.
- •Вопрос 31. Постоянный электрический ток.
- •Вопрос 33. Закон Ома для замкнутой цепи.
- •Вопрос 32. Закон Ома для однородного участка цепи.
- •Вопрос 34. Работа и мощность электрического тока.
- •Вопрос 36. Движение заряжен частиц в магнитном поле.
- •Вопрос 35. Магнитное поле в вакууме.
- •Вопрос 39. Поток вектора магнитной индукции сквозь произвольную поверхность.
- •Вопрос 42. Явление самоиндукции.
- •Вопрос 41. Электромагнитная индукция.
- •Вопрос 43. Энергия магнитного поля тока.
- •Вопрос 45. Ферромагнетизм.
- •Вопрос 44. Закон полного тока.
- •Вопрос 46. Интерференция света от двух источников .
- •Вопрос 48. Дифракция света.
- •Вопрос 49. Поляризация света.
- •Вопрос 55. Волновые свойства микрочастиц.
- •Вопрос 59. Современные представления об электропроводности твердых тел.
- •Вопрос 58. Атом водорода в квантовой механике.
- •Вопрос 60. Атомное ядро.
Вопрос 19. Применение первого закона термодинамики к изопроцессам.
Среди
равновесных процессов, происходящих
с термодинамическими системами,
выделяются изопроцессы, при которых
один из основных параметров состояния
сохраняется постоянным.
Изохорный
процесс
(V=const).
При изохорном процессе газ не совершает
работы над внешними телами, т.е.
![]() .
то есть вся теплота, которую получает
газ идёт на изменение его внутренней
энергии.
.
то есть вся теплота, которую получает
газ идёт на изменение его внутренней
энергии.
![]() Используя первое
начало термодинамики
можно найти колич
теплоты при
изохорн процесе:
Используя первое
начало термодинамики
можно найти колич
теплоты при
изохорн процесе:
![]()
Изобарный процесс (p=const). Работа, совершаемая газом при расширении или сжатии газа, равна A = PΔV. Количество теплоты, получаемое или отдаваемое газом, характеризуется изменением энтальпии: δQ = ΔI = ΔU + PΔV.
физический смысл молярной газовой постоянной R: если Т2–Т1=1K, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К. В изобарном процессе при сообщении газу массой m количества теплоты его внутренняя энергия возрастает При этом газ совершит работу.
Изотермический
процесс
(T=const).
Изотермический
процесс —
термодинамический
процесс,
происходящий в физической системе при
постоянной температуре.
Для осуществления изотермического
процесса систему обычно помещают в
термостат
(массивное тело, находящееся в тепловом
равновесии),
теплопроводность
которого велика, так что теплообмен с
системой происходит достаточно быстро
по сравнению со скоростью протекания
процесса и температура системы в любой
момент практически не отличается от
температуры термостата. Графиком
изотермического процесса является
изотерма. В идеальном
газе
при изотермическом процессе произведение
давления на объём постоянно (закон
Бойля-Мариотта).
Изотермы идеального газа в координатах
p,V
— гиперболы, расположенные на графике
тем выше, чем выше температура, при
которой происходит процесс (см. рисунок).
При изотермическом процессе системе,
вообще говоря, сообщается определённое
количество теплоты (или она отдаёт
теплоту) и совершается внешняя работа.
Альтернативный процесс, при котором
теплообмен с окружающей средой
отсутствует (термодинамическая система
находится в энергетическом равновесии
— система не поглощает и не выделяет
тепло), называется адиабатическим
процессом.
Работа,
совершенная идеальным газом в
изотермическом процессе, равна
![]() ,
где
,
где
![]() —
число частиц газа,
—
число частиц газа,
![]() —
температура,
—
температура,
![]() и
и
![]() —
объём газа в начале и конце процесса,
—
объём газа в начале и конце процесса,
![]() —
постоянная
Больцмана
. В твёрдом теле и большинстве жидкостей
изотермические процессы очень мало
изменяют объём тела, если только не
происходит фазовый
переход.
Первый закон термодинамики для
изотермического процесса в идеальном
газе записывается в виде:
—
постоянная
Больцмана
. В твёрдом теле и большинстве жидкостей
изотермические процессы очень мало
изменяют объём тела, если только не
происходит фазовый
переход.
Первый закон термодинамики для
изотермического процесса в идеальном
газе записывается в виде:
![]()
![]()
Вопрос 21. Второе начало термодинамики.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное. Если за цикл совершается положительная работа (цикл протекает по часовой стрелке), то он называется прямым, если за цикл совершается отрицательная работа (цикл протекает против часовой стрелки), то он называется обратным.
Термодинамический
процесс называется обратимым, если он
может происходить как в прямом, так и
в обратном направлении, причем если
такой процесс происходит сначала в
прямом, а затем в обратном направлении
и система возвращается в исходное
состояние, то в окружающей среда и в
этой системе не происходит никаких
изменений. Всякий процесс, не
удовлетворяющий этим условиям, является
необратимым.
Любой равновесный процесс является
обратимым. Обратимые
процессы – это идеализация реальных
процессов.
Их рассмотрение важно по двум причинам:
1) многие процессы в природе и технике
практически обратимы; 2) обратимые
процессы являются наиболее экономичными;
имеют максимальный термический
коэффициент полезного действия, что
позволяет указать пути повышения к. п.
д. реальных тепловых двигателей.
Энтропия.
Понятие энтропии введено в 1865 г. Р.
Клаузиусом. Для выяснения физического
содержания этого понятия рассматривают
отношение теплоты Q,
полученной телом в изотермическом
процессе, к температуре Т теплоотдающего
тела, называемое
приведенным количеством теплоты.
Приведенное количество теплоты,
сообщаемое телу на бесконечно малом
участке процесса, равно Q/T.
Строгий теоретический анализ показывает,
что приведенное количество теплоты,
сообщаемое телу в любом
обратимом круговом процессе,
равно нулю энтропия
замкнутой системы
может либо
возрастать
(в случае необратимых процессов), либо
оставаться постоянной
(в случае обратимых процессов).
Неравенство
Клаузиуса
(1854): Количество теплоты, полученное
системой при любом круговом процессе,
делённое на абсолютную температуру,
при которой оно было получено (приведённое
количество теплоты), неположительно.
![]() Второе
начало термодинамики. Используя
понятие энтропии и неравенство Клаузиуса,
второе
начало
термодинамики
можно сформулировать как
закон возрастания энтропии
замкнутой системы при необратимых
процессах: любой
необратимый процесс в замкнутой системе
происходит так, что энтропия системы
при этом возрастает.
Закон
Стефана — Больцмана —
Мощность излучения абсолютно чёрного
тела прямо пропорциональна площади
поверхности и четвёртой степени
температуры тела:
P
= SεσT4,
где
ε
- степень черноты (для всех веществ ε
< 1,
для абсолютно черного тела ε
= 1).
При помощи закона Планка для излучения,
постоянную σ
можно опр как
Второе
начало термодинамики. Используя
понятие энтропии и неравенство Клаузиуса,
второе
начало
термодинамики
можно сформулировать как
закон возрастания энтропии
замкнутой системы при необратимых
процессах: любой
необратимый процесс в замкнутой системе
происходит так, что энтропия системы
при этом возрастает.
Закон
Стефана — Больцмана —
Мощность излучения абсолютно чёрного
тела прямо пропорциональна площади
поверхности и четвёртой степени
температуры тела:
P
= SεσT4,
где
ε
- степень черноты (для всех веществ ε
< 1,
для абсолютно черного тела ε
= 1).
При помощи закона Планка для излучения,
постоянную σ
можно опр как
![]()
|
Вопрос 20. Адиабатический процесс.
Адиабатическим называется процесс, при котором отсутствует теплообмен (Q=0) между системой и окружающей средой. К адиабатическим процессам можно отнести все быстропротекающие процессы. Например, адиабатическим процессом можно считать процесс распространения звука в среде, так как скорость распространения звуковой волны настолько велика, что обмен энергией между волной и средой произойти не успевает. Адиабатические процессы применяются в двигателях внутреннего сгорания (расширение и сжатие горючей смеси в цилиндрах), в холодильных установках и т. д.
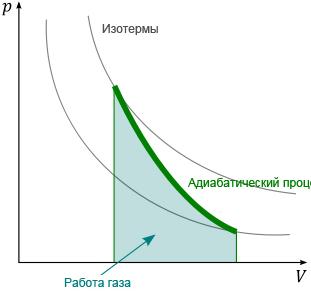
Адиабатический
процесс является частным случаем
политропного
процесса.
Адиабатические процессы обратимы,
если их проводить достаточно медленно
(квазистатически).
В общем случае адиабатический процесс
необратим.
Первое
начало термодинамики .Для
адиабатического процесса первое начало
термодинамики в силу отсутствия
теплообмена системы со средой имеет
вид![]() где:
где:
![]() -
изменение внутренней энергии тела,
-
изменение внутренней энергии тела,
![]() -
работа, совершаемая системой
Уравнение
Пуассона
Для
идеальных
газов
адиабата имеет простейший вид и
определяется уравнением:
-
работа, совершаемая системой
Уравнение
Пуассона
Для
идеальных
газов
адиабата имеет простейший вид и
определяется уравнением:
![]() где:
где:![]() —
давление
газа,
—
давление
газа,
![]() —
его объём,
—
его объём,![]() —
показатель адиабаты,
—
показатель адиабаты,
![]() и
и
![]() —
теплоёмкости
газа соответственно при постоянном
давлении и постоянном объёме.
Показатель
адиабаты
Для
нерелятивистского невырожденного
одноатомного идеального газа k = 5/3,
для двухатомного k = 7/5, для
трёхатомного k = 4/3, для газов
состоящих из более сложных молекул,
показатель адиабаты, k определяется
степенью
свободы
конкретной молекулы. При
адиабатическом процессе показатель
адиабаты равен
—
теплоёмкости
газа соответственно при постоянном
давлении и постоянном объёме.
Показатель
адиабаты
Для
нерелятивистского невырожденного
одноатомного идеального газа k = 5/3,
для двухатомного k = 7/5, для
трёхатомного k = 4/3, для газов
состоящих из более сложных молекул,
показатель адиабаты, k определяется
степенью
свободы
конкретной молекулы. При
адиабатическом процессе показатель
адиабаты равен
![]() где
R - универсальная
газовая постоянная
С
учётом уравнения
состояния идеального газа
уравнение адиабаты может быть
преобразовано к виду:
где
R - универсальная
газовая постоянная
С
учётом уравнения
состояния идеального газа
уравнение адиабаты может быть
преобразовано к виду:
![]() ,
где T — абсолютная
температура
газа. Или к виду:
,
где T — абсолютная
температура
газа. Или к виду:
![]() Поскольку k всегда больше 1, из последнего
уравнения следует, что при адиабатическом
сжатии (т.е. при уменьшении V) газ
нагревается (T возрастает), а при
расширении — охлаждается, что всегда
верно и для реальных газов.
Поскольку k всегда больше 1, из последнего
уравнения следует, что при адиабатическом
сжатии (т.е. при уменьшении V) газ
нагревается (T возрастает), а при
расширении — охлаждается, что всегда
верно и для реальных газов.
