
Давление газа на стенку сосуда Основное уравнение мкт
![]()
№37
Средняя кинетическая энергия молекул газа
![]()
Число степеней свободы молекул это число независимых переменных (координат), полностью определяющих положение системы в пространстве. В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла. Таким образом, двухатомный газ обладает пятью степенями свободы (i = 5). Трехатомная и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, находящейся в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT.
№38
Внутренняя энергия термодинамической системы.
энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц.
Внутренняя энергия для произвольной
массы т газа.
![]()
внутренняя энергия, отнесенная к одному
молю газа
![]()
№39
первое начало термодинамики: теплота,
сообщаемая системе, расходуется на
изменение ее внутренней энергии и на
совершение ею работы против внешних
сил.
![]()
или в дифференциальной форме
![]() или
или
![]()
Если система периодически возвращается
в первоначальное состояние, то изменение
ее внутренней энергии U=0.
Тогда, согласно первому началу
термодинамики,![]()
№40
Работа совершаемая при изменении объема.
Если газ, расширяясь, передвигает
поршень на бесконечно малое расстояние
dl, то производит над ним
работу![]()
где S — площадь поршня, Sdl=dV—
изменение объема системы. Таким образом,![]()
Полную работу А, совершаемую газом при
изменении его объема от V1 до V2,
найдем интегрированием формулы
![]()
№41
Связь между внутренней энергией и теплоемкостью идеального газа.
уравнение Майера:
![]() оно показывает, что Ср всегда больше СV
на величину молярной газовой постоянной.
оно показывает, что Ср всегда больше СV
на величину молярной газовой постоянной.
№42
Адиабатическим называется процесс,
при котором отсутствует теплообмен
(Q=0) между системой
и окружающей средой.
![]()
№43
Процесс, в котором теплоемкость остается постоянной, называется политропным.
уравнение
политропы:
![]()
где п=(С—Сp)/(С—СV)—показатель политропы. Очевидно, что при С=0, n=, из (55.9) получается уравнение адиабаты; при С = , n = 1 — уравнение изотермы; при С=Сp, n=0 —уравнение изобары, при С=СV, n=± — уравнение изохоры.
изохорный, изобарный, изотермический и адиабатический процессы имеют общую особенность — они происходят при постоянной теплоемкости. В первых двух процессах теплоемкости соответственно равны СV и Сp, в изотермическом процессе (dT=0) теплоемкость равна ±, в адиабатическом (Q=0) теплоемкость равна нулю.
№44
Работа, совершаемая при различных политропических процессах.
адиабатическом процессе
![]()
Если газ адиабатически расширяется от
объема V1 до V2, то его
температура уменьшается от T1
до T2 и работа расширения идеального
газа![]()
При изохорном процессе газ не совершает
работы над внешними телами
![]()
При изобарном процессе работа газа при
увеличении объема от V1 до V2
равна
![]()
работа изотермического расширения
газа: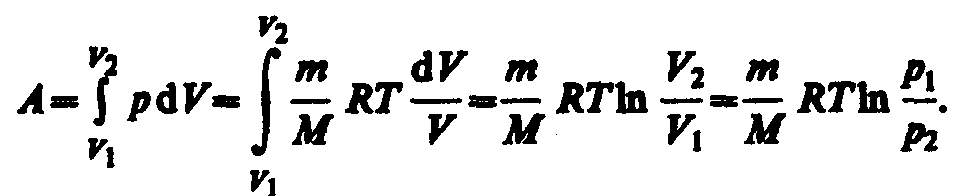
№46
Термодинамическая вероятность W
состояния системы — это число способов,
которыми может быть реализовано данное
состояние макроскопической системы,
или число микросостояний, осуществляющих
данное макросостояние (по определению,
W1, т. е. термодинамическая
вероятность не есть вероятность в
математическом смысле (последняя
1!)).
![]()
Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным, до тех пор пока вероятность состояния не станет максимальной.
Распределение максвелла. распределение молекул по скоростям
![]()
№47
барометрическая формула. Она
позволяет найти атмосферное давление
в зависимости от высоты или, измерив
давление, найти высоту
![]()
распределение Больцмана
![]()
Определение постоянной авагадро
![]()
№48
Среднее число столкновений за 1 с равно
числу молекул в объеме «ломаного»
цилиндра:
![]() где
п — концентрация молекул, V = d2
<v> <v> — средняя скорость молекулы
или путь, пройденным ею за 1 с). Таким
образом, среднее число столкновений
где
п — концентрация молекул, V = d2
<v> <v> — средняя скорость молекулы
или путь, пройденным ею за 1 с). Таким
образом, среднее число столкновений
![]()
Расчеты показывают, что при учете
движения других молекул![]()
Тогда средняя длина свободного пробега
![]()
№49
Функция состояния, дифференциалом
которой является Q/T,
называется энтропией и обозначается
S.![]()
2-е начало термодинамики.
1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу;
2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
№50
Карно вывел теорему: из всех периодически действующих тепловых машин, имеющих одинаковые температуры нагревателей (T1) и холодильников (T2), наибольшим к. п. д. обладают обратимые машины; при этом к. п. д. обратимых машин, работающих при одинаковых температурах нагревателей (T1) и холодильников (T2), равны друг другу и не зависят от природы рабочего тела, а определяются только температурами нагревателя и холодильника.
Цикл карно:
количество теплоты Q1 (полученное),
равно работе расширения
![]()
адиабатическое расширение
![]()
Количество теплоты Q2 (отданное),
равно работе сжатия.
![]()
Работа адиабатического сжатия
![]()
КПД цикла Карно
![]()
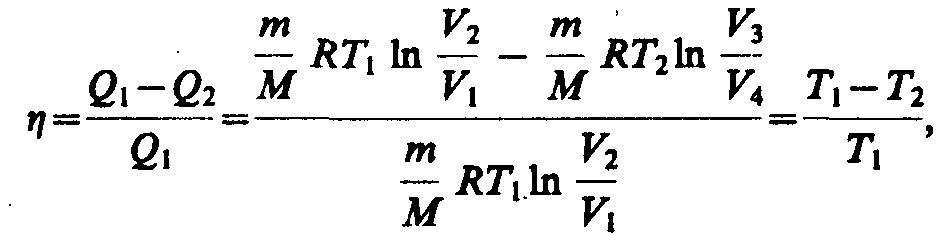
№51
Уравнение ванн-дер-ваальса
![]()
№52
Фазой называется термодинамически равновесное состояние вещества, отличающееся по физическим свойствам от других возможных равновесных состояний того же вещества
Фазовый переход I рода (например, плавление, кристаллизация и т. д.) сопровождается поглощением или выделением теплоты, называемой теплотой фазового перехода. Фазовые переходы I рода характеризуются постоянством температуры, изменениями энтропии и объема. Фазовые переходы, не связанные с поглощением или выделением теплоты и изменением объема, называются фазовыми переходами II рода. Эти переходы характеризуются постоянством объема и энтропии, но скачкообразным изменением теплоемкости.
№53
При высоких температурах (T > Tк) изотерма реального газа отличается от изотермы идеального газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Tк на изотерме имеется лишь одна точка перегиба К. Критическое состояние – состояние в котором параметры (pк, Vк, Tк) являются критическими.
Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответствует условиям равновесия двух сосуществующих фаз: КП — твердого тела и жидкости, КИ—жидкости и газа, КС—твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру Ттр и соответствующее ей равновесное давление ртр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой.
№54
поверхностное натяжение равно силе поверхностного натяжения, приходящейся на единицу длины контура, ограничивающего поверхность.
Давление под изогнутой поверхностью жидкости.
![]()
давление для произвольной поверхности
жидкости двоякой кривизны:![]()
где R1 и R2 — радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в дайной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости. Для сферической искривленной поверхности (R1=R2=R), для цилиндрической (R1=R и R2=), В случае плоской поверхности (R1=R2=).
№55
Явление изменения высоты уровня жидкости
в капиллярах называется капиллярностью.
Жидкость в капилляре поднимается или
опускается на такую высоту h, при которой
давление столба жидкости (гидростатическое
давление) gh
уравновешивается избыточным давлением
p,
![]()
№56
Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку
Поликристаллы - твердые тела имеющие мелкокристаллическую структуру, т. е. состоящие из множества беспорядочно ориентированных мелких кристаллических зерен.
Анизотропия - зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки.
Физические типы кристаллов: ионные, атомные, молекулярные, металлические.
