
- •Естествознание и его методология. Эмпирические и теоретические методы познания мира.
- •Культура. Естественно-научная и гуманитарная культуры.
- •3 Атомистическая концепция и основные этапы ее развития.
- •4 Фундаментальные взаимодействия в природе.
- •5. Концепции пространства и времени.
- •6. Начала термодинамики. Энтропия и ее статистический смысл.
- •7. Термодинамика открытых систем.
- •8. Электромагнитная теория Максвелла.
- •9. Корпускулярно-волновой дуализм света и микрочастиц
- •10. Принцип неопределенности Гейзенберга и принцип дополнительности Бора.
- •11. Общие представления о Вселенной. Модели нестационарной Вселенной.
- •12. Звезды и Галактики
- •13. Солнечная система. Происхождение и строение земли.
- •14. Гипотезы происхождения жизни.
- •15. Основные принципы эволюции жизни.
- •16. Основные уровни организации живого.
- •17. Современное представление о биосфере Земли.
- •18. Учение Вернадского о ноосфере Земли.
- •19. Самоорганизация системы и их свойства. Примеры процессов самоорганизации.
- •20. Принципы устойчивого развития. Планетарное мышление.
- •21. Универсальный эволюционизм. Путь к единой культуре.
- •Путь к единой культуре.
6. Начала термодинамики. Энтропия и ее статистический смысл.
Законы термодинамики описывают поведение так называемых макроскопических систем, т. е. тел (твёрдых, жидких или газообразных), состоящих из большого числа частиц.
В основе термодинамики лежат фундаментальные законы (начала), которые являются обобщением многочисленных наблюдений и выполняются независимо от конкретной природы образующих систему тел.
Необходимым условием термодинамического равновесия в системе является равенство значений температуры для всех частей системы.
Существование температуры – параметра, единого для всех частей системы, находящейся в термодинамическом равновесии, иногда называют нулевым началом термодинамики.
Первое начало термодинамики утверждает, что количество теплоты (тепла) dQ , сообщённое системе, идёт на увеличение её внутренней энергии dU и на совершение системой работы dA , т. е. dQ = dU + dA .
Обобщение вывода Карно на произвольные термодинамические системы позволило немецкому физику Р.Клаузиусу (1822–1888) сформулировать в 1850 году второе начало термодинамики в следующем виде: невозможен процесс, при котором теплота переходила бысамопроизвольно от тел более холодных к телам более нагретым.
Третье начало термодинамики может быть сформулировано так:
«Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».
![]()
или
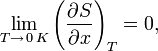
где ![]() —
любой термодинамический параметр.
—
любой термодинамический параметр.
Третье начало термодинамики относится только к равновесным состояниям.
Третье начало термодинамики позволяет находить абсолютное значение энтропии.
В 1865 году Клаузиус для определения меры необратимого рассеяния энергии ввёл в термодинамику понятие «энтропия» (от греч. entropia – поворот, превращение). Согласно Клаузиусу приращение энтропии dS при квазистатическом процессе (бесконечно медленном процессе, когда система переходит из одного состояния в другое последовательно через цепочку квазиравновесных состояний) определяется так называемой приведённой теплотой dQ /T ( dQ – малое количество теплоты, полученное системой; T – абсолютная температура): dS = dQ /T . Для необратимых процессов приращение энтропии больше приведённой теплоты, т. е. dS > dQ /T .
Энтропия определяется степенью хаоса в термодинамической системе.
Энтропия связана с «направлением времени». Время несимметрично. В 1906 году М.Планк (1858–1947), основываясь на идеях Больцмана о связи энтропии с термодинамической вероятностью, получил для энтропии следующее выражение S = k lnW (Обозначим статистический вес греческой буквой W*-дуга с завитушками*) , где k = 1,38·10 (в степени–23)Дж/К – коэффициент пропорциональности, который был рассчитан Планком и назван им постоянной Больцмана.
7. Термодинамика открытых систем.
Закрытая система - система в которой есть обмен только с энергией .
Открытая система - это система , которая
обменивается и энергией , и веществом , и информацией .
Существует особый класс термодинамических систем – открытые системы – в которых возникают локальные условия для появления упорядоченности. Открытые системы ещё называют потоковыми – в них действительно существует поток как некоторая математическая абстракция, но ничто не мешает нам представить её в виде вещественного потока некоторой материи или энергии.
При определённых условиях энтропия системы может, увеличиваться, оставаться неизменной или в отличие от изолированных систем даже уменьшаться. анализ поведения энтропии в открытой системе показал, что в отличие от изолированной системы, энтропия неизолированной системы может уменьшаться.
Если dS окруж. Среды. <0, тогда dSсистемы >0. (Перетекание энтропии из окруж среды в систему)
Если dS окруж. среды=0:
dS системы = 0 –равновесное состояние окруж. среды и системы
dS системы >0 – не имеет физ. Смысла
Если dS окруж.среды >0:
1-dSсистемы<0 –в системе протекают процессы структурирования
2-dS системы >0 –в системе, как и в окруж. среде преобладают диссимативные процессы.
3-dS сист=0 – не имеет физ. смысла
