
Водородный показатель и рН
1.
Ионное
произведение  чистой воды при 250С
равняется
чистой воды при 250С
равняется
А) + 10-14
В) 10-7
С) 10+7
Д) 1014
Е) 14
2. Концентрация ионов [H+] в чистой воде при 250С составляет (моль/л)
А) 10-14
В) + 10-7
С) 10+7
Д) 101
Е) 7
3. Концентрация ионов [ОH-] в чистой воде при 250С составляет (моль/л)
А) 10-14
В) + 10-7
С) 7
Д) 101
Е) 107
4. Концентрацию ионов водорода в растворе сильной одноосновной кислоты можно рассчитать по формуле
А) + [H+] = Cк-ты
В) [H+] = Cк-ты – [OH-]
C)
[H+]
= 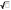 Кк-ты
Ск-ты
Кк-ты
Ск-ты
Д) [H+] = 14 – [OH-]
Е) [H+] = [OH-]
5. Для нейтрального раствора верно
А) + [H+] = [OH-]
В) [H+] = 14 – [OH-]
С) [H+] < [OH-]
Д) [H+] [OH-]=14
Е) [H+] > [OH-].
3. [H+] < [OH-] в растворе
А) + NaOH
B) KCI
C) HCI
Д) CH3COOH
E) H3PO4
6. [H+] > [OH-]
A) NaOH
B) KOH
C) + HCI
Д) KCI
E) NH4OH
7. Если Сн+ = 10-4, то Сон- равно
А) 14
В) 10-14
С) 10-7
Д) + 10-10
Е) 10-4
8. Водородным показателем рН называют величину, численно равную
А) – ln Cн+
В) + - lg Cн+
C) lg Cн+
Д) ln Cн+
Е) – logB C
9. Для разбавленных водных растворов сумма рН и рОН равна
А) 10-14
В) 10-7
С) 1
Д) 7
Е) + 14
10.Гидроксильным показателем рОН называют величину, численно равную
А) – ln Cн+
В) + - lg Cон-
C) lg Cн+
Д) -ln Cон-
Е) lg Cон-
11. В нейтральном растворе
А [H+] > 10-7
В) [H+] <10-7
C) + [H+] = 10-7
Д) pH = 14
E) pH = 1
12. Смещение реакции среды в организме в кислую сторону называется
А)+ ацидозом
В) алкалозом
С) гидролизом
Д) нейтрализацией
Е) обменом
13. Смещение реакции среды в организме в щелочную сторону называется
А ацидозом
В) + алкалозом
С) гидролизом
Д) нейтрализацией
Е) обменом
14. рН крови человека в норме равно:
А) 5,5
В) 3,6
С) 0,9 – 2,0
Д) 14
Е) + 7,36 – 7,40
15. Ионную силу раствора можно рассчитать по формуле
А) I = ∑Ci ∙ Zi
B) I = 1/2∑Ci ∙ Zi
C) I = 1/2∑Ci2 ∙ Z
Д) I = ∑Ci ∙ Zi2
E) + I = 1/2∑Ci ∙ Zi2
16. Какова реакция среды, если рОН = 13?
А) + кислая
В) щелочная
С) слабощелочная
Д) слабокислая
Е) нейтральная
17. Вычислите рН раствора гидроксида натрия с СNaOH = 0,001моль/л
А) 10-2
В) 2
С) 9
Д) + 11
Е)10-12
18. Для раствора гидроксида натрия с молярной концентрацией эквивалента 0,1 моль/л:
А) рН = 1
В) + рН = 13
С) рОН = 5
Д) рОН = 13
Е) рН= рОН = 7
19. Для раствора HCI с концентрацией 0,1 моль/л верно утверждение:
А) [H+] = [OH-]
В) [H+]< [OH-]
C) + pH = 1
Д) pOH = 1
E) [H+] = 10-13
20.Концентрацию ионов водорода по формуле [H+] = Ск-ты можно рассчитать для растворов
А)+ НNO3
B) H2CO3
C) H2SO3
Д) CH3COOH
E) C2H5 COOH
21.Концентрацию ионов гидроксида по формуле [ОH+] = Сосн-я можно рассчитать для растворов
А+NaOH
B) H2CO3
C) H2SO3
Д) CH3COOH
E) C2H5 COOH
22. Для кислых растворов при 250С
А) рН = 7
В) рН > 7
C) [H+] = 7
Д) [H+] < 10-7
E) + [OH-] < 10-7
23. [H+] > [OH-] в растворах
А) NaOH
B) KOH
C) NaCI
Д) + CH3COOH
E) NH4OH.
24. Выберите самую сильную кислоту, зная ее константу диссоциации :
A)+ K (HNO2) = 5.1· 10- 4.
B) K (HBrO) = 2.5·10- 9.
C) K (HIO3) = 1.6· 10- 1.
D) K (HIO) = 2.3·10- 11.
E) K (HN) = 6.5 · 10- 10.
25. Выберите самую слабую кислоту, зная ее константу диссоциации:
A) K (HNO2) = 5.1· 10- 4.
B) K (HBrO) = 2.5·10- 9.
C) K (HIO3) = 1.6· 10- 1.
D)+ K (HIO) = 2.3·10- 11.
E) K (HN) = 6.5 · 10- 10.
26. Концентрацию ионов водорода в растворе слабой одноосновной кислоты можно рассчитать по формуле:
A) [H+ ] = ca.
B) + [H+ ] = ca* α.
C)
[H+
] =
 .
.
D) [H+ ] = [ОH-] = 10-7.
E) [H+ ] = - lg[ОH-].
27. Концентрацию ионов гидроксида в растворе слабого однокислотного основания можно рассчитать по формуле:
A) [H+ ] = ca.
B)+ [H+ ] = ca* α.
C) [H+ ] = .
D) [H+ ] = [ОH-] = 10-7.
E) [H+ ] = - lg[ОH-].
28. Концентрацию гидроксид-ионов в растворе слабого однокислотного основания можно рассчитать по формуле:
A) [ОН-] = Cосн
B) +[ОН-] = *
C)
[ОН-]
= √ 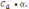
D) [ОН-] = 14 - [H+]7
E)
[ОН-]
=
 .
.
29. Суть протолитических реакций заключается в:
A) изменении числа связей в молекулах реагентов.
B) + переносе протона от одной частицы к другой.
C) переносе электронных пар, приводящих к образованию или разрушению
комплексных соединений.
D) переносе электронов от одной частицы к другой.
E) переносе отрицательных частиц от одного реагента к другому.
30. Какая из приведенных частиц согласно протолитической теории играет роль только основания:
A) NH4+.
B) H2O.
C) HSO4-.
D) H2SO3.
E)+ OH-.
31. Какая из приведенных частиц согласно протолитической теории играет роль только кислоты:
A) OH-.
B) H2O.
C) Cl-.
D) NH3.
E)+ NH4+.
32. Какая из приведенных частиц согласно протолитической теории играет роль амфолита:
A) OH-.
B) +H2O.
C) Cl-.
D) NH3.
E) NH4+.
33. Какое из уравнении соответствует закону разбавления Оствальда?
А)+ (Cα2)/(1-α).
В) (C2-α)(1-α).
С) (1-α)/C2α.
D) (1-α)/(Cα2).
E) 1/(C2α).
34. Закон действующих масс, используемый в химии, применим для:
А) растворов слабых электролитов.
В) концентрированных растворов слабых электролитов.
C)+ разбавленных водных растворов слабых электролитов. +
D) разбавленных водных растворов сильных электролитов.
E) любых водных растворов.
35. Выберите формулу характеризующую константу диссоциации слабых электролитов:
А) + К = Cα2/(1-α).
В) K = (1-α)/Cα2.
С) K = α2/C(1-α).
D) слабые электролиты констант диссоциации не имеют.
E) слабые электролиты полностью распадаются на ионы.
Буферные растворы
1. Кислотный буфер состоит из
А) + слабой кислоты и соли слабой кислоты, образованной сильным основанием
В) сильного основания
С) сильной кислоты
Д) сильной кислоты и соли сильной кислоты, образованной сильным основанием
Е) слабого основания и соли, образованной слабой кислотой и слабым основанием
2. Основный буфер состоит из
А) слабой кислоты и соли слабой кислоты, образованной сильным основанием
В) + слабого основания и соли сильной кислоты, образованной слабым основанием
С) сильной кислоты и соли сильной кислоты, образованной сильным основанием
Д) слабого основания и соли, образованной слабой кислотой и слабым основанием
Е) соли слабой кислоты, образованной сильным основанием
3. Укажите основный буферный раствор
А) NaН2 PO4 и Nа2 HPO4
В) Pt-COOH, Pt-COONa
C) + NH4OH, NH4CI
Д) H2CO3, NaHCO3
E) CH3COOH, CH3COONa
4. Укажите уравнение Гендерсон- Гассельбаха для рассчета рН основного буферного раствора:
A) pH = - lgCH+.
B)
+ pH = 14 - pKb
+
lg

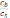 .
.
C) pH = 14 - pOH.
D)
pH =  p
p -
-  lg
lg .
.
E)
pH
= 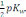 -
-  p
p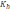 -
lg
-
lg .
.
5. Укажите уравнение Гендерсон- Гассельбаха для рассчета рН кислотного буферного раствора:
A)
pH
=
-
lg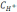 .
.
B)
+ pH
=
p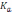 - lg
- lg  .
.
C)
pH
=
 -
-  .
.
D)
pH
=
-  -
-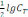 .
.
E)
pH
=14
+ lg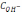 .
.
6. При добавлении небольшого количества NaОН к ацетатному буферу с ним будет взаимодействовать:
A) CH3COONa.
B)+ CH3COOН.
C) CH2 ClCOONa.
D) CH2 ClCOOH.
E) CHCl2COONa.
7. При добавлении небольшого количества НCl к ацетатному буферу с ним будет взаимодействовать:
A)+ CH3COONa.
B) CH3COOН.
C) CH2 ClCOONa.
D) CH2 ClCOOH.
E) CHCl2COONa.
8. При добавлении небольшого количества NaОН к аммиачному буферу с ним будет взаимодействовать:
A) + NН4Cl.
B) NН4ОН.
C) NН4NО3.
D) NН4Br.
E) NН4NО2.
9. При добавлении небольшого количества НCl к аммиачному буферу с ним будет взаимодействовать:
A) NН4Cl.
B)+ NН4ОН.
C) NН4NО3.
D) NН4Br.
E) NН4NО2.
10. Для поддержания рН среды равным 4,7 применяют буферную систему:
A) + ацетатный.
B) аммиачный.
C) формиатный.
D) гидрокарбонатный.
E) фосфатный.
11. Для поддержания в водном растворе значения рН = 9 пригодна буферная система:
A) ацетатный.
B) +аммиачный.
C) формиатный.
D) гидрокарбонатный.
E) фосфатный.
12. Концентрацию ионов водорода в ацетатном буферном растворе можно рассчитать по уравнению
CaVa
A) + [H+] = Ka -------------
Cs Vs
Cs Vs
B) [H+] = Ka -------------
CаVа
CаVа
С) [H+] = Ka + -------------
CsVs
CsVs
Д) [H+] = Ka + -------------
CaVa
CаVа
Е) [H+] = рKa + -------------
CsVs
13. В состав аммиачного буферного раствора входят соединения:
А) NH4NO3 и (NH4)2SO4
B) (NH4)2СO3 и NH4CI
C) + NH4CI и NH4OH.
Д) (NH4)2SO4
Е) NH4OH и НСI.
14. Укажите уравнение Гендерсон- Гассельбаха для рассчета рН аммиачной буферной системы:
A) pH = - lg CH+.
B)+
 +
+
 .
.
C)
Д)
pH =
 -
-
 -
-
 .
.
E ) pH = 14 + lg COH-.
15. Укажите уравнение Гендерсон- Гассельбаха для рассчета рН основной буферной системы:
A) pH = - lgCH+.
B) + pH = 14 - pKb + lg .
C) pH = 14 - pOH.
D) pH = p - lg .
E) pH = - p - lg .
16. Укажите уравнение Гендерсон- Гассельбаха для рассчета рН кислотного буферного раствора:
A)
pH
=
-
lg
 .
.
B)+ pH = p - lg .
C)
pH
=
 -
-
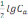 .
.
D) pH = - - .
E) pH =14 + lg .
17. Концентрацию ионов водорода в ацетатном буферном растворе можно рассчитать по уравнению:
А)

В)
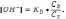
С)
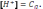
D)

Е)
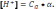
18.
Концентрацию ионов [ 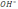 ]
в аммиачном
буферном растворе можно рассчитать по
уравнению:
]
в аммиачном
буферном растворе можно рассчитать по
уравнению:
А)
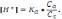
В)+
С)
D)
Е)
19.Осадок образуется, если величина:
А) ИП = Ks.
В)+ ИП > Ks.
С) ИП < Ks.
D) ИП ≤ Ks.
E) Нет закономерности.
20. Раствор пересыщен, если величина:
A) ИП = Ks.
B)+ ИП > Ks.
C) ИП < Ks.
D) ИП ≤ Ks.
E) Добавлена вода.
21. Раствор не насыщен, если величина:
A) ИП = Ks.
B)+ ИП < Ks.
C) ИП > Ks.
D) ИП ≥ Ks.
22. Для реакции протекающей в растворе аА+вВ ↔ dД + еЕ константа скорости имеет вид:
А)+
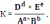
B)

C)


D)
E)

23. Произведение растворимости для соединения AmBn образующегося по уравнению
mA+ nB ↔ Am*Bn описывается выражением:
A)
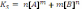
B)+
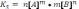 .
.
C)
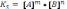 .
.
D)
 .
.
E)
 .
.
24. Для реакции Mg(OH)2 ↔ Mg2++2OH- выражением величины KS является:
А) Ks ≤ [Mg2+]* [OH-]2.
В) [Mg2+] = [OH-]2.
С) Ks = [Mg2+]*[OH-].
D) + Ks = [Mg2+]* [OH-]2.
E) Ks ≥ [Mg2+]* [OH-]2.
25. Вычислите растворимость AgCl (моль/л), если ПРAgCl = 10-10
А) 10-10 моль/л
В) 10-7 моль/л
С)+ 10-5 моль/л.
D) 10-3 моль/л
E) моль/л
26. Вычислите произведение растворимости AgCI, если растворимость этой соли равна 10-5 моль/л
А) 5*10-15
В) 10-15
С) 5*10-13
D) +10-10
E) 5*10-5
27. Вычислите произведение растворимости Ks(AgI), если растворимость этой соли равна 10-8:
А) +10-16.
В) 5*10-8
С) 10-7
D) 5*10-4
E) 2,5*10-10
28.Вычеслите растворимость BaSO4 (моль/л),если Ks(BaSO4) = 1*10-10
А) 10-10
В) 10-8
C) +10-5.
D) 10-3
E) 10-2
29. Для реакции Ca3(PO4)2 ↔ 2Ca2+ + 3PO43- выражением величины KS является:
А) Ks = [Ca2+]3+[PO43- ]2.
В) Ks = [Ca2+]+[PO43- ].
С) Ks = [Ca2+]*[PO43- ].
D)+ Ks = [Ca2+]3*[PO43- ]2.
E) Ks = [Ca2+]2*[PO43-]3.
