
Химическая кинетика
1. Химическая кинетика изучает:
А) + скорость и механизм протекания химических реакций
В) закономерности превращения химической энергии в тепловую
С) закономерности превращения химической энергии в кинетическую
Д) тепловой эффект химической реакции
Е) изменение рН раствора во время химической реакции
2. Скорость химической реакции – это:
А) + изменение концентрации реагирующих веществ в единицу времени
В) число молекул, принимающих участие в элементарном акте химической реакции
С) число молекул субстрата, превращающихся под действием одной молекулы
фермента
Д) сумма показателей степеней в кинетическом уравнении реакции
Е) изменение концентрации катализатора в единицу времени
3. Скорость гомогенной химической реакции это:
А) число молекул, принимающих участие в элементарном акте химической
реакции
В)+ число молекул, реагирующих в единицу времени в единице объема
С) число молекул, реагирующих в единицу времени на единице площади
Д) сумма показателей степеней в кинетическом уравнении реакции
Е) изменение концентрации катализатора в единицу времени.
4. Зависимость константы скорости химической реакции от температуры количественно может быть описана:
А) правилом Вант-Гоффа
В) + законом действующих масс
С) уравнением Аррениуса
Д) уравнением Михаэлиса-Ментен
Е) уравнением Гендерсона-Гассельбаха
5. Скорость прямой реакции 2NO + O2 = 2NO2 можно рассчитать по уравнению:
А) w = [NO]2 + [O2]
B) w =2[NO] [ O2]
C) w =2[NO2]2
D) w = k[NO][ O2]
E) + w = k[NO]2 [O2]
6. Скорость обратной реакции 2NO + O2 = 2NO2 можно рассчитать по уравнению:
А) w =[NO2]2
В) w =2[NO2]
С)+ w =k[NO2]2
Д) w = k[NO][ O2]
E) w = k[NO]2 [O2]
7. Выражение для скорости реакции А + В + В→ АВ2:
А) w = k[B][B]
В) w = k[A][B]
С)+ w =k[A][B]2
Д) w = k[AB2]
E) w = k[A][B2]
8. Влияние концентрации реагирующих веществ на скорость химической реакции количественно выражается
А) правилом Вант-Гоффа
В) + законом действующих масс
С) уравнением Аррениуса
Д) уравнением Михаэлиса-Ментен
Е) уравнением Гендерсона-Гассельбаха
9. Особенностями каталитического действия ферментов являются:
А) невысокая каталитическая активность
В) независимость каталитического действия от температуры
С) независимость каталитического действия от рН
Д) + высокая специфичность действия
Е) отсутствие температурного оптимума действия
10. Уравнение v = k• c2 соответствует реакциям:
А) нулевого порядка
В) первого порядка
С) третьего порядка
Д)+ второго порядка
Е) дробного порядка
11. Скорость реакции первого порядка описывается уравнением:
А) v = k/
B) v = dc/dt
C) + v = k•c
D) v = k ∙c2
E) v = kca cb
12. Биологическими катализаторами являются:
А) аминокислоты
В) полисахариды
С) липиды
Д)+ ферменты
Е) углеводы
13. Функция ферментов в живом организме заключается в:
А) транспорте оксигенов
В) + катализе биохимических реакций
С) обеспечении иммунитета
Д) обеспечении энергией
Е) перенесении кислорода к тканям и органам
14. Скорость гетерогенной реакции представляет собой:
А) число молекул, реагирующих в единицу времени в единице объема
В) + число молекул, реагирующих в единицу времени на единице площади поверхности
С) число молекул, принимающих участие в элементарном акте химической реакции
Д) число молекул субстрата, превращающихся под действием одной молекулы фермента
Е) число, равное сумме показателей степеней при концентрациях
15. Истинная скорость реакции определяется по соотношению:
А) – (С2-С1)/(t2 - t1)
B) ∆C /∆t
C) (C2- C1)/ (t2 - t1)
D) -∆C /∆ t
E) + +dC/dt
16. Выберите единицы измерения скорости гомогенной реакции:
А) + моль/(л∙с)
В) моль/(м2∙ с)
С) л/(моль ∙с)
Д) м2/(моль ∙с)
Е) моль/м2
17. Укажите реакцию, для которой w= kC(O2)
А)+ 2C(т) + О2(г)→2СО2
В) СО(г)+ О2(г) →2СО2(г)
С) 2SO2(г)+ О2(г) →2SO3(г)
Д) N2(г) + O2(г) →NO(г)
Е) O2(г)+ 2H2(г) →2Н2О(ж)
18. Укажите бимолекулярную (двумолекулярную) реакцию:
А) + H2 + J2 → 2HJ
B) J2→2 J
C) H2→2H
D) NH4CI→ NH3+ HCI/
E) NH4CNS → (NH2)2CS
19. Формулировка «при повышении температуры на 10 градусов скорость большинства реакций увеличивается в 2-4 раза» соответствует правилу:
А) Дюкло-Траубе
В) + Вант-Гоффа
С) Шульце-Гарди
Д) Панета-Фаянса
Е) Пригожина
20. Скорость реакции возрастает в присутствии катализатора. Действие катализатора состоит в том, что он:
А) уменьшает скорость прямой реакции
В) уменьшает скорость обратной реакции
С) + направляет реакцию по другому пути, который характеризуется более низкой энергией активации
Д) направляет реакцию по другому пути, который характеризуется более высокой энергией активации
Е) влияет на истинное равновесие
21. Как изменится скорость прямой химической реакции СаСО3(т)=СаО(т) + СО2(г),
если давление в системе увеличить в 5 раз?
А) увеличится в 5 раз
В) уменьшится в 25 раз
С) уменьшится в 5 раз
Д) увеличится в 25 раз
Е) + не изменится
22. Выражение закона действующих масс для скорости прямой реакции
аА + bB↔cC + dD имеет вид:
А) w = k CA CB
B) w = k (CAa + CBb)
C) + w = k CAa CBb
D) w = k CCc CDd
E) w = k (CCc + CDd)
23. Тримолекулярной является реакция:
А) H2 + J2 = 2HJ
В) J2 = 2 J
С) + 2NO + O2 = 2NO2
Д) CO + CI2 = COCI2
E) Ca(HCO3)2↔H2O + CO2 + CaO
24. Выражение константы равновесия для реакции 2NO(г) + CI2(г)→ 2NOCI(г) имеет вид
А) + K = C2(NOCI)/C2(NO) C(CI2)
B) K = C2(NO) C(CI2)
C) K = C2(NO) C(CI2)/ C2 (NOCI)
D) K = C2(NOCI)/C2(NO) + C(CI2)
E) K = C2(NO) + C(CI2)/ C2 (NOCI)
25. Выражение закона действующих масс для прямой реакции
СаСО3(т)→ СО2(г) + СаО(т) имеет вид:
А) w = k C(СаСО3)
B) w = k С(СаО) С(СО2)
C) + w = k
D) w = k С(СаО) + С(СО2)
E) w = k С(СО2)
26. Сумма показателей степеней в уравнении типа w = k CAa CBb представляет собой:
А) молекулярность реакции
В) число молекул, принимающих участие в элементарном акте химической реакции
С) + порядок реакции
Д) скорость реакции
Е) константу скорости реакции
27. Число молекул, принимающих участие в элементарном акте химической реакции, называется:
А) + молекулярностью реакции
В) порядком реакции
С) скоростью реакции
Д) константой скорости реакции
Е) температурным коэффициентом реакции
28. Зависимость скорости химической реакции от температуры количественно может быть описана:
А) законом Лавуазье -Лапласа
В) законом действующих масс
С) + уравнением Аррениуса
Д) уравнением Михаэлиса-Ментен
Е) уравнением Гендерсона- Гассельбаха.
29. В соответствии с эмпирическим правилом Вант-Гоффа при повышении температуры реакционной смеси от 30о до 40оС скорость химической реакции:
А) увеличится в 22,4 раза
В) уменьшится в 10 раз
С) + увеличится в 2-4 раза
Д) достигнет своего максимального значения
Е) увеличится в 8 раз
30. Выберите положения, характеризующие явления катализа:
А) катализатор расходуется в процессе протекания химической реакции
В) + катализатор не смещает положения равновесия химической реакции
С) после окончания реакции количество катализатора уменьшается в 2 раза
Д) катализатор ускоряет только прямую реакцию
Е) катализатор ускоряет только обратную реакцию
31. В выражении γ = (Кt + 10) величина γ называется…
А) изотоническим коэффициентом
В) координационным числом
С) + температурным коэффициентом скорости реакции
Д) фактором эквивалентности
Е) степенью диссоциации
32. При повышении температуры:
А) Скорость экзотермических реакций возрастает, а эндотермических – уменьшается.
В)+ Скорость экзотермических реакций уменьшается, а эндотермических – возрастает.
С) Скорость экзотермических реакций и эндотермических реакций не изменяется.
D) Уменьшается скорость как экзо-, так и эндотермических реакций.
Е) Возрастает скорость как экзо-, так и эндотермических реакций.
Растворы. Концентрация
1. Реальная или условная частица вещества Х, эквивалентная одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции, называется
А)+ эквивалент
В) фактор эквивалентности
С) молярная масса эквивалента
D) количество вещества эквивалента
Е) мольная доля
2. Число, показывающее, какая доля частицы вещества Х, эквивалентна одному иону водорода в данной кислотно-основной реакции или одному электрону в данной окислительно-восстановительной реакции, называется
А) эквивалент
В)+ фактор эквивалентности
С) молярная масса эквивалента
D) количество вещества эквивалента
Е) мольная доля
3. Фактор эквивалентности данной кислотно-основной реакции показывает, какая доля частицы вещества Х эквивалентна
А) всем электронам, участвующим в реакции
В) одному электрону
С) всем ионам водорода, участвующим в реакции
D) + одному иону водорода
Е) сумме электронов и ионов водорода.
4. Фактор эквивалентности данной окислительно-восстановительной реакции показывает, какая доля частицы Х эквивалентна
А) всем электронам, участвующим в реакции
В)+ одному электрону
С) всем ионам водорода, участвующим в реакции
D) одному иону водорода
Е) сумме электронов и ионов водорода
5.
По отношению
 можно рассчитать величину фактора
эквивалентности
можно рассчитать величину фактора
эквивалентности
А) для кислот
В) для оснований
С) для солей
D) веществ, участвующих в кислотно-основных реакциях
Е) + веществ, участвующих в окислительно-восстановительных реакциях
6.
По отношению
 можно рассчитать величину фактора
эквивалентности
можно рассчитать величину фактора
эквивалентности
А)+ для кислот.
В) для оснований
С) для солей
D) для оксидов
Е) веществ, участвующих в окислительно-восстановительных реакциях.
7.
По отношению
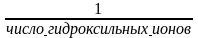 можно рассчитать величину фактора
эквивалентности
можно рассчитать величину фактора
эквивалентности
А) для кислот.
В) + для оснований.
С) для солей
D) для оксидов
Е) веществ, участвующих в окислительно-восстановительных реакциях.
8.
По отношению
 можно рассчитать величину фактора
эквивалентности
можно рассчитать величину фактора
эквивалентности
А) для кислот
В) для оснований
С) + для солей.
D) веществ, участвующих в кислотно-основных реакциях
Е) веществ, участвующих в окислительно-восстановительных реакциях.
9. г/моль - это единица измерения величин
А)+ молярная масса
В) молярная концентрация
С) молярная масса эквивалента
D) молярная концентрация эквивалента
Е) моляльная концентрация
10. моль/л - это единица измерения величин
А) молярная масса
В) + молярная концентрация
С) молярная масса эквивалента
D) молярная концентрация эквивалента
Е) моляльная концентрация
11. Молярная масса Ca(OH)2 равна 74 г/моль. Молярная масса эквивалента Ca(OH)2 будет равна (г/моль)
А) 74
В) 60
С) 40
D) + 37
Е) 34
12. Молярная масса CaSO4 равна 136 г/моль. Молярная масса эквивалента CaSO4 будет равна (г/моль)
А) 272
В) 136
С) 96
D) + 68
Е) 40
13. Молярная масса эквивалента NaOH равна 40 г/моль. Молярная масса NaOH будет равна (г/моль)
А) 120
В) 80
С) + 40
D) 20
Е) 10
14. Молярная масса эквивалента Al(OH)3 равна 26 г/моль. Молярная масса Al(OH)3 будет равна (г/моль)
А) 130.
В) + 78.
С) 39.
D) 26.
Е) 13.
15. Фактор эквивалентности f э = 1 для вещества
А) Na2SO4
В) + NaNO3
С) CaCI2
Д) Na2CO3
E) Na3PO4
16. Фактор эквивалентности f э = 1/2 для вещества
А) + Na2SO4
В) NaNO3
С) NaCI
Д) NaBr
E) Na3PO4
17. Фактор эквивалентности f э = 1/3 для вещества
А) Na2CO3
В) + Na3PO4
С) NaNO3
Д) Ca(OH)2
Е) Al2(SO4)3
18. Фактор эквивалентности f э = 1/6 для вещества
A) Al(OH)3
В) Na3PO4
C) + Al2(SO4)3
Д) CaCI2
E) Mg(NO3)2.
19. Укажите группу веществ, имеющих одинаковое значение фактора эквивалентности:
А) KCI, Ca(OH)2, H2SO4
B) Al(OH)3,H2CO3, NaBr
C) + AlJ3, Fe(OH)3,CrCI3
Д) Cr(OH)3, FeSO4, HCI
E) KCI, Al(OH)3, FeSO4
20. Моль/кг – это единица измерения
А) молярной концентрации
В) молярной концентрации эквивалента
С) + моляльной концентрации
Д) массовой доли
Е) мольной доли.
21. Моль/л – это единица измерения
А) + молярной концентрации
В ) объемной доли
С) моляльной концентрации
Д) массовой доли
Е) мольной доли.
22. Единицы измерения массовой доли
А) моль/л
В) г/мл
С) + %
Д) кг
Е) моль/кг.
23. Отношение массы растворенного вещества к массе раствора характеризует
А) молярную концентрацию
В) молярную концентрацию эквивалента
С) + массовую долю
Д) мольную долю
Е) моляльную концентрацию.
24. Отношение количества растворенного вещества к объему раствора характеризует
А) + молярную концентрацию
В) молярную концентрацию эквивалента
С) массовую долю
Д) мольную долю
Е) моляльную концентрацию
25. Отношение количества вещества эквивалента растворенного вещества к объему раствора характеризует
А) молярную концентрацию
В) + молярную концентрацию эквивалента
С) массовую долю
Д) мольную долю.
Е) моляльную концентрацию
26. Отношение количества растворенного вещества к массе растворителя называется
А) молярной концентрацией
В) молярной концентрацией эквивалента
С) массовой долей
Д) мольной долей
Е)+ моляльной концентрацией
27. Выберите формулу для расчета молярной концентрации
m(х)
А) ώ = --------------100%
m(p-pa)
m(х)
В) + ώ = -------------------
M (х) V(p-pa)
m(х)
С) Сэ(х) = -----------------
M э(х) V(p-pa)
m(х)
Д) ώ = ------------------- 100%
V(p-pa) р (р-ра)
nэ (х)
Е) Cэ(х) = --------------
V (p-pa)
28. Выберите формулу для расчета молярной концентрации эквивалента
m(х)
А) ώ = --------------100%
m(p-pa)
m(х)
B) С(х) = -----------------
M (х) V(p-pa)
m(х)
С) + Сэ(х) = -----------------
M э(х) V(p-pa)
n(х)
Д) C(х) = --------------
V (p-pa)
m(х)
Е) ώ = ------------------- 100%
V(p-pa) р (р-ра)
29. Молярная концентрация эквивалента рассчитывается по формуле
m(х)
А) ώ = --------------100%
m(p-pa)
m(х)
В) ώ = ---------------------- 100%
V(p-pa) р (р-ра)
m(p-pa)
C) ώ = ------------- 100%
m(х)
n(х)
Д) C(х) = --------------
V (p-pa)
nэ(х)
Е) + Cэ(х) = --------------
V (p-pa)
30. Выберите верную формулу для расчета массовой доли
nэ(х)
А) Cэ(х) = --------------
V (p-pa)
m(p-pa)
В) ώ = ------------- 100%
m(х)
n(х)
С) C(х) = --------------
V (p-pa)
m(х)
Д) + ώ = --------------------- 100%
m(х)+ m(p-ля)
m(х)
Е) ώ = --------------------- 100%
m(х) m(p-ля)
31. Отношение массы растворенного вещества к массе раствора характеризует
А) молярную концентрацию
В) молярную концентрацию эквивалента
С) + массовую долю
Д) мольную долю
Е) моляльную концентрацию.
32. Отношение количества растворенного вещества к объему раствора характеризует
А) + молярную концентрацию
В) молярную концентрацию эквивалента
С) массовую долю
Д) мольную долю
Е) моляльную концентрацию
33. Отношение количества вещества эквивалента растворенного вещества к объему раствора характеризует
А) молярную концентрацию
В) + молярную концентрацию эквивалента
С) массовую долю
Д) мольную долю
Е) моляльную концентрацию.
34. Отношение количества растворенного вещества к массе растворителя называется
А) молярной концентрацией
В) молярной концентрацией эквивалента
С) массовой долей
Д) мольной долей
Е)+ моляльной концентрацией
35. В 1 литре содержится 3,65 г хлороводорода. Молярная концентрация этого раствора равна
А) 1 моль/л
В) 0,5 моль/л
С) + 0,1 моль/л
Д) 0,05 моль/л
Е) 0,01 моль/л.
36. В 1 литре содержится 4,00г гидроксида натрия; молярная концентрация этого раствора равна
А) 1 моль/л
В) 0,5 моль/л
С) + 0,1 моль/л
Д) 0,05 моль/л
Е) 0,01 моль/.
37.В 182 г воды растворили 0,1 моль глюкозы. Какова массовая доля глюкозы в растворе?
А) 009
В)+ 098
С) 18%
Д) 05 моль/л
Е) 9%.
38. Математическое выражение закона эквивалентов:
А)

В)
+ 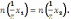
С)
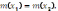
D)
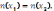
Е)

39. Математическое выражение следствия закона эквивалентов:
А)
+ 
B)
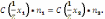
C)
D)
Е)
40.По
соотношению 
 рассчитывают:
рассчитывают:
А) массовую долю раствореннго вещества.
В) молярную концентрацию эквивалента.
С) + молярную концентрацию.
D) моляльную .
Е) мольную долю.
41.
По соотношению 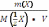 рассчитывают:
рассчитывают:
А) массовую долю раствореннго вещества.
В) + молярную концентрацию эквивалента.
С) молярную концентрацию.
D) моляльную .
Е) мольную долю.
42.
По сотношению 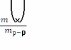 рассчитывает концентрацию:
рассчитывает концентрацию:
А) + массовую долю раствореннго вещества.
В) молярную концентрацию эквивалента.
С) молярную.
D) молялную .
Е) мольную долю.
43. По соотношению рассчитывают:
А) массовую долю раствореннго вещества.
В) молярную концентрацию эквивалента.
С) молярную.
D) + моляльную .
Е) мольную долю.
44.
Эквивалентная молярная концентрация
равна молярной концентрации в
соединении

 :
:
A)+ HCl.
B) Na2СO3.
C) К2SO4.
D) Са(NO3)2.
E) H3PO4.
45. Эквивалентная молярная концентрация больше молярной концентрации в соединении

 :
:
A) HCl.
B) NaCl.
C) NaOH.
D) KNO3.
E)+ H3PO4.
Коллигативные свойства
1.Выберите раствор, гипертонический по отношению к плазме крови:
А) 0,1%- ный раствор NaCI
В) +10%- ный раствор NaCI
С) 0,15 М раствор NaCI
Д) 0,9%- ный раствор NaCI
Е) 0,01 М раствор NaCI
2. Выберите раствор, изотонический по отношению к плазме крови
А) 1 М раствор NaCI
В) 10%- ный раствор NaCI
С) 0,01% раствор NaCI
Д) + 0,9%- ный раствор NaCI
Е) 0,01 М раствор NaCI
3. Выберите раствор, гипотонический по отношению к плазме крови
А) 1 М раствор NaCI
В) 10%- ный раствор NaCI
С) 0,15 М раствор NaCI
Д) 0,9%- ный раствор NaCI
Е) + 0,01 % раствор NaCI
4. Упругость клеток, обеспечивающая эластичность и сохранение определенной формы органов, обусловленная осмотическим давлением, называется
А) лизисом
В)+ тургором
С) гемолизом
Д) плазмолизом
Е) деплазмолизом
5. Набухание и разрыв оболочек эритроцитов в гипотоническом растворе называется
А) диализ
В) тургором
С) + гемолизом
Д) плазмолизом
Е) деплазмолизом.
6.Сжатие, сморщивание клеток в гипертонической среде называется
А) лизисом
В) тургором
С) гемолизом
Д) + плазмолизом
Е) деплазмолизом
7.Для внутривенных инъекций обычно используются растворы:
А) пересыщенные
В) гипертонические
С) + изотонические
Д) гипотонические
Е) насыщенные
8.Закон Вант-Гоффа описывает зависимость от концентрации
А) изменения давления насыщенного пара растворителя над раствором
В) изменения температуры кипения раствора
С) изменения температуры замерзания раствора
Д) + осмотического давления
Е) диффузии
9. Математическим выражением закона Рауля является выражение:
р0 – р n
A) + --------- = --------
P0 n + N
B) pV = CRT
C) C1V1 = C2V2
Д) π = CRT
m(х)
E) C(х) = ---------------------
М(х) V(p-pa)
10. К коллигативным свойствам раствора не относится:
А) давление насыщенного пара растворителя над раствором
В) температура кипения раствора
С) температура замерзания раствора
Д) осмотическое давление раствора
Е) + моляльная концентрация раствора
11. Часть осмотического давления, обусловленная наличием в растворе высокомолекулярных компонентов, называется
А) давление насыщенного пара над чистым растворителем
С) + онкотическим давлением
Д) осмотическим давлением
Е) изотонированием
12. Растворы с осмотическим давлением большим, чем в стандарте называются:
А) + гипертоническим
В) гипотоническим
С) изотоническим
Д) физиологическим
Е) насыщенным
13. При помещении эритроцитов в 10% раствор хлорида натрия наблюдается
А) гемолиз
В) + плазмолиз
С) деплазмолиз
Д) равновесное состояние
Е) эндосмос
14. При помещении эритроцитов в 0,1% раствор хлорида натрия наблюдается
А) + гемолиз
В) плазмолиз
С) диализ
Д) равновесное состояние
Е) экзосмос
15. Одинаковое число частиц в растворах одинаковой молярной концентрации будут иметь растворы солей
А) Na2SO4 и NaCI
B) Na2CO3 и NaBr
C) NaBr и K2SO4
Д) + NaCI и KBr
E) NaCI и Na3PO4
16. Питьевая сода, широко используемая в пищевой промышленности это:
А) С6Н12О6
В) NаCI
C) KNO3
Д) + NaHCO3
E) Na2CO3.
