

СЖАСФЕНДИЯРОВ АТЫНДАҒЫ ҚАЗАҚ ҰЛТТЫҚ МЕДИЦИНА УНИВЕРСИТЕТІ |
|
КАЗАХСКИЙ НАЦИОНАЛЬНЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ СДАСФЕНДИЯРОВА |
ДЕПАРТАМЕНТ «ФАРМАЦИЯ» МОДУЛЬ «ФАРМАЦЕВТ-АНАЛИТИК» ЭКЗАМЕНАЦИОННЫЕ ВОПРОСЫ ДЛЯ СТУДЕНТОВ 1 КУРСА ПО ДИСЦИПЛИНЕ «НЕОРГАНИЧЕСКОЙ ХИМИИ» |
||
Экзаменационные вопросы по «Неорганической химии» для студентов 1 курса фармацевтического факультета по специальности
051103 «Фармация» 2011-2012 уч.Год
Химическое равновесие
1.Понятие «равновесие» означает состояние, в котором…
А) количества реагентов равны количествам продуктов реакции.
В) + концентрации веществ не изменяются со временем и отсутствуют потоки массы и энергии.
С) массы продуктов реакции равны массам исходных веществ.
Д) внутренняя энергия равна нулю.
Е) энтропия больше нуля.
2.Состояние химического равновесия характеризуется тремя обязательными признаками.
Это…
А) нулевое значение энергии активации; химическая система должна быть открытой;
положительный тепловой эффект.
В) положительное значение энергии активации; присутствие катализатора; скорости прямой и
обратной реакции должны быть одинаковыми.
С) + химическая система должна быть изолированной; скорости прямой и обратной реакции
должны быть одинаковыми; в системе не происходит никаких видимых изменений
Д) химическая система должна быть закрытой; скорости прямой и обратной реакции должны быть
одинаковыми; нулевое значение энергии активации
Е) скорости прямой и обратной реакции должны быть обратно пропорциональны друг другу;
давление и температура должны быть постоянными величинами.
3. Химическое равновесие называют динамическим, потому что…
А) + два противоположных процесса оказываются сбалансированными
В) в результате совершается работа
С) в результате выделяется или поглощается энергия
Д) два противоположных процесса протекают с разными скоростями
Е) два противоположных процесса протекают обязательно при нагревании.
4. Химические реакции, протекающие в противоположных направлениях, называют…
А) кинетическими
В) термохимическими
С)+ обратимыми
Д) каталитическими
Е) окислительно-восстановительными.
5. Состояние химического равновесия количественно характеризуют…
А) исходными концентрациями реагентов
В) константой Больцмана
С) + константой равновесия
Д) энергией активации
Е) концентрацией продуктов реакции.
6. Для обратимой реакции общего вида aA + bB ↔ dD+eE константа равновесия К записывется так:
[D]d [E]e
А)
+ K = 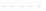
[A]a [B]b
[A]a [B]b
В) К =
[D]d [E]e
[D]d + [E]e
C)
K = 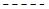
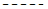
[A]a [B]b
[D]d [E]e
Д) K =
[A]a + [B]b
1
Е) К = ------[D]∙[E]
2
Квадратные скобки обозначают равновесные концентрации; a,b,d,e – стехиометрические коэффициенты.
7. Численное значение константы равновесия химической реакции определяет…
А) скорость реакции
В) энергию активации
С) + выход реакции
Д) молекулярность реакции
Е) порядок реакции.
8. Выход реакции велик в том случае, если…
А) константа равновесия К<<1
В) + константа равновесия К>>1
С) используется катализатор
Д) используется ингибитор
Е) константа равновесия К=1.
9. При достижении химического равновесия концентрации веществ…
А) + становятся постоянными
В) увеличиваются для продуктов и уменьшаются для исходных веществ
С) не могут быть определены
Д) достигают максимальных значений для исходных веществ
Е) достигают максимального значения для продуктов реакции.
10. Какую размерность имеет константа равновесия?
А) + Она всегда безразмерна
В) она может оказаться размерной или безразмерной величиной в зависимости от вида реакции
С) моль∙с
Д) моль/с
Е) моль/л.
11.Константа равновесия термической диссоциации карбоната кальция СаСО3(тв) ↔ СаО(тв) + СО2(г)
может быть записана как...
[CaCO3]
А) Кр= -------------------
[CaO][CO2]
[CaO][CO2]
B) Кр= -------------------
[CaCO3]
C) Кр = [CaCO3] [CaO][CO2]
Д) + Кр = Рсо2
Е) Кр = Р2со2 .
12. Принцип подвижного равновесия утверждает, что внешнее воздействие на равновесную систему приводит к смещению равновесия в том направлении, при котором эффект произведенного воздействия ослабляется. При этом подразумевают три основных типа внешнего воздействия:
А) изменение давление и объема, добавление катализатора
В) изменения давления, концентрации, объема
С) + изменение температуры, концентрации, давления
Д) изменение температуры и давления, добавление катализатора
Е) изменение температуры, давления и энергии активации.
13. Принцип подвижного равновесия справедлив …
А) только для химических процессов
В) только для физических процессов
С) только для химических процессов с участием катализатора
Д) + как для химических, так и для физических процессов
Е) только для биологических процессов.
14. Как влияет увеличение объема сосуда на равновесие: Fe2O3( )+ 3CO2()↔ 2Fe() + 3CO2() ?
А)+ Не влияет
В) сдвигает равновесие вправо, т.к. в ходе реакции увеличивается объем веществ
С) сдвигает равновесие вправо, т.к. в ходе реакции увеличивается число молекул
Д) сдвигает равновесие влево
Е) равновесие сдвигается в максимальную сторону.
15. Как изменяется константа равновесия при повышении температуры?
А) Уменьшается
В) + увеличивается для эндотермических реакций и уменьшается для экзотермических
С) увеличивается
Д) сначала увеличивается, затем уменьшается
Е) увеличивается, если давление при этом постоянное.
16. В какой из реакций давление не влияет на константу равновесия:
А) CO2(г) + С(тв)↔ 2СО(г)
В) N2O4(г)↔ 2NO2(г)
С) + Н2(г) + S(ж) ↔ H2S(г)
Д) 2SO2(г) + O2(г)↔2SO3(г)
Е) N2+ 3H2 ↔2NH3
17. Какое из перечисленных веществ обратимо реагирует с кислородом?
А) + оксид серы (IV)
В) фосфор
С) цезий
Д) оксид азота
Е) водород
Растворы
1.В зависимости от агрегатного состояния растворителя растворы бывают…
А) жидкими, прозрачными, окрашенными
В) твердыми, аморфными, стеклообразными
С) + твердыми, жидкими, газообразными
Д) газообразными, жидкими, мутными
Е) жидкими, мутными, газообразными.
2. На растворимость веществ оказывают влияние…
А) температура, наличие катализатора, низкое значение теплового эффекта растворения
В) температура, наличие катализатора, низкое значение энергии активации
С) + природа растворяемого вещества и природа растворителя, температура, давление
Д) степень окисления элементов растворителя, атмосферное давление, валентность элементов растворяемого вещества
Е) валентность элементов растворяемого вещества.
3. Известны две основные теории растворов:
А) химическая и электролитическая
В) + физическая и химическая
С) кинетическая и каталитическая
Д) молекулярная и ионная
Е) ионная и водородная.
4. Среди перечисленных ниже твердых веществ в воде хорошо растворим…
А) сульфат бария
В) силикат кальция
С) сульфид меди
Д) + нитрат железа
Е) карбонат кальция
5. Исследования водных растворов показали, что в них образуются соединения частиц растворенного вещества с молекулами воды. Эти соединения называют…
А) гидроксидами
В) + гидратами
С) ангидридами
Д) метеоритами
Е) кислотными остатками.
6. Иногда гидратная вода настолько прочно связана с растворенным веществом, что при выделении его из раствора входит в состав его кристаллов. Вода, входящая в структуру таких кристаллов называется…
А) гидратной
В) гидроксидной
С) + кристаллизационной
Д) дистиллированной
Е) оксидной.
7. Кристаллогидрат сульфата меди (II) (медный купорос) CuSO4∙5H2O имеет цвет:
А) красный
В) + синий
С) фиолетовый
Д) золотисто-желтый
Е) кирпично-красный.
8. Растворимость очень немногих твердых веществ с повышением температуры уменьшается;
к ним относится…
А) + Ca(OH)2
B) KCI
C) NH4HCO3
Д) KNO3
Е)MgSO4∙6H2O.
9. Растворимость газов в жидкостях с ростом температуры…
А) увеличивается
В) не изменяется
С) становится неограниченной
Д) + уменьшается
Е) не происходит.
10. В отличие от твердых веществ и жидкостей на растворимость газов сильно влияет:
А) температура
В) присутствие катализатора
С) + давление газа
Д) природа растворителя
Е) концентрация газа.
11. Приготовленный раствор нитрата натрия оставили в незакрытой колбе в летнюю жаркую пору.
Через несколько дней на дне колбы обнаружились кристаллы. Раствор над кристаллами
называется…
А) ненасыщенным
В) разбавленным
С) насыщенным
Д)+ пересыщенным
Е) концентрированным.
12. Количественный состав раствора выражают с помощью понятия:
А) парциального давления
В) + концентрации
С) плотности
Д) аддитивности
Е) объема.
13. Под концентрацией раствора понимают…
А) соотношение между количествами растворенного вещества и растворителя
В) + содержание растворенного вещества (в определенных единицах) в единице массы и объема
С) давление насыщенных паров растворителя в зависимости от количества растворенного
вещества
Д) плотность раствора
Е) соотношение между молярной массой и молярной массой эквивалента.
14. Чаще всего для выражения концентрации используют…
А) + массовую долю, молярную концентрацию, мольную долю
В) парциальное давление, процентную концентрацию, общее число растворенных веществ
С) коэффициент растворимости, растворимость, объемную долю
Д) численное значение плотности раствора, коэффициент преломления, электропроводность раствора
Е) значение величины силы тока или потенциал.
15. Концентрация насыщенных растворов обычно выражают через растворимость вещества S
по формуле:
А)
S
= 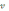 в-ва/
растворителя
в-ва/
растворителя
В) S = mв-ва/mр-ра
С) + S =( mв-ва/mрастворителя)∙100
Д) S= ( в-ва/ mр-ра) ∙100
Е)
S
= mв-ва/
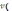 р-ра).
р-ра).
16. В 190 г воды растворили 10 г сахара. Какова массовая доля сахара в растворе?
А) 0,1
В) 10
С) 0,4
Д) + 0,05
Е) 5,0.
17. В 100 мл воды растворили 20г пентагидрата сульфата меди (II). Массовая доля сульфата меди в полученном растворе равна…
А) 10,7%
В) + 16,7%
С) 9%
Д) 7,5%
Е) 8%.
18. Рассчитайте молярную концентрацию раствора серной кислоты, если массовая доля кислоты в этом растворе равна 0,12 (плотность раствора 1,08 г/мл):
А) + 1,32 моль/л
В) 12%
С) 1,6 моль/л
Д) 0,66 моль/л
Е) 0,55моль.
19. Суспензией (взвесью) называют…
А)+ гетерогенную смесь частиц веществ определенного размера
В) гомогенную смесь не менее двух твердых веществ
С) гетерогенную смесь частиц веществ любого размера
Д) раствор со строго взвешенной массой растворенного вещества
Е) гетерогенную смесь, в которой обязательно образуется осадок не зависимо от размера частиц.
20. Дым – это …
А) суспензия молекул никотина в воздухе
В) газовый раствор (смесь) воздуха и газообразных продуктов сгорания
С) + коллоидная дисперсия твердых частиц в воздухе
Д) коллоидная дисперсия жидких частиц в воздухе
Е) хлорид серебра.
21. Если пропустить луч света через коллоидную дисперсию, свет частично рассеивается в ней. Это явление носит название…
А) принципа Паули.
В)+ эффекта Тиндаля.
С) эффекта Джоуля-Ленца.
Д) парникового эффекта.
Е) принцип Ле-Шателье.
Электролитическая диссоциация и ионные реакции в растворах
1.Электролиты - это вещества, которые…
А) проводят электрический ток.
В) растворимы в воде.
С) не растворимы в органических растворителях.
Д) + диссоциируют в растворе или в расплаве на ионы.
Е) находятся в растворе в молекулярном виде.
2.Ионы - это…
А) атомы, характеризующиеся одним и тем же зарядом ядра.
В) + одноатомные или многоатомные частицы, несущие электрический заряд.
С) условные заряды атомов в молекуле, вычисленные в предположении, что все связи в молекуле- ковалентные.
Д) вещества, используемые для изготовления электрических проводов.
Е) условные заряды атомов в молекуле, вычисленные в предположении, что все связи в молекуле
- металлические.
3. Самопроизвольный распад молекул растворенного (иногда – расплавленного) вещества на катионы и анионы называется…
А) электролизом.
В) ионной проводимостью.
С) гомогенным катализом.
Д) + электролитической диссоциацией.
Е) ассоциацией.
4. Процесс электролитической диссоциации является…
А) неравновесным.
В) экзотермическим
С) эндотермическим.
Д) + обратимым.
Е) необратимым.
5. Мерой электролитической диссоциации электролита принято считать…
А) + степень диссоциации.
В) молярную концентрацию раствора
С) рН раствора
Д) константу гидролиза
Е) константу равновесия.
6.Степень диссоциации - это…
А) отношение количества растворенного вещества к общему количеству веществ в растворе.
В) отрицательный логарифм концентрации катионов в растворе
С) + отношение числа молекул, распавшихся на ионы, к общему числу молекул растворенного вещества.
Д) число гидратированных молекул электролита.
Е) число ассоциированных молекул электролита.
7. Численное значение степени диссоциации электролита в растворе при данной температуре зависит от…
А) атмосферного давления.
В) наличия катализатора.
С) + концентрации раствора.
Д) агрегатного состояния электролита.
Е) произведения растворимости.
8.Степень диссоциации сульфита калия в водном растворе с концентрацией 1 моль/л равна 0,75.
Вычислите концентрацию ионов калия в растворе:
А) 0,75 моль/л
В)2,25 моль/л
С) + 1,5 моль/л
Д) 2 моль/л
Е) 1 моль/л.
9.К слабым электролитам относится…
А) нитрат железа(III).
Д) сульфат калия.
С)+ сероводородная кислота.
Д) серная кислота.
Е) нитрат натрия.
10. К сильным электролитам относится…
А) хлорэтан.
В) сернистая кислота.
С) + сульфат калия.
Д) уксусная кислота.
Е) гидроксид аммония.
11. Величиной, характеризующей диссоциацию и не зависящей от концентрации раствора, является…
А) константа гидролиза.
В) ионное произведение воды.
С) + константа диссоциации.
Д) отношение количества растворенного электролита к общей массе раствора.
Е) произведение растворимости.
12. Известно соотношение между константой Кд и степенью диссоциации α электролита. Для электролита, диссоциирующего на один катион и один анион, это соотношение называется законом разведения Оствальда и описывается формулой:
[К+]∙[А-] α
А) Кд = -------------- = ------ С [КА] 1-α
В)+ Кд = α2 С
С) Кд = (1+ α)С2
Д) Кд = (1- α)С
Е) Кд = (1-α)/ С
Здесь С – молярная концентрация электролита КА в растворе.
13.Величину
К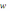 называют:
называют:
А) водородным показателем.
В) произведением растворимости воды.
С) + ионным произведением воды.
Д) произведением искусства дистилляции.
Е) силовым показателем кислотности раствора.
14. Ионное произведение воды зависит только от температуры, численное значение этой величины при 250С составляет…
А)
К .
.
В)
К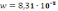 .
.
С)
К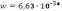 .
.
Д)
+ К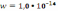 .
.
Е)
К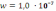 .
.
15. Кислотность (основность) растворов принято выражать через водородный показатель (рН), рассчитываемый по формуле:
А) рН = lg [H+].
B) рН = - lg [OH-].
C)+ рН = - lg [H+].
Д) рН = - ln [OH-].
E) рН = - log [H+].
16.Значение рН чистой воды при 250С составляет…
А) 1.
В)+ 7.
С) 0.
Д) 10.
Е) 5.
17. Рассчитайте рН: а) соляной кислоты с концентрацией 0,1 моль/л; б) водного раствора гидроксида калия с концентрацией 1,0 моль/л, считая, что указанные вещества диссоциируют полностью:
А) + а) 1; б)14.
В) а) 7; б) 7.
С) а) 14; б) 0.
Д) а) 2; б)12.
Е) а) 1; б)13.
18. Рассчитайте концентрацию ионов водорода в растворе аммиака с концентрацией 1,5 моль/л.
Константа
диссоциации гидроксида аммония равна
1,7
 10-5:
10-5:
А) [Н+] = 3∙ 10-10 моль/л.
В) [Н+] = 2∙ 10-2 моль/л.
С) +[Н+] = 2∙ 10-12 моль/л.
Д) [Н+] = 4∙ 10-1 моль/л.
Е) [Н+] = 2∙ 10-8 моль/л.
19. Диссоциацию малорастворимых веществ (типаAgCI или BaSO4) характеризуют с помощью специальной константы, называемой…
А) константой Больцмана.
В) + произведением растворимости.
С) степенью ионизации.
Д) ионным произведением.
Е) константой гидролиза.
20. Взаимодействие карбоната бария с соляной кислотой можно представить сокращенным ионным уравнением:
А) Ba2+ + 2CI- = BaCI2.
B) Ba2+ + CO32- + 2H+ + CI- = Ba2+ + CO32 + 2HCI↑.
C) + BaCO3 + 2H+ = Ba2+ + CO2↑ +H2О
Д) 2H++ CO32 = H2CO3
E) Ba2+ + CO32 = BaCO3↓
21. С каким веществом вступит в реакцию обмена в водном растворе хлорид бария?
А) HNO3.
B) + CuSO4.
C) CuCI2.
Д) LiOH.
E) HNO2.
22. Ниже перечислены ионы, одновременно обнаруженные в одном из водных растворов:
А) Ba2+, NO3-,SO42-,NH4+,Br-.
B) Zn2+,CI-, Fe2+,Ca2+,OH-.
C) Cu2+, Br-,S2-,Ag+,NO3-.
Д) + Fe2+,SO42-,Na+, NH4+, NO3-.
E) Al3+, CI-, Fe3+,Mg2+,OH-.
23.Какая соль не может вступать в обменные реакции в водном растворе?
А) Нитрат аммония.
В) хлорид натрия.
С) +нитрат калия.
Д) нитрит калия.
Е) нитрат натрия.
24. С точки зрения теории диссоциации, кислотой называют соединение,…
А) образующее при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН-.
В) подвергающиеся гидролизу в водном растворе.
С)+ образующее при диссоциации в водном растворе из положительных ионов только ионы водорода Н+.
Д) способные проводить электрический ток.
Е) образующее при диссоциации в водном растворе из положительных ионов только ионы кислотного остатка.
25. Водные растворы многих солей могут иметь щелочную или кислую среду. Причиной этого является …
А) электролиз солей.
В) диспропорционирование солей.
С)+ гидролиз солей.
Д) гидратирование солей.
Е) ассоциация солей.
26. Какое вещество практически полностью гидролизуется в воде?
А)+ Al2S3.
B) таких веществ не существует.
C) KCI.
Д) H2SO4.
Е) NaNO3
Общая характеристика неорганических соединений, их классификация и номенклатура.
1.На какие два типа можно подразделить все химические вещества?
А) Органические и неорганические.
В) + индивидуальные вещества и смеси.
С) металлы и неметаллы.
Д) простые и сложные.
Е) открытые и изолированные.
2. Все индивидуальные неорганические вещества подразделяются на …
А) + простые и сложные.
В) солеобразующие и несолеобразующие.
С) ионные и ковалентные.
Д) твердые и жидкие.
Е) металлические и неметаллические.
3. Сложные неорганические вещества обычно делят на четыре важнейших класса:
А) металлы, неметаллы, кислоты, соли.
В) оксиды, пероксиды, кислоты, соли.
С) + оксиды, основания, кислоты, соли.
Д) окислители, восстановители, ингибиторы, катализаторы.
Е) двойные соли, комплексные соли, окислители, восстановители.
4. К амфотерным оксидам относятся…
А) SiO2, ZnO,Cl2O7.
B) BeO, Al2O3, N2O5.
C) Cr2O3, F2O, Cl2O.
Д) + Cr2O3, Al2O3.
E) CaO, P2O5.
5. К какому типу химического взаимодействия относятся реакции кислот с индикаторами, приводящие к изменению окраски раствора?
А) + Кислотно-основному.
В) окислительно-восстановительному.
С) каталитическому
Д) донорно-акцепторному.
Е) металлохромному.
6.Укажите пару веществ, которые полностью растворяются в соляной кислоте:
А) Fe, PbS.
B) BaSO4, MgSO4.
C) +CaCO3, CaSO4.
Д) AgCI, AgBr.
E) Hg2Cl2, BaCrO4.
7. Только одно из приведенных названий кристаллогидрата Na2SO4∙10H2O соответствует правилам международной номенклатуре:
А) кристаллогидрат сернокислого натрия.
В) + декагидрат сульфата натрия.
С) глауберова соль.
Д) кристаллогидрат натрия.
Е) нонагидрат сульфата натрия.
8.Укажите самую слабую из перечисленных кислот:
А) HI.
B) H3BrO4.
C) HNO3.
Д) + HOCI
E) HBr.
9. Гексацианоферрату (III) калия соответствует формула:
A) K[Fe(OH)4 ]
B) K4 [Fe(CN)6]
C) KCr(SO4)2∙12H2O.
Д) + K3 [Fe(CN)6]
E) K2CrO4.
Водород. Вода и пероксид водорода.
1.По своим физическим свойствам водород во многом похож на…
А) щелочные металлы.
В) фуллерен.
С) бензол.
Д) + галогены
Е) халькогены.
2. Химические свойства водорода в наибольшей степени похожи на свойства…
А) галогенов. В) хрома и марганца.
С) благородных газов.
Д) + щелочных металлов.
Е) меди и серебра.
3. Атомы водорода способны не только отдавать, но и присоединять электроны, приобретая при этом электронную конфигурацию…
А) атома лития.
В)+ инертного газа гелия.
С) иона Na+.
Д) иона F-.
E) иона Cl-.
4. Какой тип химической связи в молекуле Н2?
А) Водородная.
В) ионная.
С) донорно-акцепторная.
Д) + ковалентная неполярная.
Е) ковалентная полярная.
5. Молекулярный водород легче метана в…
А) + 8 раз.
В) 3 раза.
С) 16 раз.
Д) 32 раза.
Е) 6 раз.
6. Соединения, образующиеся при взаимодействии водорода с активными металлами, называют…
А) карбидами.
В) гидратами.
С) + гидридами.
Д) ангидридами.
Е) оксидами.
7. Для каждого соединения «обычного» водорода существует его дейтериевый аналог. Важнейшим из них является оксид дейтерия, называемый…
А) + тяжелой водой.
В) магнитной водой.
С) сухим льдом.
Д) инеем.
Е) облегченной водой.
8. Смесь равных объемов двух газов имеет плотность в 10 раз меньшую плотности этана.
Какие это газы?
А) Водород и кислород.
В) водород и азот.
С) + гелий и водород.
Д) гелий и озон.
Е) водород и хлор.
9. Водород способен окислить следующие вещества:
А) литий и платину.
В) бром и барий.
С) оксид железа (II) и оксид меди (II).
Д)+ калий и кальций.
Е) алюминий и цинк.
10. Вода может реагировать с …
А) аренами и азотом.
В) алканами и аргоном.
С) + ангидридами кислот и ацетиленом.
Д) апатитами и ацетоном.
Е) бензолом и анилином.
11. Валентный угол < НОН в молекуле воды составляет…
А)+ 1050.
В) 1090 28/.
С) 1200.
Д) 1800.
Е) 900.
12.Вода – это идеальный…
А) окислитель.
В) + амфолит.
С) растворитель для большинства органических соединений.
Д) катализатор.
Е) ингибитор.
13.Плотность чистой воды при 250С равна…
А) + 1,0 г/мл.
В) 1,0 г/моль.
С) 22,4 л/моль.
Д) плотности пероксида водорода.
Е) 1,98 г/мл.
14. Жесткость воды обусловлена присутствием ионов…
А) +Ca2+ и Mg2+.
B) Ba2+ и SO42-.
C) Fe2+ и Al3+.
Д) Sr2+ и CO32-.
E) Al3+ и Zn2+.
15. Вода в отличие от сероводорода при обычных условиях – жидкость. Это объясняется…
А) меньшей молекулярной массой воды.
В) существованием водородных связей в молекуле воды.
С) + образованием ассоциатов из молекул воды за счет межмолекулярных водородных связей.
Д) нулевым значением дипольного момента воды.
Е) отсутствием значения дипольного момента воды.
16. Из 21 г. гидрида кальция можно получить…
А) 10,5 г Н2О.
В) + 2,0 г Н2.
С) 15,0 г Н2О2.
Д) 4,0 г СаС2.
Е) 1,0 г Н2.
17. Сколько атомов содержит молекула пероксида водорода?
А) + Четыре.
В) три.
С) два.
Д) молекула состоит не из атомов, из ядер атомов.
Е) пять.
18. Степень окисления кислорода в молекуле пероксида водорода равна…
А) нулю.
В) +2.
С) -2.
Д) + -1.
Е) -1/2.
19. Пероксид водорода может быть получен при взаимодействии с водой…
А) ВаО или К2О.
В) О3 или Н2S.
C) + ВаО2 или К2О2.
Д) О2
Е) О2 + Н2О.
20. Пероксид водорода (Н2О2) в окислительно-восстановительных реакциях…
А) всегда проявляет окислительные свойства.
В) может быть только восстановителем.
С) + окисляется при реакциях с сильным окислителем.
Д) всегда диспропорционирует.
Е) не проявляет окислительно- восстановительных свойств.
21. При взаимодействии Н2О2 с перманганатом калия в присутствии серной кислоты образуются следующие вещества:
А)+ MnSO4 + K2SO4 + O2↑ + Н2О.
B) MnO + K2SO4 + O2↑ + Н2О.
C) MnO2↓+ KOH + O2↑ + Н2О.
Д) Н2О2 не реагирует с перманганатом калия в кислой среде.
Е) H2MnO3 + KOH + O2↑.
22. Какие два вещества вступили в реакцию, если в результате образуется одно вещество – гидроксид железа (III)?
А) Fe и Н2О2.
B) Fe2O3 и Н2О.
C) + Fe(OH)3 и Н2О2.
Д) Fe и Н2О..
Е) FeO и Н2О.
23. 30%-ный раствор пероксида водорода в воде имеет техническое название…
А) нашатырный спирт.
В) + пергидроль.
С) формалин.
Д) олеум.
Е) ацетон.
Халькогены
1.К халькогенам относят элементы…
А)+ главной подгруппы VI группы периодической системы.
В) побочной подгруппы VI группы.
С) главной подгруппы VII группы.
Д) благородных газов.
Е) побочной подгруппы VII группы.
2.Кислород и сера…
А) хорошие проводники электричества.
В) имеют аллотропные модификации.
С) + хорошо растворимы в воде.
Д) типичные восстановители.
Е) проводники I рода.
3. Сера имеет три аллотропные модификации, называемые…
А) карбин, сера кубическая, озон.
В) карбен, сера кристаллическая, кремнезем.
С) сера кристаллическая, сера гидратная, сера гомогенная.
Д)+ сера аморфная, сера ромбическая, сера моноклинная.
Е) сера гетерогенная, сера кристаллическая, кремнезем.
4. Объемная доля кислорода в воздухе составляет…
А) +21%.
В)78%.
С) 50%.
Д) воздух практически полностью состоит из кислорода.
Е) 60%.
5.Какое из перечисленных веществ позволяет выделить максимальное количество кислорода при прокаливании одного моля?
А) + KCIO3.
B) KMnO4.
C) KNO3.
Д) HgO.
E) FeO.
6.Укажите уравнение реакции, используемой для качественного обнаружения озона:
А) +2KI + O3 + Н2О = I2+ O2 + 2KOH.
B) 2 FeSO4 + O3 + H2SO4 = Fe2 (SO4)3 + O2 + Н2О.
C) PbS +2O3 = PbSO3+ 2O2.
Д) такой реакции, к сожалению, не существует.
Е) озон в реакциях ОВР не принимает участия.
7. Сероводород при обычных условиях - …
А) газ зеленоватого цвета с чесночным запахом.
В) легколетучая жидкость.
С) + бесцветный газ с запахом тухлых яиц.
Д) один из аллотропов серы.
Е) бесцветный газ с запахом горящей серы.
8.Сероводород – это…
А) сильнейший окислитель.
В) очень сильная кислота.
С) типичное амфотерное соединение.
Д) + типичный восстановитель.
Е) амфолит.
9. Оксид серы (IV) является ангидридом…
А) серной кислоты.
В) +сероводородной кислоты.
С) сернистой кислоты.
Д) тиосерной кислоты.
Е) надсерной кислоты.
10.Массовая доля кислорода в оксиде серы (IV) равна…
А) + 50%.
В) 25%.
С) 66,6%.
Д) 10%.
Е) 70%.
11. Формула тиосульфата натрия -…
А) Na2SO3.
B) Na2S2.
C) Na2SO4.
Д) + Na2S2O3.
Е) Na2S4O6.
12. Оксид серы (VI) получают окислением SO2 в обратимой реакции 2SO2 + O2↔ 2SO3 + Ỡ. Чтобы сместить равновесие этой реакции вправо, необходимо…
А) обязательно использовать катализатор.
В) повысить температуру.
С) понизить давление.
Д) + понизить температуру и повысить давление.
Е) использовать ингибитор.
13. Раствор SO3 в 100%-ной серной кислоте называют…
А) царской водкой.
В) плавиковой кислотой.
С) + олеумом.
Д) олеиновой кислотой.
Е) стеариновой кислотой.
14. Существует неукоснительное правило приготовления разбавленной серной кислоты из концентрированной:
А) + сосуд с водой медленно приливают концентрированную H2SO4.
B) в сосуд сконцентрированной серной кислотой приливают воду.
С) порядок приливания не имеет значения.
Д) серная кислота не растворяется в воде.
Е) серная кислота обязательно должна быть ледяной.
15. Пирит имеет формулу…
А) Na2SO4 ∙10 H2O.
B) FeS.
C) + FeS2.
Д) Na2S2.
E) Fe2S3.
16. Какие вещества вступили в реакцию, если в результате образовались BaSO4 + H2SO4 + H2O (указаны все продукты реакции без коэффициентов):
А) Ba(HSO4)2+ BaSO4+ O2.
B) BaO+ Ba(HSO3)2.
C)+ Ba(HSO3)2 + H2O2.
Д) Ba + H2SO4(конц).
E) BaCI2+ HNO3.
17. Качественная реакция на сульфат-ионы:
А) SO42- + 2H+ = SO3↑+ H2O.
B) + Ba2+ + SO42- = BaSO4↓.
C) Ba2+ + SO32- = BaSO3↓.
Д) 2NH4+ + SO42- = 2NH3↑+ H2SO4.
E) 2Na+ + SO42- = Na2SO4.
Подгруппа азота
1.Молекулярный азот N2 – исключительно…
А) электропроводен при низких температурах.
В) + нереакционноспособен при обычных условиях.
С) легко диссоциирует на атомарный азот уже при комнатной температуре.
Д) легко растворяется в воде.
Е) легко образует аммиак при обычных условиях.
2. В молекуле азота атомы связаны…
А) + двумя π- связями и одной σ связью.
В) двумя σ -связями и одной π- связью.
С) двумя π- связями и одной водородной связью.
Д) ковалентными связями, образованными по донорно-акцепторному механизму.
Е) ковалентной полярной связью.
3. Белый фосфор в отличие от азота…
А) обладает заметной электрической проводимостью.
В)+ химически высоко реакционноспособен.
С) не встречается в природе в свободном состоянии.
Д) хорошо растворим в воде.
Е) широко используется в промышленности при изготовлении спичек.
4. Фосфор, как и азот, входит…
А) в состав всех минеральных солей.
В)+ в состав всех живых организмов.
С) в состав воздуха.
Д) царской водки.
Е) морской воды.
5. В лабораторных условиях азот может быть получен прокаливанием…
А) нитрата аммония.
В) фосфата аммония.
С)+ нитрита аммония.
Д) нитрата серебра.
Е) нитрата свинца.
6. Какая из аллотропных модификаций фосфора наименее реакционноспособна?
А) Белый фосфор.
В)+ черный фосфор.
С) красный фосфор.
Д) фосфор так же, как и азот, не имеет аллотропных модификаций.
Е) белый фосфор одновременно с красным.
7. Все аллотропы фосфора (особенно белый фосфор) гораздо более реакционноспособны, чем молекулярный азот. Причина заключается в том, что…
А) + значение энергии связи в молекуле N2 значительно превышает значение энергии связи между атомами в любом аллотропе фосфора.
В) молекула азота образована ковалентными связями, тогда как молекула фосфора образована слабыми водородными связями.
С) молярная масса азота намного меньше молярной массы фосфора.
Д) любое твердое вещество более реакционноспособно , чем газообразное вещество.
Е) потому что фосфор расторим в концентрированной серной кислоте, а азот нет.
8. Соединения: а) азота, б) фосфора с металлами называют…
А) а) амидами; б) фосфитами.
В) а) нитритами; б) фуранами.
С)+ а) нитридами; б) фосфидами.
Д) а) нитратами; б) фосфинами.
Е) а) нитритами б)фосфинами.
9. Назовите промежуточное вещество Х в следующей схеме: дихромат аммония→Х→ аммиак:
А) оксид хрома(III).
В) водород.
С)+ азот.
Д) оксид хрома(IV).
Е) оксид хрома (II).
10. Аммиак в обычных условиях – это…
А) + бесцветный газ с резким удушливым запахом.
В) густая жидкость с характерным запахом нашатыря.
С) кристаллическое вещество фиолетово-серого цвета.
Д) ядовитый газ с запахом тухлых яиц.
Е) газ бурого цвета с резким удушливым запахом.
11. Молекула аммиака имеет форму…
А) тетраэдра.
В) + треугольной пирамиды.
С) треугольника.
Д) куба.
Е) два правильных тетраэдра.
12. Полярные молекулы аммиака…
А) практически нерастворимы в воде.
В) + очень хорошо растворимы в воде.
С) в жидком аммиаке связаны ионными связями.
Д) в водном растворе практически мгновенно диссоциируют на ионы N-3 и Н+1.
Е) лакмус синий в парах NH3 краснеет.
13. В отличие от аммиака, фосфин…
А)+ практически не растворяется в воде.
В) образует гидроксиды.
С) является газообразным веществом.
Д) проявляет свойства восстановителя.
Е) проявляет окислительные свойства.
14. Валентность и степень окисления азота в азотной кислоте соответственно равны:
А) V и +5.
B)+ IV и +5.
C) V и +4.
Д) III и -3.
E) II и +2.
15. Валентность и степень окисления азота в ионе аммония соответственно равны:
А) III и +5.
B) V и -4.
C)+ IV и -3.
Д) III и -5.
E) III и +4.
16. Оксид азота (III) при обычных условиях – синяя жидкость, являющаяся…
А) несолеобразующим оксидом.
В) ангидридом азотной кислоты.
С) амфотерным оксидом.
Д)+ ангидридом азотистой кислоты.
Е) основным оксидом.
17. Оксид фосфора() (истинная формула Р4О6) – это…
А)+ ангидрид фосфористой кислоты.
В) ангидрид фосфорноватистой кислоты.
С) ангидрид ортофосфорной кислоты.
Д) несолеобразующий оксид.
Е) ангидрид пирофосфорной кислоты.
18. Для азотной кислоты характерны реакции…
А) восстановления.
В) диспропорционирования.
С) нейтрализации.
Д) + окисления.
Е) комплексообразования.
19. При взаимодействии концентрированной азаотной кислоты с цинком выделяется газообразный…
А) кислород.
В) водород.
С) + оксид азота(IV).
Д) аммиак.
Е) оксид азота(II).
20. При взаимодействии разбавленной азотной кислоты с медью выделяется газообразный…
А) водород.
В) + оксид азота(IV).
С) оксид азота(II).
Д) аммиак.
Е) оксид азота(I).
21.Какой металл не реагирует с охлажденной концентрированной азотной кислотой?
А) Cu.
B)+ Fe.
C) Ag.
Д) Al.
E) Zn.
22. «Царской водкой» называют водную смесь, содержащую…
А)+ азотную кислоту и хлороводород в мольном соотношении 1:3.
В) азотную кислоту и хлороводород в мольном соотношении 3:1.
С) азотную кислоту и перманганат калия в мольном соотношении 1:1.
Д) азотную кислоту и дихромат калия в мольном соотношении 2:1.
Е) азотную кислоту и хлороводородную кислоту в мольном соотношении 1:10.
23.При прокаливании большинства твердых нитратов выделяется…
А) азот.
В) оксид азота(II).
С)+ кислород.
Д) оксид азота(I).
Е) аммиак.
24. Какое из веществ называется гидрофосфитом калия?
А) K2HPO4.
B) KH2PO3.
C)+ K2HPO3.
Д) KH2PO2.
Е) KH2PO4.
25.Какие нитраты называют селитрами?
А) Ca(NO3)2 ; Cu(NO3)2 ; AgNO3.
B) Fe(NO3)2; Fe(NO3)3; Al(NO3)3.
C) Ba(NO3)2; Mg(NO3)2; Zn(NO3)2.
Д)+ NaNO3; KNO3; NH4NO3.
E) Na2SO4; K2SO3; (NH4)2SO4.
26. Среди перечисленных минеральных удобрений укажите преципитат:
А) Ca(H2PO4)2.
B) (NH4)2 HPO4.
C) NH4NO3.
Д) + CaHPO4 ∙2Н2О.
Е) Ca3 (PO4)2.
Подгруппа углерода и кремния
1.После кислорода самый распространенный элемент в земной коре - …
А) + кремний.
В) углерод.
С) свинец.
Д) железо.
Е) марганец.
2. Среди перечисленных ниже веществ к аллотропным модификациям углерода относятся…
А) фуллерен.
В) озон.
С) свинец.
Д) +алмаз.
Е) марганец.
3.В отличие от углерода кремний…
А)+ в свободном состоянии не встречается.
В) имеет аллотропные модификации.
С) является твердым веществом.
Д) проявляет типичные восстановительные свойства.
Е) проявляет типичные окислительные свойства.
4. Алмаз – это…
А) аморфное вещество коричневого цвета.
В)+ самое твердое из известных веществ.
С) один из лучших проводников электрического тока.
Д) ангидрид угольной кислоты.
Е) порошок черно-серого цвета.
5.В карбине и графите атомы углерода находятся соответственно в состоянии…
А) + sp - гибридизации и sp2- гибридизации.
В) sp2- гибридизации и sp - гибридизации.
С) sp3 - гибридизации.
Д) sp2- гибридизации и sp3 - гибридизации.
Е) sp3 – гибридизации и sp4 - гибридизации.
6. Графит и кремний – типичные…
А) окислители.
В)+ восстановители.
С) металлы.
Д) полудрагоценные камни.
Е) благородные металлы.
7. Соединения : а) углерода, б) кремния с металлами называют…
А) а) карбонатами; б) силикатами.
В) а) карборундами; б) кремнеземами.
С) а) карбинами; б) силанами.
Д)+а) карбидами; б) силицидами.
Е) а) гидридами; б) силанами.
8. При взаимодействии углерода с концентрированной серной кислотой выделилось 13,44 л газов (н.у.),рассчитать массу углерода, вступившего в реакцию.
А) 1,0.
В) 2,0.
С) +2,4.
Д) 3,6.
Е) 7,2.
9. Для полного растворения кремния можно использовать…
А) концентрированную плавиковую кислоту.
В) концентрированную серную кислоту.
С) царскую водку.
Д)+ смесь концентрированных азотной и плавиковой кислот.
Е) хлороводородную кислоту.
10. Оксид углерода(II) – …
А)+ ядовитый газ без цвета и запаха.
В) газ с запахом чеснока.
С) твердое вещество белого цвета.
Д) легкокипящая жидкость.
Е) кислотный оксид угольной кислоты.
11. Оксид углерода (II) формально можно считать…
А) несолеобразующим оксидом.
В) амфотерным оксидом.
С) + ангидридом муравьиной кислоты.
Д) ангидридом угольной кислоты.
Е) ангидридом уксусной кислоты.
12. В присутствии катализатора или при облучении СО окисляется хлором, образуя…
А) тетрахлорид углерода и озон.
В)+ ядовитый газ фосген.
С) углекислый газ и четыреххлористый углерод.
Д) оксид углерода (II) невозможно окислить хлором.
Е) газ метан и хлороводородную кислоту.
13. При нагревании со многими металлами оксид углерода (II) образует летучие жидкости, называемые…
А) карбенами.
В) карбокатионами.
С) карбоанионами.
Д)+ карбонилами.
Е) карбидами.
14. При нагревании оксида углерода (II) с водородом при повышенном давления идет обратимая реакция с образованием…
А) водяного газа.
В) этилового спирта.
С) +метилового спирта.
Д) муравьиной кислоты.
Е) муравьиного альдегида.
15. Карбонилы металлов широко используют…
А)+ для получения металлов высокой чистоты.
В) в качестве катализаторов в органической химии.
С) в парфюмерной промышленности.
Д) для получения технических алмазов.
Е) для получения непредельных углеводородов.
16.Какой газ тяжелее углекислого газа?
А) Воздух.
В) угарный газ.
С) пропан.
Д) +озон.
Е) водород.
17. При обычных давлениях и комнатной температуре твердый оксид углерода (IV)…
А) самопроизвольно воспламеняется на воздухе.
В) самопроизвольно распадается на углерод и кислород.
С) легко переходит в жидкое состояние.
Д) + переходит в газообразное состояние, минуя жидкое.
Е) переходит в оксид углерода (II).
18. Оксид углерода (IV) – это…
А) амфотерный оксид.
В) основной оксид.
С) ангидрид уксусной кислоты.
Д) +ангидрид угольной кислоты.
Е) ангидрид муравьиной кислоты.
19.Угольная кислота в свободном виде…
А) представляет собой летучую жидкость.
В) представляет собой тяжелую, густую жидкость.
С) + не существует, так как она чрезвычайно неустойчива и легко разлагается.
Д) представляет собой газообразное вещество тяжелее воздуха.
Е) представляет собой тяжелую маслянистую жидкость.
20. Угольная кислота – двухосновная; она образует средние и кислые соли, называемые…
А) карбидами и гидрокарбидами.
В)+ карбонатами и гидрокарбонатами.
С) карбонилами и гидрокарбонилами.
Д) карборундами и гидрокарборундами.
Е) карбидами и гидрокарбидами.
21. Качественная реакция на соли угольной кислоты - …
А)+ действие сильных кислот.
В) действие щелочей.
С) взаимодействие с нитратом серебра.
Д) взаимодействие с озоном.
Е) реакция серебряного зеркала.
22. Из всех карбонатов в воде растворимы карбонаты…
А) металлов, стоящих в ряду активности после водорода.
В) металлов, стоящих в ряду активности до водорода.
С)+ щелочных металлов и аммония.
Д) щелочноземельных металлов.
Е) металлов подгруппы железа.
23. Угольная кислота, так же, как и кремниевая, относится к типичным…
А) восстановителям.
В) сильным кислотам.
С) окислителям.
Д)+ слабым кислотам.
Е) амфотерным кислотам.
24. Гидрокарбонаты щелочных металлов при нагревании…
А) + разлагаются на карбонаты, углекислый газ и воду.
В) разлагаются на оксид щелочного металла, оксид углерода (II) и воду.
С) диспропорционируют.
Д) плавятся и переходят в жидкое состояние.
Е) разлагаются на углекислый газ и воду.
25. Из солей угольной кислоты наибольшее практическое значение имеет…
А) глауберова соль.
В) бертолетова соль.
С) гидроксокарбонат.
Д) +сода.
Е) соль Мора.
26. Соединение NaHCO3 называется…
А) гидроксокарбонататом натрия.
В) известняком.
С)+ гидрокарбонатом натрия.
Д) гидроксокарбонат меди (II).
Е) технической содой.
27.Зеленые растения под действием света поглощают углекислый газ. При этом происходит реакция:
h𝑣
А) CO2 = C+O2↑.
h𝑣
B)+ 6CO2 + 6H2O = C6H12O6 + 6O2↑.
h𝑣
C) CO2 + C = 2CO
h𝑣
Д) CO2 + H2O = H2CO3.
E) CO2 + H2 = HCOOH.
28.Оксид кремния (IV) – …
А) газообразное вещество без цвета и запаха.
В) основной оксид.
С) + ангидрид кремниевой кислоты.
Д) твердое, очень тугоплавкое вещество.
Е) амфотерный оксид.
29. Кремнезем растворяется в…
А) соляной кислоте.
В) царской водке.
С) воде.
Д) + плавиковой ксилоте.
Е) азотной кислоте.
30.Концентрированные растворы силикатов натрия и калия называют…
А) жидкими кристаллами.
В) кристаллогидратами.
С)+ жидким стеклом.
Д) жидким мылом.
Е) твердым мылом.
31. Простейшее водородное соединение кремния называется…
А) метан.
В) боран.
С)+ силан.
Д) алкан.
Е) алкен.
32.Щелочи реагируют с силаном по уравнению:
А) SiH4 + 2KOH = SiO2 + 2KH + 2H2↑.
B)+ SiH4 + 2KOH +H2O = K2SiO3 + 4H2↑.
C) SiH4 + 4KOH = K4Si + 4H2↑+ 2O2↑.
Д) SiH4 + 3KOH =K2SiO3 + KH + 2O2↑.
E) SiH4 + 3KOH =H2SiO3 + 3KH + H2↑.
33. Среди карбидов и силицидов особое место занимает карборунд SiC, который…
А) имеет высокую температуру плавления.
В) + по твердости близок к алмазу.
С) химически очень реакционноспособен.
Д) хорошо растворим в воде.
Е) обладает окислительными свойствами.
Подгруппа марганца
1.Природное соединение марганца:
А) MnO.
B) MnCI2.
C) KMnO4.
Д) K2MnO4.
E) + MnO2.
2.При взаимодействии MnO2 с концентрированной хлороводородной кислотой образуется:
А) MnO.
В) MnO2.
С) K2MnO4.
Д)+ CI2.
E) MnCI4.
3. В уравнение реакции: KMnO4 + H2O2 +H2SO4 f эквивалентности (KMnO4) как окислителя равен:
А) 1.
В) 1/2.
С)1/4.
Д)+ 1/5.
Е) 1/6.
4. Для получения марганца из его оксидов используют восстановитель:
А) H2.
B) K.
C) H2S.
Д) HBr.
E)+Si.
5. Формула минерала «гаусманита»...
А) MnO.
В) Mn2O3.
С)+Mn3O4.
Д) MnS.
E) MnCO3.
6. Какая из кислот пассивирует марганец?
А) HCI.
B) H2SO4.
C) + HNO3.
Д) CH3COOH.
E) H2S.
7. Цвет аквакомплекса [Mn(H2O)6]2+…
A) бесцветный.
В) синий.
С) малиновый.
Д) + слаборозовый.
Е) бурый.
8. При восстановлении KMnO4 в нейтральной среде образуется:
А) MnO.
В)+ MnO2.
С) Mn3O4.
Д) Mn2O3.
Е) Mn2O7.
9. Оксид марганца, обладающий основными свойствами:
А) MnO2.
В) Mn2O3.
С) Mn2O7.
Д)+ MnO.
Е) Mn3O4.
10. При прокаливании KMnO4 образуется:
А) Mn2O3.
В) MnO.
С) K2MnO4.
Д)+О2.
Е) Mn3O4.
Подгруппа хрома
1.Для какого из элементов характерна степень окисления равная «3»?
А) + Хром.
В) марганец.
С) ванадий.
Д) магний.
Е) свинец.
2. В какой цвет окрашивается раствор, если идет следующая реакция:K2Cr2O7 + KI + HCI→
А) синий.
В) + бурый.
С) фиолетовый.
Д) желтый.
Е) зеленый.
3. Какой из оксидов обладает амфотерными свойствами?
А) CrO.
B)+ Cr2O3.
C) CrO3.
Д) MnO2.
Е) Mn2O7.
4. Какой из оксидов проявляет основные свойства?
А)+ CrO.
B) Cr2O3.
C) CrO3.
Д) MnO2.
Е) Mn2O7.
5. Фактор эквивалентности дихромата в реакции: K2Cr2O7 + KI + HCI→
А) 1.
В1/2 .
С) 1/3.
Д) 1/5.
Е)+ 1/6.
6. При взаимодействии CrCI3 и (NH4)2S в водном растворе образуется:
A) Cr2S3.
B) CrOHCI2.
C) CrS.
Д) Cr2(SO4)3.
E) + Cr(OH)3.
7. Формула хромистого железняка:
А) FeO.
B) + Fe(CrO2)2.
C) NaCrO2.
Д) Na2CrO4.
E) Cr2O3.
8. Какая из солей хрома подвергается полному и необратимому гидролизу?
А) CrCI3.
B) Cr2(SO4)3.
C) CrPO4
Д) +Сr2S3.
E) CrBr3.
9. Какой из приведенных оксидов является кислотным, сильным ядом, сильнейшим окислителем и окрашен в темно-красный цвет?
А) CrO.
В) + CrO3.
С) Cr2O3.
Д) CrO2.
Е) CrO(OH).
10. Какое соединение хрома применяется как прижигающее средство от бородавок и полипов?
А) CrCI3.
В) Cr2(SO4)3.
С) CrO.
Д)+ CrO3.
Е) Cr2O3
Законы химии
1.Количественной характеристикой химических реакций является закон сохранения массы, который открыл:
А) Жозеф - Луи- Пруст
В) Д.И.Менделеев
С) + М.В.Ломоносов
Д) Авогадро
Е) Гей – Люссак.
2. Газовые законы – это законы объемных отношений, которые были открыты:
А) Жозеф – Луи –Пруст
В) Д.И.Менделеев
С) М.В.Ломоносов
Д)+ Авогадро
Е) Гей- Люссак.
3. Закон постоянства состава был открыт:
А) + Жозеф – Луи – Пруст
В) Д.И.Менделеев
С) М.В.Ломоносов
Д) Авогадро
Е) Гей – Люссак.
4. Отношение массы определенного объема одного газа к массе такого же объема другого газа (взятого при тех же условиях) называется:
А) молярной массой
В) количеством вещества
С)+ плотность первого газа по второму
Д) молярным объемом газа
Е) молярной концентрацией.
5. Молекула уксусной кислоты состоит из:
А) из одного атома углерода, двух атомов водорода и одного атома кислорода
В) из одного атома углерода, трех атомов водорода и одной альдегидной группы
С)+ из двух атомов углерода, четырех атомов водорода и двух атомов кислорода
Д) из ионов кислотного остатка и водорода
Е) из спиртовой группы и метильной группы.
6.Какое количество вещества содержится в оксиде серы(IҮ) массой 12 г
М(SO3) =80 г /моль
А) 15 моль
В) 1,5 моль
С)+ 0,15 моль
Д) 0,015 моль
Е) 0,0015 моль.
7.Какое количество атомной серы содержится в сульфиде железа (II) массой 22г
М(FeS)=88 г /моль
А) 25 моль
В) 2,5 моль
С) + 0,25 моль
Д) 0,025 моль
Е) 0,0025 моль.
8. Чему равна массовая доля углерода в карбиде кальция?
А)+ 37,5%
В) 3,75%
С) 0,375%
Д) 40%
Е) 4%
9.Какую массу будет иметь азот объемом 30 л при нормальных условиях?
А) 375,2 г
В) 37,52 г
С) 3,752 г
Д) 0,3752 г
Е) 0,0375г.
10.Какой объем займет аммиак массой 51 г при нормальных условиях?
А) 6720 л
В) 672,0 л
С)+ 67,2 л
Д) 6,72 л
Е) 0672 л.
11. Плотность бромоводорода по водороду равна:
А) 4050
В) 405,0
С)+ 40,5
Д) 4,05
Е) 0,405
12. Плотность бромоводорода по воздуху равна:
А) 2800
В) 280,0
С) 28,00
Д)+ 2,80
Е) 0,28
Строение атома
1.Сколько нейтронов в ядре атома Pb с массовым числом 208?
А) 82
В) 125
С) 207
Д) 289
Е)+ 126
2.Сколько протонов в ядре атома Pb с массовым числом 208?
А)+ 82
В) 125
С) 207
Д) 289
Е) 126
3.Сколько энергетических уровней в атоме Pb?
А) 5
В)+ 6
С) 7
Д) 8
Е) 9
4.Сколько электронов на энергетическом уровне с n =3?
А) 2
В) 8
С)+ 18
Д) 32
Е) 50
5.Сколько подуровней на энергетическом уровне с n=4?
А) 1
В) 2
С) 3
Д) + 4
Е) 5
6.Сколько электронов в атоме Pb на подуровне 4f?
А) 2
В) 6
С) 8
Д) + 14
Е) 18
7. Высшая степень окисления атома вольфрама
А) 2
В) 3
С) 4
Д)+ 6
Е) 7
8.Сколько и каких элементарных частиц образуют атом фтора 919F?
А) 9 нейтронов 10 протонов и 19 электронов
В) 9 нейтронов и 9 электронов
С) 9 протонов и 19 электронов
Д)+ 9 протонов,10 нейтронов и 9 электронов
Е) 10 протонов, 9 нейтронов, 9 электронов
9. Электронная конфигурация иона щелочного металла - 1S22P63S23P6 Это ион:
А) рубидия
В)+ калия
С) натрия
Д) лития
Е) цезия
10.Каковы а) валентность и б) степень окисления азота в азотной кислоте
А)+ а) IҮ б) +5
В) а) III б) -3
С) а) Ү б) +5
Д) а) IҮ б) +3
Е) а) IҮ б) +4
11. Что такое электронная орбиталь?
А)+ область в пространстве, где наиболее вероятно нахождение электрона
В) траектория, по которой электрон движется в атоме
С) набор четырех квантовых чисел
Д) функция, которая описывает вероятность нахождения электрона в каждой области
пространства
Е) это магнитное квантовое число
12. Сколько квантовых чисел ( и каких) описывают состояние электрона в атоме?
А) одно (n)
В) два (n,e)
С) три (n,l,ml)
Д)+ четыре(n,l mL,ms)
Е) пять ( n, l, mL, ms S)
13. Главное квантовое число характеризует:
А) молекулярную орбиталь
В) ориентацию орбитали в пространстве
С) число электронов в атоме
Д)+общую энергию электрона в атоме
Е) собственный момент импульса
14. Распределение электрона по орбиталям в основном состоянии атома определяется:
А) принципом запрета Паули
В) правилом Хунда
С) принципом наименьшей энергии
Д)+ принципом запрета Паули, правилом Хунда и принципом наименьшей энергии
Е) принципом наименьшей энергии и правилом Хунда
15.Какой из атомов в основном состоянии содержит два неспаренных электрона на внешнем уровне?
А) кислород
В) гелий
С)+ углерод
Д) магний
Е) аргон.
16. Строение внешней электронной орбитали ns1 характерно для элементов:
А)+ Na и К
В) Со и Ni
С) Сa и Вa
Д) CI и Br
Е) I и CI
17. Строение внешней электронной орбитали ns2 характерно для элементов:
А) Na и K
B) K и Li
C)+ Mg и Ca
Д) Br и I
E) Al и B
18.Строение внешней электронной орбитали ns2np1 характерно для элементов:
А) Na и Mg
В) K и Ca
С) Са и Sr
Д)+ Al и B
E) Mg и Ca
19. Строение внешней электронной орбитали ns2np2 характерно для элементов:
А) Na и K
В)+ С и Si
C) Mg и Ca
Д) Са и Sr
E) Al и B
20. Строение внешней электронной орбитали ns2np3 характерно для элементов:
A)+ N и P
B) K и Na
C) Ca и Mg
Д) Al и Ga
E) I и At
21. Строение внешней электронной орбитали ns2np4 характерно для элементов:
А) Na и Cs
В) I и At
С) Ca и Mg
Д) Al и B
Е)+ S и O
22. Строение внешней электронной орбитали ns2np5 характерно для элементов:
А) Na и Rb
В) K и Cs
С) +I и Cl
Д) Al и Ga
Е) S и O
23. Строение внешней электронной орбитали ns2np6 характерно для элементов:
А)+ Ne и Ar
В) Са и Sr
С) I и Cl
Д) Al и B
Е) S и O
24.Выберите электронную формулу S – элемента:
А) 1s22s22p5
B) 1s22s22p6
C) +1s22s22p63s23p64s2
Д) 1s22s22p63s23p4
E) 1s22s22p63s23p6
25. Выберите электронную формулу p – элемента:
A) 1s22s22p63s2
B) 1s22s22p63s1
C) 1s22s22p63s23p64s2
D)+ 1s22s22p63s23p4
E) 1s22s22p63s23p64s1
26.Сколько всего электронов имеет частица Ва2+, если порядковый номер бария равен 56?
А) 58
В) 57
С) 56
Д) 55
Е) +54
27.Сколько всего электронов имеет частица I-, если порядковый номер йода равен 53?
А) 55
В) +54
С) 53
Д) 52
Е) 51
28.Сколько всего электронов имеет частица Fe3+, если порядковый номер железа равен 26?
А) 29
В) 27
С) 26
Д) 25
Е) + 23
29. В электронейтральном атоме число протонов всегда равно:
А) числу нейтронов.
В)+ числу электронов.
С) числу изотопов.
D) сумме чисел нейтронов и протонов.
Е) разности чисел нейтронов и протонов.
30. Атомы данного химического элемента превращаются в атомы другого элемента, если они:
А) теряют нейтроны.
В)+ теряют протоны.
С) теряют электроны.
D) приобретают протоны.
Е) приобретают электроны.
31. Нуклоны – общие название:
А) протонов и электронов.
В)+ протонов и нейтронов.
С) нейтронов и электронов.
D) стабильных нуклидов.
Е) ядра и электронов.
32. Нуклиды элемента называются:
А) нуклонами.
В) изомерами.
С)+ изотопами.
D) аллотропными модификациями.
Е) ядрами.
33. Когда электронейтральный атом превращается в анион, то его:
А) заряд ядра уменьшается.
В) заряд ядра увеличивается.
С) заряд ядра не изменяется.
D)+ возрастает число электронов в атоме.
Е) уменьшается число электронов в атоме.
34. Когда электронейтральный атом превращается в катион, то его:
А) заряд ядра уменьшается.
В) заряд ядра увеличивается.
С) заряд ядра не изменяется.
D) возрастает число электронов в атоме.
Е) + уменьшается число электронов в атоме.
Строение молекул. Химическая связь
1. Что такое химическая связь?
А) это притяжение электронов одних атомов к ядрам других атомов
В)+ взаимодействие ядер атомов, обусловливающих устойчивость молекулы в целом
С) обобществление электронных пар различными атомами
Д) образование молекулярных орбиталей из атомных
Е) образование ионных орбиталей из атомных.
2. Причина образования химической связи:
А) притяжение электронов
В) притяжение нейтронов
С) уменьшение общей энергии системы
Д)+ взаимодействие ядер атомов
Е) перекрывание электронных облаков
3.Сколько электронов участвует в образовании электронных связей в молекуле аммиака?
А) 8
В) + 6
С) 10
Д) 2
Е) 5
4.Сколько электронов участвует в образовании химических связей в молекуле хлорида аммония?
А) +8
В) 6
С) 10
Д) 2
Е) 5
5.Различают типы химических связей:
А) ковалентная и водородная
В) ионная и водородная
С) металлическая и водородная
Д) водородная, металлическая
Е)+ ковалентная, ионная, металлическая и водородная
6. Ковалентная связь характеризуется:
А) длиной и направленностью
В) энергией и направленностью
С) направленностью, длиной и энергией
Д) насыщаемостью, длиной и энергией
Е) + длиной, энергией, направленностью и насыщаемостью
7.Какой тип связи в молекуле Н2?
А) водородная
В)+ ковалентная неполярная
С) донорно-акцепторная
Д) Ван-дер-ваальсова
Е) ионная.
8.Какой тип связи в молекуле CI2?
А) водородная
В) + ковалентная неполярная
С) донорно-акцепторная
Д) Ван-дер-ваальсова
Е) ионная.
9.Какой тип связи в молекуле HCI?
А) ионная
В)+ ковалентная полярная
С) ковалентная неполярная
Д) донорно-акцепторная
Е) водородная
10.Какой тип связи в молекуле NH4CI?
А)+ донорно-акцепторная
В) ионная
С) ковалентная полярная
Д) ковалентная неполярная
Е) водородная
11.Какой тип связи в молекуле СН3СООН?
А) донорно-акцепторная
В)+ водородная
С) ионная
Д) ковалентная полярная
Е) ковалентная неполярная
12. Какой тип связи в молекуле С2Н5ОН?
А) ионная
В) ковалентная полярная
С)+ водородная
Д) донорно-акцепторная
Е) ковалентная неполярная.
13. Валентный угол между ядрами атомов в молекуле Н2О:
А)+ 104,500
В) 1000
С) 900
Д) 800
Е) 700
14. Валентный угол между ядрами атомов в молекуле NH3^
А) 1000
В)+ 107,30
С) 900
Д) 800
Е) 700
15. Молекула NH3 имеет форму:
А) равностороннего треугольника
В) угловую
С) тетраэдра
Д)+ правильной пирамиды
Е) ромба
16. Молекула ВСI3 имеет форму:
А)+ плоского треугольника
В) угловую
С) тетраэдра
Д) правильной пирамиды
Е) ромба
17. Молекула СН4 имеет форму:
А) равностороннего треугольника
В) +тетраэдра
С) угловую
Д) правильной пирамиды
Е) ромба
18. Валентность - это:
А)+ число химических связей, образованных данным атомом в соединении
В) степень окисления атома
С) число отданных электронов
Д) число принятых электронов
Е) число электронов, недостающих для получения устойчивой конфигурации
19. Степень окисления атома – это:
А) частичный заряд атома в молекуле
В) полный заряд атома в молекуле
С) число химических связей, образованных атомом в молекуле
Д)+ заряд атома в молекуле, вычисленный предположительно, что все связи – ионные
Е) окислительный потенциал атома, возведенный в некоторую степень
20.Как связаны степень окисления и валентность атома?
А) степень окисления всегда меньше валентности
В)+ степень окисления может быть равна валентности
С) степень окисления может быть больше валентности
Д) это одно и то же
Е) степень окисления и валентность могут быть равными нулю
21. Молекула, центральный атом которого находится в состоянии SP3- гибридизации имеет строение:
А)+ тетраэдр
В) равносторонний или равнобедренный треугольник
С) выпуклая треугольная пирамида
Д) квадрат
Е) прямоугольник
22.Если при образовании химической связи электроны лишь частично смещаются от одного взаимодействующего атома к другому, то образующаяся связь называется:
А) ионной
В) +ковалентной полярной
С) ковалентной неполярной
Д) водородной
Е) металлической
23.Если при образовании химической связи электроны в равной степени принадлежат обоим атомам, то образующаяся связь называется:
А) ионной
В) ковалентной полярной
С)+ ковалентной неполярной
Д) водородной
Е) металлической
24. Связь, образованная внешними электронами атомов металла в кристаллической решетке металла, называется:
А) ионной
В) ковалентной полярной
С) ковалентной неполярной
Д) водородной
Е)+ металлической
25. Связь, характерная для соединений, содержащих сильно полярные ковалентные связи между атомом водорода и элементом с высокой электроотрицательностью, называется:
А) ионной
В) ковалентной полярной
С) ковалентной неполярной
Д)+ водородной
Е) металлической.
26. Число пар электронов, участвующих в образовании связи, называется
А) гибридизацией
В) направленностью связи
С) насыщаемостью связи
Д) поляризуемостью связи
Е)+ кратностью связи
27. Расстояние между атомами, образующими связь, характеризуется величиной, называемой:
А) гибридизацией
В) направленностью связи
С) насыщаемостью связи
Д) поляризуемостью связи
Е)+ длиной связи
28. Молекулярная орбиталь в которой максимальная электронная плотность сосредоточена на прямой соединяющей ядра атомов, называется:
А) атомной
В) молекулярной
С)+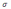 – орбиталью
– орбиталью
Д) π - орбиталью
Е) АО
29. Молекулярная орбиталь возникающая в результате бокового перекрывания
р- орбиталей взаимодействующих атомов , называется:
А) атомной
В) молекулярной
С)
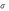 – орбиталью
– орбиталью
Д) + π – орбиталью
Е) АО
30.В соединениях атомов типичных металлов с типичными неметаллами имеет место связь:
А) + ионная
В) ковалентная полярная
С) ковалентная неполярная
Д) водородная
Е) металлическая
31. Ионная связь наблюдается в соединениях:
А) NH3
В) H2O
C) O2
D)+ NaCI
E) N2
32.Какая из перечисленных молекул не является полярной?
А) СО
В) СО2
С)+ SO2
D) N2
E) C2H4
33. Тип гибридизации электронов бериллия в молекуле ВеСI2, если угол между связями равен 1800:
А) +sp
B) sp2
C) sp3
D) f2
E) sp3d4
34.Какая из молекул характеризуется большей кратностью связей?
А) NH3
B) BF2
C) SO2
D) + N2
E) C2H4
35. Какая геометрическая конфигурация молекул соответствует sp2 гибридизации
А)+ треугольная
В) тетраэдрическая
С) угловая
Д) октаэдрическая
Е) квадрат
36. Тип гибридизации электронов углерода в молекуле СН4, если угол между связями равен 109028/:
А) sp
B) sp2
C) +sp3
D)sp3d2
E) sp3d4
37.Укажите молекулу с наименьшей кратной связью:
А) NH3
B) BF3
C)+ Н2
D) N2
E) О2
38. Какая геометрическая конфигурация молекул соответствует sp3d2 гибридизации?
А) треугольная
В) тетраэдрическая
С) угловая
Д) октаэдрическая
Е)+ пирамидальная.
39.Укажите полярную молекулу:
A) O2
B) N2
C) H2
D) F2
E)+ HF
40. Чему равна кратность связи в молекуле N2?
А) 0
В) 1
С) 2
Д) + 3
Е) 4
41.Укажите тип гибридизации в молекуле С2Н2:
А)+ sp
B) sp2
C) sp3
D)sp3d2
E) sp3d4
42.Какая геометрическая конфигурация молекул соответствует sp2d гибридизации?
А) плоская квадратная
В) тетраэдрическая
С) угловая
Д)+ октаэдрическая
Е) линейная.
43.Укажите неполярную молекулу:
А) Н2S
B) H2O
C) HF
D) NH3
E) +H2
44. Количественной характеристикой полярности связи молекул является величина:
А)+ дипольного момента
В) длина связи
С) энергия связи
Д) валентный угол
Е) электроотрицательность атома
45.Какая геометрическая конфигурация молекул соответствует sp –гибридизации
А) угловая
В) тетраэдрическая
С) октаэдрическая
Д) плоская квадратная
Е)+ линейная
46. Определите полярную молекулу:
А) H2
B) F2
C) O2
D) + NH3
E) N2
47. Укажите тип гибридизации атомов углерода в молекуле этилена С2Н4:
А) sp
B) + sp2
C) sp3
D)sp3d1
E) sp3d2
48. Сколько связывающих π -связей в молекуле F2?
А) 0
В) 1
С) 2
Д) + 3
Е) 4
49. Определите наибольшую кратность связи в молекуле?
А) NH3
B) BF3
C)+ SO2
D) C2H2
E) O2
50.Между какими молекулами возникает водородная связь?
А) NaBr и HCI
В) Li и H2CO3
С) H 2C и H2O
Д) SO2 и H2O
Е) + CH3OH и H2O
51.В каких соединениях существует водородная связь?
А)+ CH3COOH
B) NaCI
C) H2SO4
D) C2H2
E) Fe2O3
Термодинамика
1. Термодинамическая система, состоящая из двух или нескольких отличающихся фаз, между которыми есть поверхность раздела, называется:
А) открытой
В) закрытой
С) изолированной
Д) гомогенной
Е)+ гетерогенной
2. Система «разбавленный раствор глюкозы в открытом стакане» является:
А) грубодисперсной
В) гетерогенной
С) изолированной
Д) закрытой
Е) +открытой
3. Система « 0,9 % раствор NaCI в запаянной ампуле» является:
А) грубодисперсной
В) гетерогенной
С) изолированной
Д)+ закрытой
Е) открытой
4. Функция состояния, характеризующая энергосодержание системы в изобарно-изотермических условиях, это:
А) температура
В) давление
С) + энтальпия
Д) энтропия
Е) энергия Гиббса
5. Количество теплоты, выделяющееся или поглощающееся в результате химической реакции в изобарно-изотермических условиях, называется:
А) температурным коэффициентом
В) + тепловым эффектом реакции
С) стандартной теплотой разложения
Д) стандартной теплотой образования
Е) стандартной теплотой нейтрализации
6. «Теплота разложения какого-либо химического соединения равна по абсолютной величине и противоположна по знаку теплоте его образования» - это формулировка:
А) первого начала термодинамики
В) второго начала термодинамики
С)+закона Лавуазье - Лапласа
Д) закона Гесса
Е) следствия из закона Гесса
7. Выберите математическое выражение закона Лавуазье-Лапласа:
А) Q = ∆U + A
B) + ∆Hd = -∆Hf
C) Qv = ∆U
D)
Qp
= 
E) ∆Hd = ∆Hf
8. Термодинамическая система, внутри которой нет поверхности раздела фаз, а свойства одинаковы в каждой точке системы, называется:
А) + гомогенной
В) гетерогенной
С) изолированной
Д) открытой
Е) закрытой
9. Тепловой эффект реакции образования 1 моль вещества из простых веществ
при Т = 298,15К и р =101,325кПа, называется:
А) теплотой образования
В) + стандартной теплотой образования
С) теплотой сгорания
Д) теплотой нейтрализации
Е) теплотой разложения
10. Термодинамическая система, состоящая из двух и более фаз, отличающихся по свойствам и имеющих поверхность раздела, называется:
А) изолированной
В) закрытой
С) открытой
Д) + гетерогенной
Е) гомогенной
11.Из приведенных термодинамических систем выберите гомогенную:
А) человек
В) растение
С)+ раствор сахара в воде
Д) система « твердая вода - жидкая вода»
Е) система « жидкая вода – газообразная вода»
12.Из приведенных термодинамических систем выберите гетерогенную:
А) камень
В) разбавленный раствор сахара в воде
С) разбавленный раствор глюкозы в воде
Д) разбавленный раствор NaCI в воде
Е)+ система «жидкая вода - лед»
13. Термодинамическая система, которая обменивается с окружающей средой массой (веществом) и энергией называется:
А) +открытой
В) закрытой
С) изолированной
Д) гомогенной
Е) гетерогенной.
14. Термодинамическая система, которая обменивается с окружающей средой энергией,
но не обменивается массой, называется:
А) открытой
В) +закрытой
С) изолированной
Д) гомогенной
Е) гетерогенной
15.Выберите закрытую термодинамическую систему:
А) человек
В) растение
С)+ остывающий камень
Д) термос
Е) живая клетка
16.Какая из приведенных формул является математическим выражением первого закона
термодинамики?
А)
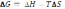
B) + Q = ∆U+ p∆V
C) PV = m/Nx RT
D) ∆S = Qобр/T
E) V = k CаА СbB
17.Для изобарного процесса:
А) + p = const
B) T = const
C) V = const
D) m = const
E) H = const
18.При изохорном процессе в термодинамических системах не изменяется:
А) давление
В) температура
С)+ объем
Д) внутренняя энергия
Е) энтальпия
19.По какой формуле определяется тепловой эффект изобарного процесса Qp?
А) Qp = ∆G -T∆S
B) Qp = ∆U
C)+ Qp = ∆H
D) Qp = p∆V
E) Qp = U + p∆V
20. Изучением тепловых эффектов химических реакций занимается:
А) термодинамика
В) биохимия
С) химическая кинетика
Д) + термохимия
Е) электрохимия
21.В эндотермических реакциях:
А) скорость химической реакции увеличивается при понижении температуры
В)+ энтальпия реакции увеличивается ( Н >O)
С) тепловой эффект реакции положителен (Q>O)
Д) для достижения равновесия требуется катализатор
Е) Для достижения равновесия требуется ингибитор
22.Для эндотермической реакции:
А)+ Q<0 ∆H> 0
B) Q<0 ∆H<0
C) Q>0 ∆H>0
D) Q=0 ∆H< 0
E) Q>0 ∆H=0
23. Экзотермической называется реакция, при которой:
А) Q<0 ∆H< 0
B) + Q>0 ∆H<0
C) Q>0 ∆H>0
D) Q<0 ∆H>0
E) Q=0 ∆H>0
24. Приведенная ниже формулировка «Энтальпия химической реакции равна сумме стандартных теплот образования продуктов реакции за вычетом суммы теплот образования исходных веществ с учетом стехиометрических коэффициентов» соответствует:
А) первому закону термодинамики
В) закону Рауля
С) закону Лавуазье- Лапласа
Д) + первому следствию закона Гесса
Е) Второму закону термодинамики
25.Выберите математическое выражение первого следствия из закона Гесса:
А) Qp = ∆H
В)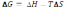
С) ∆S = Qобр/T
Д)+ ∆Hpo = ∑∆Ho обр.продуктов - ∑∆Ho обр. веществ исх.
Е) ∆U = U2 – U1
26. Энтропия термодинамической системы не изменится в процессе протекания
химической реакции:
А) HCI + NH3→NH4CI
B) C2H5OH + 3O2→2CO2+ 3H2O
C) NI3 NH3→N2+ 3HI
D) + H2 + CI2→2HCI
E) 2CO + O2→ 2CO2
27.Энтропия термодинамической системы увеличивается в процессе протекания химической реакции:
А) 2N2O + 4O2→2N2O5
B) 3H2+ N2→2NH3
C)4HCI + O2→2CI2 + 2H2O
D)N2+ O2→2NO
E) + 2H2O2→2H2O + O2
28. Человек является термодинамической системой:
А) открытой гомогенной
В) закрытой гетерогенной
С) изолированной гомогенной
Д) + открытой гетерогенной
Е) закрытой гомогенной
29. Гетерогенная термодинамическая система:
А) однородна
В) имеет одну фазу
С) не содержит поверхности раздела фаз
Д)+ содержит поверхности раздела фаз
Е) одинакова по свойствам в каждой точке.
