- •3) Периодический закон д.И. Менделеева. Периодическая система элементов. Электроотрицательность. Закономерности изменения ее по периодам и группам элементов периодической системы.
- •5) Химическая связь. Ковалентная связь. Свойства ковалентной связи: прочность, полярность, насыщаемость, направленность, гибридизация, кратность.
- •6) Кс. Гибридизация атомных орбиталей. Водородная и донорно-акцепторная связь.
- •9) Энергетические эффекты химических реакций. Энтальпия. Закон Гесса. Следствия из закона Гесса. Расчет теплового эффекта химической реакции.
- •10) Энтропия. Энергия Гиббса. Термохимические расчеты.
- •11) Химическая кинетика и равновесие. Скорость химических реакций. Закон действия масс. Влияние температуры (закон Вант-Гоффа).
- •14) Химическое равновесие. Константа равновесия. Сдвиг равновесия. Принцип Ле-Шателье.
- •15) Растворы. Способы выражения концентрации растворов.
- •16) Свойства растворов неэлектролитов. Давление пара. Криоскопия и Эбуллиоскопия. Осмотическое давление.
- •17) Теория электролитической диссоциации. Степень диссоциации. Сильные и слабые электролиты. Константа диссоциации. Закон разведения Оствальда.
- •19) Ионообменные реакции. Направление протекания реакции. Произведение растворимости.
- •20) Ионное произведение воды. Водородный показатель. Индикаторы.
- •22) Гидролиз солей. Степень и константа гидролиза.
- •23) Окислительно-восстановительные реакции (овр). Степень окисления атомов Основные окислители и восстановители. Составление уравнений овр методами электронного и электронно-ионного баланса.
- •24) Электрохимические процессы. Стандартный электродный потенциал. Ряд напряжений металлов. Гальванические элементы.
- •26) Электролиз расплавов и растворов солей.
- •28) Коррозия металлов. Электрохимическая коррозия. Протекторная и электрохимическая защита металлов от коррозии.
- •Протекторная защита от коррозии
- •29) Дисперсные системы. Классификация по различным признакам. Поверхностные явления. Строительные материалы.
- •36) Классификация органических соединений.
5) Химическая связь. Ковалентная связь. Свойства ковалентной связи: прочность, полярность, насыщаемость, направленность, гибридизация, кратность.
В зависимости от типов атомов, образующих химическую связь, выделяют и типы химической связи: ковалентную, ионную, металлическую и др.
Химическая связь возникает благодаря взаимодействию электрических полей, создаваемых электронами и ядрами атомов, участвующих в образовании молекулы или кристалла. Химическая связь образуется, если электроны взаимодействующих атомов получают возможность двигаться одновременно вблизи положительных зарядов нескольких ядер.
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью. Ковалентная связь существует между атомами как в молекулах, так и в кристаллах. Характерными особенностями ковалентной связи являются её насыщаемость и направленность. Насыщаемость ковалентных связей обусловлена тем, что в химическом взаимодействии участвуют электроны только внешних энергетических уровней, т. е. ограниченное число электронов.
Особенности КС:
Прочность КС – это свойства характер длинной связи (межъядерное пространство) и энергии энергией связи.
Полярность КС. В молекулах, содержащих ядра атомов одного и того же элемента, одна или несколько пар электронов в равной мере принадлежат обоим атомам, каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью.
Если пара электронов, образующих химическую связь, смещена к одному из ядер атомов, то связь называют полярной ковалентной связью.
Насыщаемость КС – это способность атома участвовать только в определенном числе КС, насыщаемость характеризует валентностью атома. Количественные меры валентности явл. число не спаренных электронов у атома в основном и в возбужденном состоянии.
Направленность КС. Наиболее прочные КС образуются в направлении максимального перекрывания атомных орбиталей, т.е. мерой направленности служит валентный угол.
Гибридизация КС – при гибридизации происходит смещение атомных орбиталей, т.е. происходит выравнивание по энергии и по форме. Существует sp, sp2, sp3 –гибридизация. sp – форма молекулы линейная (угол 1800), sp2 – форма молекулы плоская треугольная (угол 1200), sp3 - форма тетраэдрическая (угол 109028).
Кратность КС или делоколизация связи – Число связей, образующихся между атомами, называется кратностью (порядком) связи. С увеличением кратности (порядка) связи изменяется длина связи и ее энергия.
6) Кс. Гибридизация атомных орбиталей. Водородная и донорно-акцепторная связь.
Химическая связь между атомами, осуществляемая обобществленными электронами, называется ковалентной связью.
Донорно-акцепторный механизм: образуется общая электронная пара за счёт неподелённой пары электронов одного атома и вакантной орбитали другого атома.
Акцептор – атом, участвовавший в обобществлении пары за счет свободной орбитали. Донор – атом, отдающий электроны.
Водородная связь. Межмолекулярные взаимодействия. Атом водорода в соединении с атомом элемента с высокой электроотрицательностью (F, O, N и др.), способен к образованию водородной связи. В такой молекуле электронная пара сильно смещена от водорода и он, в отсутствии электронов, представляет собой положительно заряженный протон, который притягивается отрицательно заряженными концами диполей или анионами. В результате образуется более слабая, чем ковалентная (в 10- 15 раз) связь, называемая водородной. Для этой связи характерны насыщаемость и направленность. Эта связь обозначается тремя точками. Водородная связь существует между молекулами многих органических соединений (фенолов, карбоновых кислот, спиртов, альдегидов и др.) и играет важную роль в жизненно важных биохимических процессах. В веществах с молекулярной структурой проявляются силы межмолекулярного взаимодействия - Ван-дер-Ваальсовы силы(1873). В основе этих сил лежит электростатическое взаимодействие молекулярных диполей. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ - взаимодействие между молекулами с насыщенными химическими связями. Имеет электрическую природу.
Гибридиз – смешение ат-х орбиталей с разными, но близкими е-сост-ми.
Число образующихся гибридных орбиталей всегда равно обшему числу исходных атомных орбиталей , учавствующих в гибридизации.
7)_
Классификация неорганических соединений
По
функциональным признакам неорганические
соединения подразделяются на классы в
зависимости от характерных функций,
выполняемых ими в химических ре акциях.
Сложные вещества (неорганические) : 1)
оксиды ; 2) основания ; 3) кислоты ; 4) соли
.
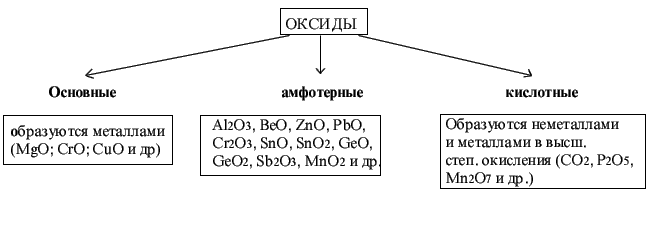
Оксиды
- это сложные вещества, в состав которых
входят атомы кислорода и какого-либо
другого элемента (ЭХОY).
Степень окисления кислорода в оксидах
равна -2. Например, Fe2O3
- оксид железа (Ш); CгO - оксид хрома (II) или
оксид хрома (+2). Оксиды : Основными
оксидами
называются такие, которые при взаимодействии
с кислотами образуют соль и воду.
Соединения этих оксидов с водой относят
к классу оснований (например, оксиду
Na2O
соответствует основание NaOH).Кислотными
оксидами
называются такие, которые при взаимодействии
с основаниями образуют соль и воду.
Соединения этих оксидов с водой относят
к классу кислот (например, оксиду P2O5
соответствует кислота H3PO4,
а оксиду Cl2O7
- кислота HClO4).К
амфотерным оксидам относятся такие,
которые взаимодействуют с кислотами и
основаниями с образованием соли и воды.
Соединения этих оксидов с водой могут
иметь как кислотные, так и основные
свойства (например, амфотерному оксиду
ZnO соответствует основание Zn(OH)2
и кислота H2ZnO2).Характерной
особенностью оксидов является способность
их к образованию солей. Поэтому такие
оксиды относятся к солеобразующим.
Наряду с солеобразующими существуют и
несолеобразующие, или безразличные,
оксиды, которые не образуют солей.
Примером могут служить CO, N2O,
NO. Амфотерные
оксиды
взаимодействуют как с кислотами, так и
с основаниями собразованием соли и
воды: ZnO
+ 2HCl = ZnCl2
+ H2O
;ZnO + 2NaOH = Na2ZnO2
+ H2O
или ZnO
+ 2NaOH
+ H2O
= Na2[Zn(OH)4].
Основания (гидроксиды) - сложные
вещества, в состав которых входят атомы
металлов (катионов) и одна или несколько
гидроксильных групп - Ме(ОН)n.
Число гидроксогрупп в молекуле основания
зависит от валентности металла и обычно
равно ей. Например, Cu(OH)2
- гидроксид меди (II), Fe(OH)3
- гидроксид железа (Ш). Амфотерные
- образуют соли при взаимодействии как
с кислотами, так и с основаниями. При
взаимодействии с кислотами амфотерные
гидроксиды проявляют свойства Be(OH)2
+ 2HCl
= BeCl2
+ 2H2O
; Be(OH)2
+ 2KOH
= K2BeO2
+ 2H2O.
Кислоты
- сложные вещества, в состав которых
входят катионы водорода, способные
замещаться на катионы металлов, и
кислотные остатки (анионы). В зависимости
от числа атомов водорода в молекуле
кислоты, способных замещаться на металл,
кислоты делятся на одно
- и многоосновные.
Например, HCl(соляная) и HNO3
(азотная) - одноосновные, H2SO4
(серная) - двухосновная, H3PO4
(фосфорная) - трехосновная. По составу
кислотные остатки делятся на
кислородсодержащие
и бескислородные.
Например, HNO3,
H2SO4
и все остальные кислоты, в состав которых
входит кислород, относятся к
кислородсодержащим. Кислоты типа HCl,
H2S
являются бескислородными.
Химимические свойства кислот
: Водные растворы кислот взаимодействуют
с металлами, стоящими в ряду напряжения
до водорода, с образованием соли и
выделением водорода (исключение HNO3)
:
Zn + 2HCl = ZnCl2
+ H2
.
Кислоты
взаимодействуют с основными оксидами
и основаниями с образованием соли и
воды: CuO
+ H2SO4
= CuSO4
+ H2O;
NaOH + HCl = NaCl + H2O
(реакция нейтрализации). Кислоты
взаимодействуют с амфотерными оксидами
с образованием соли и воды:
Cr2O3
+ 6HCl = 2CrCl3
+ 3H2O.
При
нагревании некоторые кислоты разлагаются.
Как правило, образуется кислотный оксид
и вода: H2SiO3
= SiO2
+ Н2О.
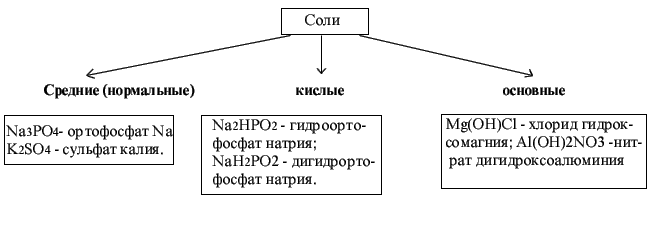
Соли -
это продукты полного или частичного
замещения атомов водорода в кислоте на
атомы металла или гидроксогрупп в
основании на кислотные остатки. В случае
полного замещения образуются средние
(нормальные соли). В случае частичного
замещения получаются кислые и основные
соли.
Средние соли образуются
при взаимодействии кислот с основаниями,
когда количеств взятых веществ достаточно
для полного замещения атомов водорода
в кислоте на атом металла или гидроксильных
групп в основании на кислотный остаток:
Al(OH)3
+ 3HCl
= AlCl3
+ 3H2O.
хлорид
Al
Кислые
соли образуются
многоосновными кислотами при взаимодействии
кислот с основаниями в тех случаях,
когда количество взятого основания
недостаточно для образования средней
соли, например: H2SO4
+ NaOH = NaHSO4
+ H2O
гидросульфат Na
.Основные
соли могут
быть образованы только многокислотными
основаниями и в тех случаях, когда
взятого количества кислоты недостаточно
для образования средней соли, например:
Fe(OH)3
+ H2SO4
= FeOHSO4
+ 2H2O сульфат
гидроксо железа (Ш).
При добавлении к основной соли кислоты,
можно получить среднюю, например:2FeOHSO4
+ H2SO4
= Fe2(SO4)3
+ 2H2O
сульфат Fe(Ш)