
Хим_равновесие
.pdf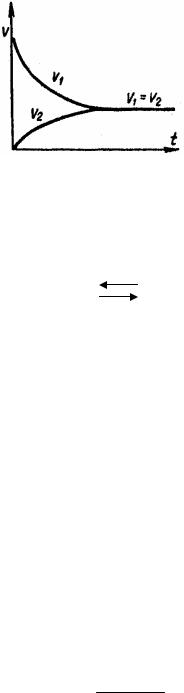
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
Необратимые и обратимые реакции. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ, то есть в одном направлении. Обратимые реакции протекают не до конца: при обратимой реакции ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что обратимая же реакция может протекать как в прямом, так и в обратном направлениях. Например:
Взаимодействие между цинком и концентрированной азотной кислотой протекает согласно уравнению и является необратимым:
Zn + 4HNО3 = Zn(NО3)2 + 2NO2 + 2H2O
Синтез аммиака является обратимой реакцией и протекает согласно уравнению: N2 + ЗН2 → 2NH3 .
Химическое равновесие называют динамическим равновесием. При равновесии протекают и прямая, и обратная реакции, но их скорости одинаковы, вследствие чего изменений в системе не наблюдается.
Количественной характеристикой химического равновесия служит константа химического равновесия. Рассмотрим ее на примере реакции синтеза йодистого водорода:
Н2 + I2 |
2НI |
Согласно закону действия масс, скорости прямой (V1) и обратной (V2) |
|
реакций выражаются уравнениями: |
|
V1 = k1[H2][I2] ; |
V2 = k2[HI]2 |
При равновесии скорости прямой и обратной реакций равны друг другу, откуда
V1 = V2 ; k1[H2][I2] = k2[HI]2
k1 |
= |
|
[HI ]2 |
|
k2 |
[H 2 ][I2 ] |
|||
|
||||
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции (К):
k1 |
= K |
K = |
[HI ]2 |
|
k2 |
[H 2 ][I2 ] |
|||
|
|
В левой части этого уравнения стоят равновесные концентрации. Правая же часть уравнения представляет собой постоянную (при постоянной температуре) величину. Можно показать, что в общем случае обратимой реакции
аА + bВ + ... ↔ pP + qQ +...
константа равновесия выразится уравнением:
K =
[P]p [Q]q ...
[ A]a [B]b ...
В условиях равновесия концентрации всех веществ, участвующих в реакции, связаны между собою. Изменение концентрации любого из этих веществ влечет за собою изменения концентраций всех остальных веществ; в итоге устанавливаются новые концентрации, но соотношение между ними вновь отвечает константе равновесия.
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. (Выходом реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца.) Например, при К >>1 выход реакции велик, потому что при этом
[P]p[Q]q…>> [A]a[B]b…
т.е. при равновесии концентрации продуктов реакции много больше концентраций исходных веществ, а это и означает, что выход реакции велик. При К. << 1 (по аналогичной причине) выход реакции мал.
В случае гетерогенных реакций в выражение константы равновесия, так же как и в выражение закона действия масс, входят концентрации только тех веществ, которые находятся в газовой или жидкой фазе. Например, для реакции
СО2 + С = 2СО |
[CO]2 |
||
K = |
|
||
[CO2 ] |
|||
|
|
||
Величина константы равновесия зависит от природы реагирующих веществ и от температуры.
Связь константы равновесия с энергией Гиббса даётся уравнением: G = - RT×ln Kp (кДж/моль).
Если Кр >1 (k1>k2) , то равновесие смещено вправо, и G<0; если же Кр <1 (k1<k2) , то равновесие смещено влево, и G<0.
Смещение химического равновесия. Принцип Ле Шателье - Брауна
Если условия процесса изменятся, то система выйдет из равновесия – скорости прямого и обратного процессов изменятся неодинаково – будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции.
При увеличении концентрации какого-либо из веществ, участвующих в процессе, равновесие смещается а сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы). Когда в реакции участвуют газы, равновесие может нарушаться при изменении объема системы. Рассмотрим влияние давления на реакцию синтеза аммиака
N2 + ЗН2 ↔ 2NH3 .
Не изменяя температуры, уменьшим в 2 раза объем системы. В первый момент парциальные давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакций
–равновесие нарушится.
Всамом деле, до увеличения давления концентрации газов имели
равновесные, значения [Н2]равн, [N2]равн и [Н2]равн, а скорости прямой и обратной реакций определялись уравнениями:
W1=k1[N2]p[H2]p3 ; W2=k2[NH3]p2
W1' =k1×2[N2]p×(2[H2]p )3 = 16×k1×[N2]p[H2]p3 = 16W1 ; W2' = k2× (2[NH3]p )2 = 4×k2[NH3]p2 = 4W2
В результате увеличения давления скорость прямой реакции возросла в 16 раз, а обратной только в 4 раза. Равновесие в системе нарушится – прямая реакция будет преобладать над обратной. После того как скорости сравняются, вновь установится равновесие, но количество аммиака в смеси возрастет – равновесие сместится вправо.
Реакция, протекающая с увеличением числа молекул газов, приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов, – к его понижению. При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т.е. в сторону уменьшения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т.е. в сторону увеличения давления.
Нарушение равновесия вследствие изменения температуры. Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры, что определяется знаком теплового эффекта реакции. Можно показать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении – в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию
N2 + ЗН2 ↔ 2NH3 + 89 кДж
При повышении температуры равновесие в системе сдвигается влево – в сторону разложения NH3, так как этот процесс идет с поглощением теплоты.
Наоборот, синтез окиси азота является эндотермической реакцией: N2 + O2 ↔ 2NO - 178 кДж
При повышении температуры равновесие в этой системе сдвигается вправо
– в сторону образования NO.
Принцип Ле-Шателье – Брауна, в применении к химическому равновесию:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Принцип Ле-Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов как кипение, кристаллизация, растворение происходят в соответствии с принципом Ле-Шателье.
