
Билет№18
2KOH(р-р)+H2SO4(р-р)→K2SO4(р-р)+2H2O(ж) 2K(+)+2OH(-)+2H(+)+SO4(2-)→2K(+)+SO4(2-)+2H2O(ж) 2OH+2H→2H2O Дельта H обр.=2delta H(H2O)-2deltaH(OH)-2deltaH(H)= -2*285,83+460,04= -111,62
Закон Гесса (математическое следствие закона сохранения энергии=1ый з-н термодинамики Тепловой эффект химической реакции, если она протекает при постоянных V,T или P,T, не зависит от пути, а определяется лишь начальным и конечным состоянием системы. . Q=U+А Следствие Гесса: Тепловые процессы эффекты, образования, горения, растворение в фазовых переходах отнесенные к стандартному переходу, представляют собой данные для термохимических расчетов. Тепловой эффект любой реакции = разности теплот образования продуктов и исходных в-тв с учетом стехиометрических коэффициентов. νАА+ νВВ= νСС+ νDD ; Δ Н 0реакции= νС Δ Н 0обр С+ νD Δ Н 0обр D - νА Δ Н 0обр А- νВ Δ Н 0обр В ; Δ Н 0реакции= ∑νпродукт Δ Н 0обр - ∑νисх.в-тв Δ Н 0обр , где Δ Н 0обр – справочные данные Энтальпия (H) — мера порядка системы. H = U + pV, Q = H. Энтальпия — функция состояния. Энтальпия – сумма внутр. энергии и работы расширения или сжатия. Стандартная энтальпия р-ции – тепл. эф-т р-ции, в котором исходные в-ва и продукты р-ции находятся в стандартном сост. Стандартная энтальпия образования вещества (H0): изменение энтальпии в процессе образования 1 моля вещества из простых веществ, взятых при НУ (устойчивых при 298 К и давлении 100 кПа.) в наиболее стабильной модификации. Зависит от ЭО атомов в соединении. Чем больше ЭО, тем отрицательнее H. Энтальпию образования прост. в-в, устойчивых при 298 К и давлении 100 кПа, принимают =0.
H0 — характеристика реакционной способности и устойчивости вещества: Чем отрицательнее H0, тем вещество более устойчиво и менее реакционноспособно. H = 0 — простые вещества, устойчивые при стандартных условиях. H > 0 — неустойчивые и взрывоопасные. Характеризует тепловой эффект реакции: H0 < 0: экзотермическая реакция, выделение тепла, U < 0. H0 > 0: эндотермическая реакция, поглощение тепла, U > 0.
Если р-ия протекает в водном р-ре, то термодинамические расчеты(H,S,G)проводятся по ионно-молекулярному ур-ю, сокращенному, т.к. энергетическое состояние в-ва в твердой кристалической форме и в форме р-ра не эквивалентны. Процесс образования сопровождается разрушением хим связей за счет гидротации ионов. Δ Н 0реакции= νС Δ Н 0обр С+ νD Δ Н 0обр D - νА Δ Н 0обр А- νВ Δ Н 0обр В Δ Н 0реакции= ∑νпродукт Δ Н 0обр - ∑νисх.в-тв Δ Н 0обр , где Δ Н 0обр – справочные данные
2)Li+H2→2LiH Zr+H2→ZrH2 ZrH2→Zr+H2 ZrH2+H2O→Zr(OH)2+2H2 CaH2+H2O→Ca(OH)2+2H2 C+2H2O→C(OH)2+H2 N2+3H2↔2NH3, 3)C(H2)=9,C(N2)=3,C(NH3)=4 Kравн=4^2/3*9^3=7,3^10^(-3) С(H2)ish=C(H2)+C(NH3)=9+4=13 C(N2)ish=C(N2)+C(NH3)=3+4=7
Билет№19
Расчет концентрации ионов H(+) в растворе слабой кислоты по константе диссоциации на примере CH3COOH (C(CH3COOH)=0,1моль/л, Кд(CH3COOH)=1,7*10^(-5)).
CH3COOH→CH3COO(-)+H(+), где C(CH3COO)=C(H)=x Кд=x*x/C, x=sqrt(C*Кд)=1,3*10^(-3) Химическое равновесие – это динамическое состояние обратимых процессов, при которой скорость прямой реакции = скорости обратной реакции, а соотношение количеств реагентов и продуктов во времени не меняется. Количественно диссоциацию слабых электролитов выражают с помощью

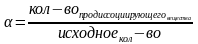 <<1
и Kд<1
Слабые кислоты и сл основания диссоц-ют
обратимо, равновесно, по ступеням, при
чем каждая последующая ступень протекает
слабее предыдущей. Количественно дис
сл электролитов выражается: α(степень
эл дисс)=кол-во продисс-их/исходное
кол-во Кд
– константа дисс-ии (конст равновесия)
α<<1 Кд<1
<<1
и Kд<1
Слабые кислоты и сл основания диссоц-ют
обратимо, равновесно, по ступеням, при
чем каждая последующая ступень протекает
слабее предыдущей. Количественно дис
сл электролитов выражается: α(степень
эл дисс)=кол-во продисс-их/исходное
кол-во Кд
– константа дисс-ии (конст равновесия)
α<<1 Кд<1
Диссоциация слабых кислот
CH3COOH↔CH3COO-+Н+
;
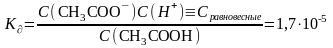
1ст. H3AsO4↔H++ H2AsO4- Кg1= C(H2AsO4-)*C(H+)/C(H3AsO4)=6*10-3 2ст. H2AsO4↔H++ HAsO4-2 Кg2=1*10-8
3ст. HAsO4↔H++ AsO4-3 Кg3=3*10-12 Кg1> Кg2 >Кg3> α1> α2> α3
Диссоциация сл оснований протекает аналогично NH4OH↔NH4++OH-Кд=1,7*10-5 pH+pOH=14 ; pH=-lg C(H+) ; pOH=14-pH pH<7 кис среда ; pH>7 щел среда Константа диссоциации. Константа диссоциации — вид константы равновесия, которая показывает склонность к диссоциации.
Диссоциация протекает с участием полярных молекул Н2О. Чем их больше, тем в большей степени протекает диссоциация.
Закон: -степень эл. диссоциации слабых электролитов, увеличивается при разбавлении раствора.
; -степень эл.диссоциации слабых электролитов ; Со - исх ; – продиссоциир. вещества
Со- - не диссоциир. Вещества;
2)UO2SO4+Na2CO3(изб)→Na6[UO2(CO3)4]+Na2SO4 КЧ=8 Ce2(SO4)3+3Na2(CO3)(изб)→Ce2(CO3)3+3Na2SO4
Fe2(SO4)3+3Na2CO3+3H2O→ 2Fe(ОН)3 + 3СО2 + 3Na2SO4 Eu2(SO4)3+Zn→ 2EuS04 + ZnS04.
UO2(SO4)+2NaF→UF2+Na2SO4+O2 Th(SO4)2+4NaF→ThF4+2Na2SO4
3)Порог Коагуляции – наименьшая концентрация электролита, вызывающая коагуляцию. Спор=1/Z^6 Из этого следует ,что коагулянтом является тот ион, который обладает наибольшей концентрацией. C(NaCl)=300, C(CaCl2)=25, C(AlCl3)=0,5 Поэтому NaCl является коагулянтом
