
Билет№10
Раствор-это многокомпонентная гомогенная система переменного состава. Сольватацией называется процесс взаимодействия между частицами растворенного вещества и растворителя. Сольватация может состоять из нескольких стадий протекающих последовательно или одновременно: молекулярная диссоциация, образование сольватов, ионизация и электролитическая диссоциация. Частным случаем сольватации является Гидратация – взаимодействие растворенного вещества с водой. Молекулы растворителя при сольватации не разрушаются. Большинство сольватов являются малоустойчивыми соединениями. Однако некоторые вещества удерживают воду, будучи в твердом состоянии (кристаллогидраты), например CuSO4*5H2O – медный купорос. Ассоциация — взаимодействие молекул/ионов растворённого вещества друг с другом (в чистых жидкостях и концентрированных растворах). Возможен, если HAX–S < HAX–AX или HAX–S < HS–S. Процесс распада электролитов на ионы в водных растворах и расплавах называется электролитической диссоциацией. Роль сольватации в процессе диссоциации:пр.сольв.(гидр) сопровождается выделением энерг. ,
К-я компенс-т затраты энерг при дисс(на разрыв связей) Закон разбавления Оствальда.
Закон:
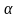 -степень эл. диссоциации слабых
электролитов, увеличивается при
разбавлении раствора.
-степень эл. диссоциации слабых
электролитов, увеличивается при
разбавлении раствора.
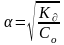 ;
;
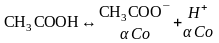 -степень эл.диссоциации слабых
электролитов ; Со - исх ;
-степень эл.диссоциации слабых
электролитов ; Со - исх ;
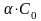 – продиссоциир. вещества
– продиссоциир. вещества
Со-
- не диссоциир. Вещества;

2.3U + 4O2 = U3O8 UO2SO4+Zn+2H2SO4=U(SO4)2+ZnSO4+2H20 U(SO4)2+4NH4F=UF4+2(NH4)2SO4 UF4 + 2Ca = U + 2CaF2
UO2SO4+4NaCO3=Na6[UO2(CO3)4]+Na2SO4
3. [Ag(NH3)2]Ag+ +2NH3 Kn([Ag(NH3)2]+) = [Ag+] [NH3]2 / [[Ag(NH3)2]+] C[Ag+]=x моль/л C[NH3]=(1+2X) моль/л
C[Ag[NH3)2+]=(0,1-X) моль/л Kn=(x(1+2x)^2)/(0,1-x)=6,8*10^-8,no t.k. x<<1 0,1-x=1,(1+2x)=1 Kn=(x*1^2)/0,1 x=6,8*10^-9 моль/л C[Ag+]=6,8*10^-9 моль/л
Билет 11
Реальное в-во – в-во со всякими примесями. Концентрация – содержание растворенного в-ва В в опред массе или объеме раствора(или растворителя) 1.массовая доля w(B)равна отношению массы раств в-ва к общ массе р-ра w(B)=m(B)/m(p-pa) ili w(B)=m(B)*100/m(p-pa)% 2.мольная доля X(B) равно отношению кол-ва в-ва n(B) к сумме количеств веществ n(A)+n(B)m всех компонентов р-ра X(B)=n(B)/(n(A)+n(B))(или умнож на 100%) 3.молярная концентр-я С(В)-отношение кол-ва раствор.в-ва к объему р-ра,т е кол-ва растворенног в-ва,содержащегося в 1л р-ра С(В)=n(B)*1000/V 4.Моляльная концентрация См(В),Моль/1000г астворителя,отношение кол-ва раствор в-ва к 1000г растворителя См(В)=n(B)*1000/m(A),Cм=m(B)*1000/M(B)*m(A) Химическая идентификация (качественный анализ) и химические измерения (количественный анализ) являются предметом специальной химической науки - аналитической химии.
Химическая идентификация (обнаружение) - это установление вида и состояния фаз, молекул, атомов, ионов вещества на основе сопоставления экспериментальных и справочных данных для известных веществ. При идентификации определяется комплекс свойств вещества: цвет, фазовое состояние, плотность, вязкость, температура кипения, плавления, растворимость и др. Методы качественного анализа базируются на ионных реакциях, которые позволяют идентифицировать элементы в форме тех или иных ионов. В ходе реакций образуются труднорастворимые соединения, окрашенные комплексные соединения или изменение цвета раствора. Определение содержания (концентрации, массы и т.п.) компонентов в анализируемом веществе называется количественным анализом. Все методы количественного анализа можно условно разделить на две большие группы: химические и инструментальные. Гравиметрический метод. Сущность метода заключается в получении трудно растворимого соединения, в которое входит определяемый компонент. По массе вещества находят массу определяемого компонента и проводят расчет его массовой доли в анализируемой навеске.
Титриметрический метод. Сущность метода заключается в измерении объема раствора того или иного реагента, израсходованного на реакцию с анализируемым компонентом. Для этих целей используют так называемые титрованные растворы, концентрация которых известна (титры). Титр - масса вещества, содержащегося в 1 мл титрованного раствора. Определение проводят способом титрования, т.е. постепенного приливания титрованного раствора к раствору анализируемого вещества, объем которого точно измерен. Существует несколько разновидностей титриметрического анализа: кислотно-основное, осадительное, окислительно-восстановительное и др. При обнаружении какого-либо компонента вещества обычно фиксируют появление аналитического сигнала – образование осадка, изменение окраски, появление линии в спектре и т.д. При этом аналитический сигнал наблюдают, главным образом, визуально. Например, если при добавлении к раствору исследуемой соли раствора гексацианоферрата(ІІ) калия появляется темно-синяя окраска, то это служит аналитическим сигналом на наличие в исследуемом растворе ионов Fe+3. Другой пример: если при внесении кристаллов некоторой соли в пламя оно окрашивается в желтый цвет, то это является аналитическим сигналом на наличие в составе соли ионов Na+.
Закон Мозли Он установил, простую связь между длиной волны рентгеновского спектра и порядковым номером элемента, оказалось, что длина волны равномерно уменьшается с увеличением порядковый номера элемента Качественная реакция - эта реакция проверки на содержание в растворе определенного вещества. Добавляется какое-то вещество и в случае наличия проверяемого вещества выделяется газ, выпадает осадок, раствор меняет цвет 1. Качественная реакция на ион железа (III)– реакция со щелочью. Если в растворе есть ионы железа (III), образуется гидроксид железа (III) Fe(OH)3. Основание нерастворимо в воде и бурого цвета. (Гидроксид железа (II) Fe(OH)2. – также нерастворим, но серо-зеленого цвета). Бурый осадок указывает на присутствие в исходном растворе ионов железа (III). FeCl3 + 3 NaOH = Fe(OH)3 ↓+ 3 NaCl 2. Качественная реакция на ион железа (III) – реакция с желтой кровяной солью. Желтая кровяная соль – это гексацианоферрат калия K4[Fe(CN)6]. (Для определения железа (II) используют красную кровяную соль K3[Fe(CN)6]). К порции раствора хлорида железа прильем раствор желтой кровяной соли. Синий осадок берлинской лазури* показывает на присутствие в исходном растворе ионов трехвалентного железа. 3 К4[Fe(CN)6 ] +4 FeCl3 = KFe[Fe(CN)6])↓ + 12 KCl
2. H2+S=H2S Ba+H2=BaH2 NaH+H2O = NaOH + H2↑ 2H2 + O2 = 2H2O 4 11H → 11H + 2β+( 0 +1 e) + 2ν ZrH4 + 4H2O --> Zr(OH)4(s) + 4H2(g)
3. Pb(NO3)2(p-p)+2NaI(p-p)=PbI2+2NaNO3(p-p) Pb^2+ +2I^-1=PbI2(ТВ) Ка=a[PbI2]/(a [Pb^2+]*a^2[I^-1])= 1/(a [Pb^2+]*a^2[I^-1]) a[PbI2]=1
dG(p-ii)=dG(PbI2)-dG(Pb)-2dG(I)=-173,56-11,82+2*51,94=-81,5 k=exp(-dG(p-ii)/RT)=exp(81,5/8,31*298)=1,35
