
Билет 15
1.
V большинства хим реакций при увеличении
t возрастает, так как увеличивается
число активных молекул. Теоретичеки
определено, что при увеличении Т на
100С доля активных молекул увеличивается
в 2,76 раз. При этом <V> (средняя)
возрастает на 2% Правило Вант-Гоффа
(эксперимент зависимость) При ↑ Т на
100С v химической реакции ↑ в 2-4 раза
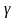 - температурный коэффициент = 2 – 4
- температурный коэффициент = 2 – 4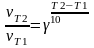 - зависимость Вант-Гоффа Уравнение
Аррениуса
- зависимость Вант-Гоффа Уравнение
Аррениуса
 К-константа скорости, К= V при СТ=1моль/л
; А-число столкновений ; R- универсальная
газов постоян= 8,314 Дж/моль*К , Еа- Энергия
Активации, T- температура.
К-константа скорости, К= V при СТ=1моль/л
; А-число столкновений ; R- универсальная
газов постоян= 8,314 Дж/моль*К , Еа- Энергия
Активации, T- температура.
Значение зависимости: позволят определить Еа и сделать вывод о механизме процесса
Определение Еа:
Аналитический
метод
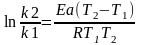
 Графический способ ln k=ln A – Еа/ RT (1/T)
Графический способ ln k=ln A – Еа/ RT (1/T)
![]()
Энергия Активации –средняя избыточная энергия, которой должны обладать частицы, чтобы произошла реакция (Е активации, кДж). Потенциальный барьер, разделяющий исходное и конечное состояние системы, который должны преодолеть реагирующие частицы, чтобы произошла реакция .
Она тратится на: -Преодоление сил, отталкивающих при сближении частиц (электронные облака отталкиваются) -Разрушение старых связей
-Изменение электронной конфигурации реагентов Реакция идет: Е>= Еактивации
Чем больше Еактивации , тем меньше V химической реакции, так как меньше будет активных частиц, способных вступить во взаимодействие.
Зависимость Еактивации от природы реагентов: если Еа < 100 кДж/моль, то такие реакции относятся к быстрым – они с заметной скоростью протекают уже при стандартных условиях. К ним относятся реакции, с участием свободных атомов, противоположно заряженных ионов, радикалов, а также реакции между самыми активными Ме и НеМе. если Еа >=100 кДж/моль, то такие реакции или не идут, или с очень медленно. Они требуют инициирования ( активирования, т.е создания в системе активных частиц –активных молекул, атомов, радикалов, ионов)
методы инициирования: 1. Термическое 2. фотохимическое (hv- облучая систему, создаем в ней акт. частицы) 3. радиационно- химический (энергия в сист подается потоком частиц с высокой энергией – нейтроны, протоны и т.п)
2. 1. Au+O2 не идет 2. 2Cu+O2=2 CuO 3. 4 Li+O2=2Li2O 4. 4Cs+O2=2Cs2O 5. K+H2O= KOH+H2 6. Cu+H2O= CuO + H2
3. PbBr2= Pb+ Br2 c= 1,3* 10-2 моль/л ПР-? ПР(PbBr2)= [Pb]*[ Br2]= c*c= (1,3* 10-2)2= 1,69*10-4.
Билет16
1. Хим изм-ия (кол-ый анализ) являются предметом спец хим науки - аналит хим. Определение содержания (концентрации, массы и т.п.) компонентов в анализируемом веществе называется кол-ым анализом. Все методы кол анализа на две большие группы: хим и инструмент. При обнаружении какого-либо компонента вещества обычно фиксируют появление аналит. сигнала – образование осадка, изменение окраски, появление линии в спектре и т.д. При этом аналитический сигнал наблюдают, главным образом, визуально. При количественном измерении определяют интенсивность аналитического сигнала, т.е. числовое значение свойства, связанного с количественным содержанием анализируемого компонента. В титриметрическом аналитическим сигналом является объем раствора, израсходованного на химическую реакцию . – другое опр. Титрование- постепенное(небольшими порциями) добавление раствора реагента известной концентрации(титранта) к известному объему определяемого вещества. Точка стехиометричности (эквивалентности)- это такой момент в титровании, когда все исходные вещества полностью (без остатка) прореагировали друг с другом, причем в таком соотношении как это задано стехиометрическими коэффициентами уравнения реакции. Закон стехиометрии: количества химических веществ, вступающих в реакцию и образующихся в результате реакции, пропорциональны их стехиометрическим коэффициентам в уравнении реакции.
(1ый вопрос не докончен)
2 1. Ce + O2 = CeO2 2. Th + O2 = ThO2 3. 2Ce(OH)4 + 8HCl =2CeCl3 + Cl2 + 8H2O 4. Th(OH)4+4HCl=ThCl4+4H20 5. 2Ce(N03)3 + 3Na2C03 =Ce2(C204)3(бел)+6NaN03 6. Th(NO3)4 + 4Na2CO3 = Na4[Th(CO3)4] + 4NaNO3
3. Na2S(изб)+ 2AgNO3= Ag2S(осадок)+ 2NaNO3 mAg2S+ nNa2S= {[mAg2S]*nS-2*xNa+}(2n-x)- (2n-x)Na+ заряд гранулы –(отрицатеьный) Na+2SO4 -2
Ca+2Cl-2 выбираем наибольший положительный заряд +2. Т.к С(пороговое)= А/z6 меньше чем больше заряд. Следовательно CaCl2 более эффективный коагулянт.
Билет 17
Раствор- химическая система включающая 2 компонента растворитель и растворенное вещество. Растворитель обычно то вещество агрегатное состояние которого передается раствору Растворы бывают: газовые (газовые смеси), жидкие и твердые. Относит. содержание компонента в растворе характеризуется его концентрацией. Классификация. По числу компонентов: Бинарные (2 компонента) и многокомпонентные. Растворитель — тот, что в избытке. По агрегатному состоянию: Жидкие (водные и неводные) Твёрдые (растворы внедрения и замерзания) Газообразные (равновесные смеси газов в любых соотношениях) По концентрации: Разбавленные (С 0,01) Концентрированные (С = 1 моль/л) Насыщенные (С > 1?) По природе растворённого вещества: Электролиты (сильные ( = 1) и слабые ( < 30%)), = распавшихся / растворённых. Неэлектролиты. По реальности: Идеальные (нет взаимодействия между AX–S, S–S, AX–AX). AX — растворённое. Реальные. Условие образования идеального раствора: Hид = 0, S > 0, V = 0.
Концентрация – количественная мера содержания растворенного вещества. Способы выражения концентрации: Массовая доля растворенного вещества w и равная отношению массы раств. Вещества и общей массы растворе m. Cv=m(в)/m(р-р) Молярная концентрация c=n/v [кол-ва вещ-ва в одном литре р-ра] [ моль/л] = m(в)/M(в)V Моляльная концентрация Cм=n/m(р-ра) = [моль/кг(h2o)] Предельно-разбавленные и насыщенные растворы Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе. Предельно разбавленный раствор- раствор в котором концентрация растворенного вещества бесконечно мала.
AgPO4↔3Ag(+)+PO4(3-) ПР=1,3*10^(-20) Kд=C(Ag+)^3*C(po4)/C(Ag3PO4)=C(Ag+)^3*C(PO4)(3-)=x^3*x X=(ПР/x^4)^1/4
2) 17) ThO2+2Ca=Th+ 2CaO Th(NO3)4 + 4 NH4F = ThF4 + 4 NH4NO3 UO2(NO3)2 + 2 NH4F = UO2F2 + 2 NH4NO3 Th(NO3)4 + 8 Na2CO3 = Na12[Th(CO3)8] + 4 NaNO3 Th(CO3)2 = ThO2 + 2 CO2 Th + 2 H2SO4 = Th(SO4)2 + 2 H2
3) Pt,H2│HNO3;Hg│Hg(NO3)2;Co│Co(NO3)2 Pt,H2│HNO3 Co│Co(NO3)2 Co(2+)+2e→Co↓ E=-0.277 (-)Co│Co(NO3)2║ HNO3│H2(Pt) (+)
Анод: Co↓-2e→Co(2+) E=-0.277 Катод: 2H(+)+2e→H2(0) E=0 ЭДС=0-(-0.277)=0.277 Токообразующие: Co(0)+2 HNO3→ Co(NO3)2+ H2(0)
Pt,H2│HNO3;Hg│Hg(NO3)2; Hg(2+)+2e→Hg↓ E=0.854 (-)H2(0)│HNO3║Hg(NO3)2│Hg Анод: H2(0)-2e→2H(+) E=0 Катод: Hg(2+)+2e→Hg↓ E=0.854 ЭДС=0.854-0=0.854 Токообразующие: H2(0)+ Hg(NO3)2→ HNO3+ Hg↓
