
- •А.В. Юрьева аналитическая химия Учебное пособие
- •Предисловие
- •Глава 1. Аналитическая химия как наука
- •1.1. Предмет и методы аналитической химии. Качественный и количественный анализ
- •1.2. Значение аналитической химии
- •1.3. Краткий очерк развития аналитической химии
- •Глава 2. Качественный химический анализ
- •2.1. Особенности аналитических реакций и способы их выполнения
- •2.2. Требования к аналитическим реакциям. Чувствительность реакций. Селективные и специфические реакции
- •2.3. Дробный и систематический анализ
- •2.4. Классификации катионов
- •Сульфидная классификация катионов
- •Деление катионов на группы по кислотно-основной классификации
- •2.5. Классификация анионов
- •Классификация анионов
- •2.6. Анализ конкретных объектов
- •Изменения проб при нагревании на пластинке
- •2.7 Основы качественного анализа органических соединений
- •Практические работы
- •Групы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов третьей аналитической группы по кислотно-основной классификации
- •Растворимость в воде некоторых солей катионов I–III аналитических групп по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов четвертой аналитической группы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов пятой аналитической группы по кислотно-основной классификации
- •Продукты некоторых аналитических реакций катионов шестой аналитической группы по кислотно-основной классификации
- •Вопросы и задачи
- •Глава 3. Метрологические основы химического анализа
- •3.1. Общая схема аналитического определения
- •Выбор метода анализа
- •Отбор и подготовка пробы к анализу
- •Проведение измерения
- •Расчет результатов анализа
- •Погрешности химического анализа
- •3.2.1. Систематические погрешности
- •3.2.2. Случайные погрешности
- •Значение t для различной доверительной вероятности
- •Вопросы и задачи
- •Глава 4. Количественный анализ. Химические методы
- •4.1. Гравиметрический анализ
- •4.1.1. Осаждение
- •4.1.2. Фильтрование и промывание осадка
- •4.1.3.Высушивание и прокаливание
- •4.1.4. Вычисления в гравиметрическом анализе
- •Практические работы
- •Вопросы и задачи
- •Глава 5. Титриметрический анализ
- •5.1. Сущность титриметрического анализа
- •5.2. Стандартизация раствора титранта
- •5.3. Основные приемы титриметрических определений
- •5.4. Расчеты в титриметрическом анализе
- •5.5. Кривые титрования
- •5.6. Основные методы титриметрического анализа
- •5.7. Техника работы
- •Вопросы и задачи
- •Глава 6. Реакции кислотно-основного взаимодействия
- •6.1. Протолитическая теория кислот и оснований Бренстеда-Лоури
- •6.2. Электронная теория Льюиса
- •6.3. Кислотно-основные и некоторые другие свойства растворителей
- •6.4. Равновесия в водных растворах кислот и оснований
- •6.5. Буферные растворы
- •6.6. Кислотно-основные индикаторы
- •Вопросы и задачи
- •Глава 7. Кислотно-основное титрование
- •7.1. Рабочие растворы
- •7.2. Кривые титрования и выбор индикатора
- •7.3. Практическое применение методов кислотно-основного титрования
- •Практические работы
- •Вопросы и задачи
- •Глава 8. Реакции окисления-восстановления. Окислительно-восстановительное титрование
- •Окислительно-восстановительное титрование
- •8.1. Требованиям к реакциям в методе окислительно-восстановительного титрования
- •8.2. Способы установления точки эквивалентности
- •8.3. Молярная масса эквивалента в реакциях окисления-восстановления
- •8.4. Кривые титрования
- •8.5. Индикаторы
- •8.6. Классификация методов окислительно-восстановительного титрования
- •8.7. Перманганатометрия
- •Практические работы
- •8.8. Иодометрия
- •Практические работы
- •8.9. Хроматометрия
- •Вопросы и задачи
- •Глава 9. Титрование по методу осаждения
- •9.1. Аргентометрия
- •9.2. Меркурометрия
- •Практические работы
- •Вопросы и задачи
- •Глава 10. Комплексометрическое титрование
- •10.1. Комплексонометрия
- •10.1.1. Рабочие растворы
- •10.1.2. Кривые титрования
- •10.1.3. Способы обнаружения конечной точки титрования
- •10.1.4. Применение комплексонометрии
- •Практические работы
- •Вопросы и задачи
- •Глава 11. Методы маскирования, разделения и концентрирования
- •11.1. Маскирование
- •11.2. Разделение и концентрирование
- •11.3. Краткая характеристика некоторых методов разделения и концентрирования
- •Вопросы и задачи
- •Глава 12. Биологические методы анализа
- •Вопросы
- •Библиографический список
- •Оглавление
- •Глава 1. Аналитическая химия как наука………………………….. ………… 4
- •Глава 2. Качественный химический анализ…………………………………….. 8
- •Глава 3. Метрологические основы химического анализа……………………. 50
- •Глава 4. Количественный анализ. Химические методы………………………. 63
- •Глава 5. Титриметрический анализ………………………………………………. 77
- •Глава 6. Реакции кислотно-основного взаимодействия ……………………… 89
- •Глава 7. Кислотно-основное титрование………………………………………… 100
- •Глава 8. Реакции окисления-восстановления. Окислительно-
10.1.1. Рабочие растворы
Основным рабочим раствором комплексонометрии является раствор комплексона III – Na2H2Y · 2H2O. Растворы ЭДТА устойчивы при хранении; их можно готовить по навеске (с учетом содержащихся 0,3 % воды в препарате). Однако обычно его титр устанавливают по раствору соли цинка, полученному растворением точной навески металлического цинка в хлороводородной кислоте. Применяемые для титрования растворы ЭДТА имеют концентрацию 0,01–0,05 моль/л.
10.1.2. Кривые титрования
Кривые
комплексонометрического титрования
обычно представляют собой зависимости
pM=–lg[Mn+]
от степени оттитрованности или объема
титранта. Расчет концентрации
ионов металла ведут с учетом концентрации
реагентов и величин констант
устойчивости соответствующих комплексов
(константы устойчивости для реакции
![]() рассчитываются по уравнению
рассчитываются по уравнению
![]() ).
На рис. 10.1 приведена кривая титрования
раствора Zn(NO3)2
раствором Na2H2Y.
Как видно, в области точки эквивалентности
происходит резкое изменение концентрации
ионов цинка (скачок титрования), которое
можно заметить с помощью соответствующих
индикаторов.
).
На рис. 10.1 приведена кривая титрования
раствора Zn(NO3)2
раствором Na2H2Y.
Как видно, в области точки эквивалентности
происходит резкое изменение концентрации
ионов цинка (скачок титрования), которое
можно заметить с помощью соответствующих
индикаторов.
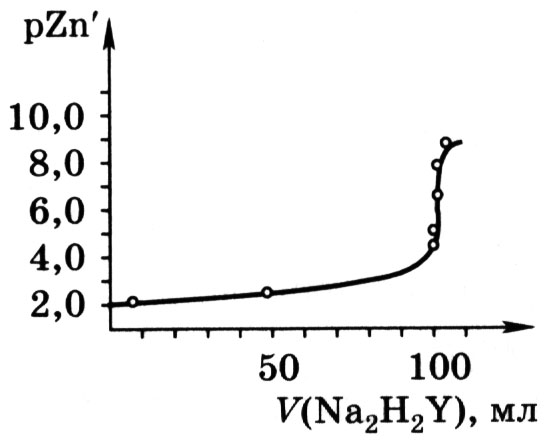
Рис. 10.1. Кривая титрования 100,0 мл 0,01 М Zn(NO3)2 при рН 10 в присутствии NH3 + NH4Cl 0,01 M раствором Na2H2Y
10.1.3. Способы обнаружения конечной точки титрования
Поскольку реакции комплексонометрического титрования обычно сопровождаются выделением ионов водорода в количестве эквивалентном катионам, в первых методиках с применением ЭДТА использовались обычные кислотно-основные индикаторы. К нейтральному раствора соли металла добавлялся избыток титрованного раствора
Na2H2Y: M2+ + H2Y2– + 2H+.
Выделившиеся ионы водорода оттитровывались щелочью, такие методики могли быть применены к небольшому кругу металлов. Этот метод сохранил некоторое практическое значение до настоящего времени.
Бурное развитие
комплексонометрии связано с открытием
так называемых металлоиндикаторов
– веществ образующих с ионами металлов
интенсивно окрашенные комплексные
соединения. Эти соединения менее прочны,
чем комплексы тех же катионов с
комплексонами. Вблизи точки эквивалентности
происходит разрушение комплексного
соединения индикатора с определяемым
ионом за счет образования более прочного
комплекса определяемого иона с титрантом.
Поэтому в конце титрования происходит
реакция
![]() .
.
Цвет раствора в
конце титрования изменяется от окраски
комплекса с индикатором (MInd)
до цвета свободного индикатора (H2Ind).
Таким образом, необходимым условием
прямого комплексонометрического
титрования является неравенство
![]() ,
где
,
где
![]() – константа устойчивости комплекса
титруемого металла с индикатором.
– константа устойчивости комплекса
титруемого металла с индикатором.
Наиболее распространенными металлохромными индикаторами являются мурексид, эриохром черный Т, кислотный хром синий, ксиленовый оранжевый и др.
Мурексид–аммонийная соль пурпуровой кислоты – изменяет свою окраску в зависимости от pH раствора и в присутствии некоторых катионов. Структурная формула индикатора имеет вид
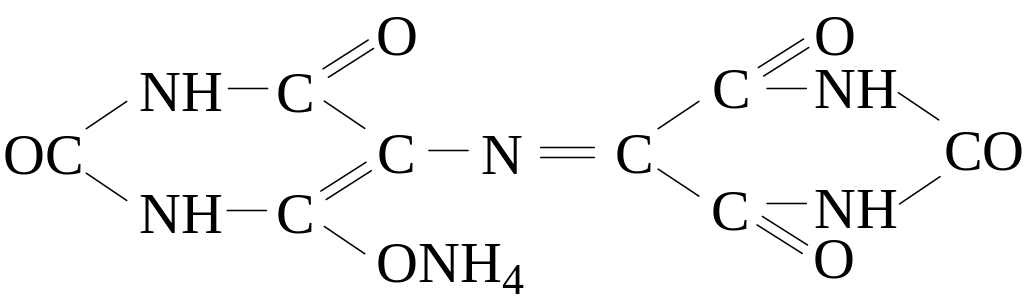
Мурексид образует комплексы с Cu2+, Ni2+, Ca2+, Co2+, Zn2+ устойчивые в нейтральной и щелочной среде. В нейтральной среде (pH < 9) растворы индикатора окрашены в красно-фиолетовый, при pH 9,2 – 10,3 – фиолетовый, при pH 10,3 – сине-фиолетовый цвет. Комплексы мурексида имеют желтый (Ni2+). желто-оранжевый (Cu2+) или красный (Ca2+) цвет. Индикатор применяют в виде 1% - го водного раствора или в виде смеси 1:500 с сахарозой или хлоридом натрия.
Одним из наиболее широко применяемых в комплексонометрии индикаторов является эриохром черный Т, относящийся к азокрасителям и имеющий в молекуле хелатообразующие OH-группы:
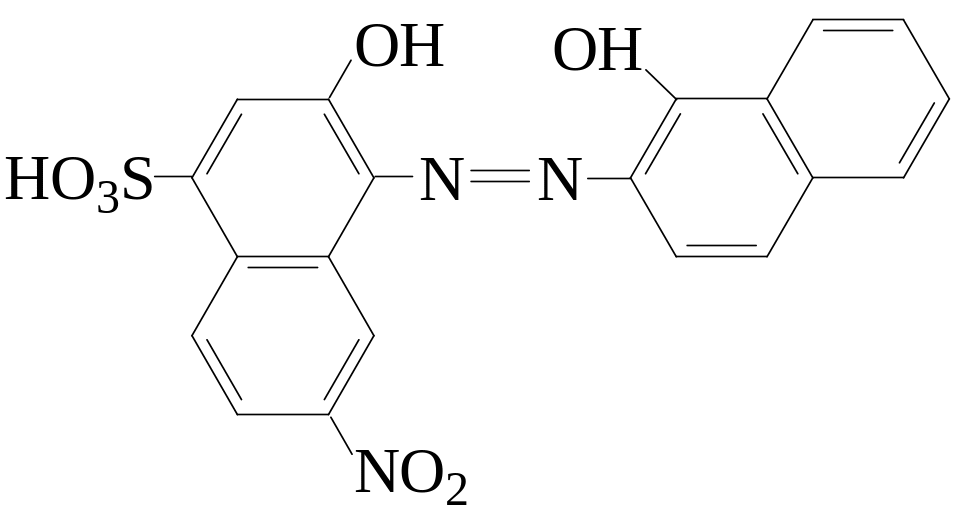
Сульфогруппа в растворе диссоциирует практически нацело (отщепляет H+). Последующее отщепление протонов от OH– группы приводит к изменению цвета индикатора. Окраска эриохром черного Т зависит от pH раствора:
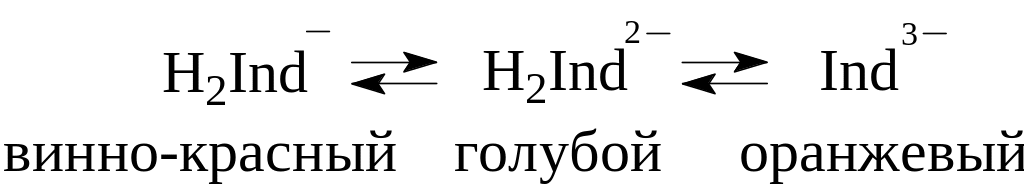
Доминирующий в аммиачном растворе анион HInd2– взаимодействует с анионом металла, образуя окрашенное в красный или фиолетовый цвет соединение. При титровании катиона металла комплексоном III (ЭДТА) в аммиачном буферном растворе в точке эквивалентности красная окраска переходит в синюю от одной избыточной капли титранта. Готовят спиртовой раствор индикатора, растворяя 0,5 г эриохрома черного Т в 19 мл аммиачного буферного раствора и доводя объем жидкости этиловым спиртом до 100 мл. Однако он не очень стоек, поэтому часто готовят сухую смесь (1:100) индикатора с хлоридом натрия (х.ч.).
При проведении титрования для улучшения четкости перехода цвета индикатора иногда используют смеси металлохромных индикаторов с индифферентными красителями, играющими роль внутреннего светофильтра. Чаще всего используют смеси: эриохром черный Т – метиловый желтый; мурексид – нафтоловый зеленый и.т.д.
