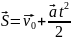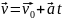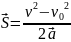- •2. Кинематика вращательного движения.
- •Переохлажденный пар
- •49.Оптический микроскоп: устройство, увеличение, разрешение. Формула Аббе. Ультрафиолетовый микроскоп: устройства, принцип действия, преимущества. Иммерсионные системы.
- •95 Возбудимость клеток
- •97) Инструментальные методы и анализа вещества
- •97) Инструментальные методы и анализа вещества
Ответы к зачету.
1. Предмет и задачи механики, кинематики.
Механика – наука о равновесии и движении тел. Классическая механика – изучает движение макроскопических тел со скоростями намного меньшими скорости света в вакууме. Релятивистская механика – рассматривает явления вокруг нас (механика теории относительности).
Механика решает задачи:
Кинематика – изучает математические способы описания движения тел без учета причин этого движения (гл. вопрос: как движется тело?)
Динамика – выясняет причины движения (почему так или иначе движется тело?)
Статика – изучает законы равновесия системы тел.
Материальная точка – абстракция (модель реального тела), размерами которого в данном условии задачи можно пренебречь.
Система отсчета – система координат и прибор для измерения времени(часы).
Эталоны длины – длина волны э/м излучения.
Эталон времени – часы – прибор, в котором будут происходить равномерно повторяемые процессы.
Относительность движения – движение тела по отношению к другим телам .
Перемещение – направленный отрезок, соединяющий начальное и конечное положение тела.
Скорость – векторная физическая величина, определяющая как быстроту движения, так и направление движения в данный момент времени.
Мгновенная
скорость –
первая производная от пути по времени.
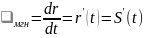
Средняя
скорость –
показывает по какому направлению и
какое по величине перемещение должны
была бы совершать мат.точка ежесекундно,
чтобы попасть из точки 1 в т.2.
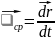
Ускорение
– предел, к которому стремится приращение
скорости к промежутку времени, за которое
оно произошло, когда интервал времени
стремится к нулю.
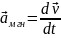 (м/с2)
(м/с2)
Нормальное
ускорение –
направлено по нормали к траектории.
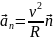
Центростремительное ускорение – вектор нормального ускорения, направленный по главной нормали к центру окружности.
Тангенциальное
ускорение –
вектор
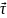 ’совпадает
с
’совпадает
с
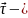 единичным
вектором, направленным по касательной
к траектории в точке 1.
единичным
вектором, направленным по касательной
к траектории в точке 1.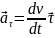
Способы описания движений: векторный, координатный, траекторный, графический.
Виды движений:
равномерное прямолинейное – движение, при котором тело за равные промежутки времени совершает одинаковые перемещения.
неравномерное – за равные промежутки времени – неодинаковые перемещения
равнопеременное – движение с постоянным по величине и направлению ускорением
равноускоренное – если вектор ускорения совпадает с вектором скорости (положительное)
равнозамедленное – если вектор ускорения направлен в противоположную сторону вектору скорости (отрицательное)
Уравнения движений материальной точки:
2. Кинематика вращательного движения.
Точка, находящаяся
на расстоянии R
от оси, проходит при этом путь S,
равный :
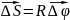 ,
где
,
где
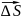 – угловое
перемещение.
Поворот
тела на некоторый угол φ (угловое
перемещение) можно задать в виде отрезка,
длина которого равна абсолютной
величине φ (в
радианах), а направление совпадает с
осью вращения.
– угловое
перемещение.
Поворот
тела на некоторый угол φ (угловое
перемещение) можно задать в виде отрезка,
длина которого равна абсолютной
величине φ (в
радианах), а направление совпадает с
осью вращения.
Скорость поворота
радиуса вектора
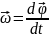 , где
, где
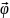 –угловая скорость тела.
Вектор
угловой скорости по величине равен
углу поворота
тела в единицу времени.
–угловая скорость тела.
Вектор
угловой скорости по величине равен
углу поворота
тела в единицу времени.
Связь угловых и линейных скоростей и ускорений:
Линейная скорость
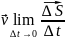
Чем дальше отстоит
точка от оси вращения, тем с большей
линейной скоростью она движется:
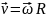
Изменение угловой
скорости характеризуется угловым
ускорением
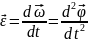
Единица измерения углового ускорения – 1 рад/с2.
Центрифугирование – процесс отделения мелких частиц от жидкости в гетерогенных системах за счет центробежной силы инерции при вращательном движении.
Конструкция центрифуги – вращающийся диск с укрепленными в шарнирных подвесках пробирками. При вращении диска пробирки, устанавливаются горизонтально. На частицу в плоскости вращения действует не ускорение свободного падения, а центробежное ускорение aц.б.=ω2r . где ω – угловая скорость вращения диска с пробирками, к- расстояние от частицы в пробирке до оси вращения.
3. Основная задача динамики состоит в определении положении тела в произвольный момент времени по известному начальному положению тела, начальной скорости и силам, действующим на тело. Материальная точка считается изолированной, если отсутствуют или скомпенсированы внешние воздействия на нее. Динамика материальной точки исходит из принципа инерции, согласно которому материальная точка, на которую не действуют никакие внешние силы, сохраняет со временем свое состояние движения (или покоя).
Инерциальные системы отсчета – системы, в кот. свободная мат. точка покоится или движется равномерно и прямолинейно. Прямолинейное и равномерное движение материальной точки в инерциальной система отсчета называется инерциальным движением.
Траектория движения – линия, вдоль которой движется тело.
Взаимодействия: гравитационное (возникает между всеми телами в соответствии с законом всемирного тяготения), электромагнитное (э/м) – между телами и частицами, обладающими электрическими зарядами, сильное – между частицами, из которых состоят ядра атомов, слабое – процессы превращения некоторых элементарных частиц.
Сила – векторная физическая величина, являющаяся мерой механического воздействия на мат.точку или тело со стороны других тел.
Первый закон Ньютона: существуют такие инерциальные системы отсчета, относительно которых при отсутствии силового воздействия или под действием взаимно уравновешивающих сил тело сохраняет состояние покоя или равномерного прямолинейного движения.
Инертность – свойство тела сохранять свою скорость в отсутствие взаимодействия с другими телами.
4.
Импульс
– векторная
величина, равная произведению массы
точки на скорость ее движения.
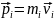
Общая
форма 2 закона Ньютона:
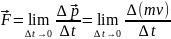
2
закон Ньютона: произведение
массы на приобретаемое телом в результате
взаимодействия ускорение равно
результирующей всех сил, действующих
на тело.
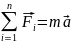
3
закон Ньютона: два
тела действуют с равными по величине,
но противоположно направленными силами.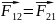
Вес тела – сила, с которой тело действует на опору или подвес.
Сила тяжести – сила притяжения тела к Земле.
Невесомость, состояние материального тела, при котором действующие на него внешние силы или совершаемое им движение не вызывают взаимных давлений частиц друг на друга.
Внешнее трение – взаимодействие между различными соприкасающимися телами, препятствующее их относительному перемещению.
Сила, возникающая на границе взаимодействия тел при отсутствии относительного движения тел, называется силой трения покоя. Если происходит относительное перемещение этих тел говорят о трении скольжения, качения.
Внутренним трением называется трение между частями одного и того же тела.
Сила упругости - сила, возникающая при деформации тела и противодействующая этой деформации.
5.
Закон
сохранения импульса: импульс
замкнутой системы сохраняется. т.е. не
изменяется с течением времени.
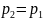
Закон
изменения импульса:
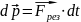
Работа
- физическая
величина,
являющаяся скалярной количественной
мерой действия силы или
сил на тело или систему, зависящая от
численной величины, направления силы
(сил) и от перемещения точки (точек) тела
или системы
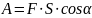 (Дж)
(Дж)
Мощность
– работа,
совершенная в единицу времени.

работа
силы тяжести не зависит от траектории
движения тела и всегда равна произведению
модуля силы тяжести на разность высот
в начальном и конечном положениях.
При
движении вниз работа силы тяжести
положительна, при движении вверх —
отрицательна.
Работа
силы тяжести равна изменению потенциальной
энергии тела, взятому с противоположным
знаком:
![]()
Работа
силы упругости
- работа, совершаемая силой упругости
при изменении деформации (удлинения)
пружины от некоторого начального
значения х1 до
конечного значения х2
![]()
6.
Энергия – мера взаимодействия и движения тел.
Кинетическая энергия механической системы – энергия механического движения этой системы.E = mv2/2
Потенциальная энергия – механ. энергия системы тел, определяемая их взаимным расположением и характером сил взаимодействия между ними.E=mgh
Кинетическая
энергия механической системы
равна сумме кинетических энергий тел.
входящих в систему. Так, кин. энергия
системы из n
материальных точек
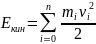 , где
, где
 - скорость -й материальной точки массой
- скорость -й материальной точки массой
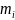 .
.
Величину,
равную энергии, заключенной в единице
объема называют плотностью
энергии:
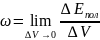
где
 - энергия. заключенная в единице объема.
- энергия. заключенная в единице объема.
7.
Изменение
потенциальной энергии системы равно
работе консервативных сил. действующих
в системе, взятой с обратным знаком
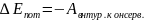
Изменение
кинетической энергии:
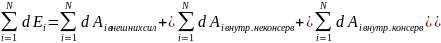
Изменение
полной энергии:
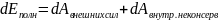
Закон сохранения энергии: в консервативных системах полная механическая энергия сохраняется.
Сущность удара заключается в том, что кинетическая энергия относительного движения соударяющихся тел на короткое время преобразуется в энергию упругой деформации.
Абсолютно упругий удар – столкновение двух тел, в результате которого в обоих взаимодействующих телах не остается никаких деформаций и вся кинетическая энергия, которой обладали тела до удара превращается в кин. энергию после удара.
Абсолютно неупругий удар – столкновение двух тел, в результате которого тела объединяются, двигаясь дальше как единое целое.
8.Тепловое движение – процесс хаотического движения частиц, образующих вещество.
Тепловые явления – явления, в которых существенную роль играет температура.
Термодинамическая система – совокупность макроскопических тел, которые могут обмениваться энергией между собой и другими телами.
Макротело – тело, состоящее из большого числа молекул.
Термодинамические параметры – физические величины, характеризующие состояние термодинамической системы.
Термодинамическое равновесие – состояние системы, при котором макроскопические величины остаются неизменными во времени.
Термодинамический процесс – изменение макроскопического состояния термодинамической системы.
Равновесный процесс – бесконечно медленный процесс, в котором ТД система переходит из одного равновесного состояния в другое.
9.
Средняя
квадратичная скорость
 =
=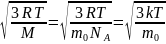
Основное
уравнение МКТ![]()
Обозначив
среднее значение кинетической энергии
поступательного движения молекул
идеального газа ![]() :
:
![]() ,
получим
,
получим
![]() .
.
Идеальный газ – газ, взаимодействие, между молекулами которого пренебрежимо мало.
|
|
где m - масса газа; = m/M - число молей.
Формулу называют уравнением состояния идеального газа Менделеева - Клапейрона.
Из уравнения состояния идеального газа следует два следствия.
1. Закон Авогадро
В равных объемах различных газов, находящихся при одинаковых давлениях и температурах, содержится одинаковое число молекул, равное постоянной АвогадроNA=6.02 1023 моль-1.
2. Закон Дальтона
В состоянии теплового равновесия давление в смеси химически не взаимодействующих идеальных газов равно сумме парциальных давлений отдельных газов, входящих в смесь:
|
P=P1+P2+P3+.... . |
|
Парциальным называют давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал весь объем, равный объему смеси при той же температуре.
Для
фиксированной массы газа произведение
давления на объем, деленное на температуру,
есть величина постоянная.
Объединенный
газовый закон может
быть записан в форме, удобной для решения
задач:
![]()
Для
изобарного процесса справедлив закон
Гей-Люссака ![]()
Для
изотермического процесса
![]() закон Бойля –Мариотта
закон Бойля –Мариотта
Для
изохорного процесса
![]() закон Шарля
закон Шарля
10.
Наивероятнейшая
скорость – скорость, в окрестности
которой на данный интервал скоростей
приходится большее число молекул, нежели
в окрестности любой другой скорости
того же интервала. н=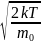
Средняя
арифметическая скорость:

Относительная
скорость: u=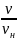
Распределение Максвелла по скоростям молекул:

Распределение Больцмана:

Распределение Максвелла – Больцмана – распределение молекул газа по координатам и скоростям при наличии произвольного потенциального силового поля.
11.
Теорема
о равномерном распределении энергии:
энергия распределяется равномерно
между всеми степенями свободы и на
каждую степень свободы приходится
энергия , равная
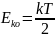
Число степеней свободы – число независимых координат, которые необходимо знать для определения положения материальной точки или системы материальных точек в пространстве.

Политропный процесс – термодинамический процесс, при котором теплоемкость газа остается неизменной.
12.
Совершение работы – макроскопический способ, при этом изменяются параметры системы, и происходит превращение одного вида энергии в другой.
Совершение теплообмена – не связан с изменением внешних параметров, а связан с изменением разности температур между системой и окружающей средой, если они находятся в тепловом контакте.
Изолированные – ТД системы, которые не обмениваются с окружающей средой ни веществом, ни энергией.
Открытые – системы, которые не обмениваются с окр. средой теплом.
Закрытые – системы. которые обмениваются с окр. средой только энергией.
![]() (1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил.
(1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил.
Изохорный
процесс (V=const)
При изохорном процессе газ не совершает
работы над внешними телами, т. е.
![]()
для изохорного процесса следует, что вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии:
![]()
Изобарный процесс (p=const) В изобарном процессе при сообщении газу массой т количества теплоты
![]()
его внутренняя энергия возрастает на величину (согласно формуле (53.4))
![]()
При этом газ совершит работу, определяемую выражением (54.3).
Изотермический процесс (T=const). Как уже указывалось, изотермический процесс описывается законом Бойля—Мариотта:
![]()
из первого начала термодинамики (dQ=dU+dA) следует, что для изотермического процесса
![]()
Ср = Сv + R. |
|
называют уравнением Майера.
Вывод: при изобарическом нагревании газа к нему подводится больше теплоты, чем при изохорическом
Вопрос №13.
Обратимым процессом называют такой процесс, который может быть проведен в обратном направлении таким образом, что система будет проходить через те же состояния, что и при прямом ходе, но в обратной последовательности. Обратимым может быть только равновесный процесс.
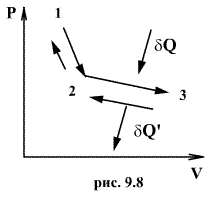
Обратимый
процесс обладает следующими свойствами:
если при прямом ходе на каком-то
элементарном участке (рис. 9.8.) система
получает тепло ![]() и
совершает работу
и
совершает работу ![]() ,
то при обратном ходе на том же участке
система отдает тепло
,
то при обратном ходе на том же участке
система отдает тепло ![]() и
над ней совершается работа
и
над ней совершается работа ![]() .
По этой причине после протекания
обратимого процесса в одном, а затем в
обратном направлении и возвращение
системы в первоначальное состояние в
окружающих телах не должно оставаться
никаких изменений. Например шарик на
пружине в вакууме колеблется бесконечно
долго.
.
По этой причине после протекания
обратимого процесса в одном, а затем в
обратном направлении и возвращение
системы в первоначальное состояние в
окружающих телах не должно оставаться
никаких изменений. Например шарик на
пружине в вакууме колеблется бесконечно
долго.
В том случае, когда после завершения прямого и обратного процессов система вернулась в первоначальное состояние и в окружающей среде остались изменения, процесс является необратимым. Очевидно, что все процессы в природе необратимые.
Рабочий цикл тепловой машины. Для охлаждения газа направим на дно цилиндра струю холодной воды. Понижение температуры газа будет происходить при неизменном объеме до тех пор, пока давление газа в цилиндре не достигнет значения p1 при температуре T4. Этому процессу на диаграмме соответствует изохора CD.
Для возвращения газа в исходное состояние, характеризуемое давлением p1, объемом V1 и температурой T1, необходимо продолжить его охлаждение до температуры T1. Этому процессу соответствует изобара DA.
Процессы, в результате совершения которых газ возвращается в исходное состояние, называют круговыми илициклическими. Рабочий цикл рассмотренной тепловой машины состоит из двух изохор и двух изобар, образующих на диаграмме p, V прямоугольник ABCD.
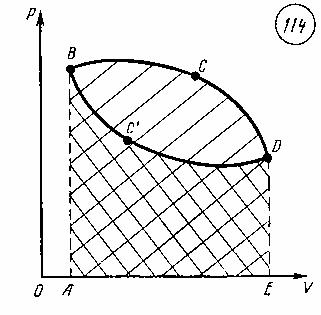
Работа тепловой машины за цикл. Покажем, что полезная работа, произведенная машиной в результате совершения рабочего цикла, пропорциональна площади цикла на диаграмме p, V.
Если при работе тепловой машины изменение состояния рабочего тела происходит по замкнутому циклу, то полезную работу за один цикл можно найти как сумму работ при расширении и при сжатии газа. Пусть изменение состояния газа за цикл представлено диаграммой в координатных осях p, V (рис. 114). Работа газа при расширении положительна и пропорциональна площади фигуры ABCDE. Работа газа при сжатии отрицательна и пропорциональна площади фигурыABC'DE. Поэтому полная работа газа, равная сумме работ при расширении и сжатии, оказывается пропорциональной площади фигуры BCDC'B цикла на диаграмме в координатных осях p, V.
Рабочий цикл холодильной машины. Некоторые тепловые машины можно с помощью другого двигателя, например электромотора, заставить совершать цикл в обратном направлении.В обратных процессах (циклах) холодильником по-прежнему называют тело с более низкой температурой, хотя оно теперь отдает тепло, а нагревателем — тело, имеющее более высокую температуру, хотя теперь оно его получает. При этом рабочее тело будет получать за один цикл от холодильника количество теплоты Q2, отдавая нагревателю количество теплоты Q1, которое больше на величину работы А,совершаемой электромотором:
Q1 = Q2 + A.
Можно сказать, что в данном случае тепловая машина производит отрицательную работу:
Q2 - Q1 = - A.
В результате проведения обратного цикла увеличивается разность температур между нагревателем и холодильником. В этих условиях тепловая машина работает как «тепловой насос». За счет работы, совершаемой электромотором, машина переносит количество теплоты Q2 от холодного тела к горячему.
Коэффициет
полезного действия ![]() ,
равный отношению полезно использованной
энергии к затраченной энергии, для
тепловой машины оказывается равным
,
равный отношению полезно использованной
энергии к затраченной энергии, для
тепловой машины оказывается равным
![]() или
или
![]() . (34.1)
. (34.1)
Французский инженер Сади Карно (1796—1832) в 1824 г. установил чрезвычайно важную для практики зависимость КПД тепловой машины от температуры T1 нагревателя и температуры T2 холодильника: независимо от конструкции и выбора рабочего тела максимальное значение КПД тепловой машины определяется выражением
![]() (34.2)
(34.2)
Любая реальная тепловая машина может иметь КПД, не превышающий это максимальное значение:
![]() (34.3)
(34.3)
Выражение для максимального значения КПД тепловой машины показывает, что для повышения коэффициента полезного действия тепловых машин существует два пути — повышение температуры T1 нагревателя и понижение температуры T2холодильника. КПД тепловой машины мог бы стать равным единице, если бы имелась возможность использовать холодильник с температурой, равной абсолютному нулю.
Однако этот путь даже теоретически неосуществим, так как абсолютный нуль, согласно представлениям термодинамики, не может быть достигнут.
Наиболее приемлемыми холодильниками для реальных тепловых машин являются атмосферный воздух или вода при температуре около 300 К.
Следовательно, основной путь повышения КПД тепловых машин — это повышение температуры нагревателя.
Теплова́я маши́на — устройство, преобразующее тепловую энергию в механическую работу (тепловой двигатель) или механическую работу в тепло (холодильник). Преобразование осуществляется за счёт изменения внутренней энергии рабочего тела — на практике обычно пара или газа.
Идеальная тепловая машина — машина, в которой произведённая работа и разница между количеством подведённого и отведённого тепла равны. Работа идеальной тепловой машины описывается циклом Карно.
Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов.
Цикл Карно назван в честь французского военного инженера Сади Карно, который впервые его исследовал в 1824 году.
Одним из важных свойств цикла Карно является его обратимость: он может быть проведён как в прямом, так и в обратном направлении, при этомэнтропия адиабатически изолированной (без теплообмена с окружающей средой) системы не меняется.
Рассмотрим обратимый и необратимый циклы Карно
Обратимый цикл Карно.Для обратимого цикла коэффициент полезного действия можно вычислить по любой из полученных ранее формул
![]() Отсюда
Отсюда
![]() или
или ![]()
![]() -
количество тепла, подводимое к системе
в процессе перехода из состояния 1 в
состояние 2.
-
количество тепла, подводимое к системе
в процессе перехода из состояния 1 в
состояние 2. ![]() -
отведенное тепло в течение изотермического
процесса 3-4. Или для случая отвода тепла
можно сказать, что к системе
подведено
-
отведенное тепло в течение изотермического
процесса 3-4. Или для случая отвода тепла
можно сказать, что к системе
подведено ![]() тепла.
Тогда
тепла.
Тогда
|
(9.25) |
Отношение
количества теплоты, подведенной к
системе, к температуре, при которой это
происходит, называется приведенной
теплотой. Таким образом, ![]() -
приведенная теплота, передаваемая
системе.
-
приведенная теплота, передаваемая
системе. ![]() -
приведенная теплота в 1 процессе.
-
приведенная теплота в 1 процессе.![]() -
приведенная теплота во II процессе. На
участках 2-3 и 4-1 Q=0. Следовательно, это
вся теплота охватывающая цикл Карно.
Таким образом, для обратимого цикла
Карно
-
приведенная теплота во II процессе. На
участках 2-3 и 4-1 Q=0. Следовательно, это
вся теплота охватывающая цикл Карно.
Таким образом, для обратимого цикла
Карно
|
(9.26) |
Так как любой замкнутый цикл можно представить как сумму бесконечного числа циклов Карно, то для любого замкнутого обратимого цикла выражение (9.26) будет справедливо и его можно записать в следующем виде
|
(9.27) |
Последнее соотношение носит название равенства Клаузиуса.
Необратимый цикл Карно.В этом случае
![]()
И все равенства превращаются в неравенства
![]()
![]()
![]()
![]()
![]()
![]()
![]()
|
(9.28) |
Уравнение (9.28) называется неравенством Клаузиуса.
Объединяя (9.27) и (9.28), получим
|
(9.29) |
Таким образом, сумма приведенных теплот любого цикла равна нулю (обратимый процесс ) или меньше нуля (необратимый процесс).
Постулат Клаузиуса: «Невозможен процесс, единственным результатом которого являлась бы передача тепла от более холодного тела к более горячему»[1] (такой процесс называется процессом Клаузиуса).
Постулат Томсона (Кельвина): «Невозможен круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара» (такой процесс называется процессом Томсона).
Вопрос №14.
Энтропия (от греч.(греческий) entropía — поворот, превращение), понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии. Э. широко применяется и в других областях науки: в статистической физике как мера вероятности осуществления какого-либо макроскопического состояния; в теории информации как мера неопределенности какого-либо опыта (испытания), который может иметь разные исходы. Эти трактовки Э. имеют глубокую внутреннюю связь. Например, на основе представлений об информационной Э. можно вывести все важнейшие положения статистической физики.
В 1824 г. Карно доказал, что для работы теплового двигателя необходимо не менее двух источников теплоты с различными температурами. Невозможность создания вечного двигателя второго рода подтверждается вторым началом термодинамики.
Приведем некоторые формулировки второго начала термодинамики:
Невозможен процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя в эквивалентную ей работу (формулировка Кельвина).
Невозможен вечный двигатель второго рода (формулировка Томпсона – Планка).
Невозможен процесс, единственным результатом которого является передача энергии в форме теплоты от холодного тела к горячему (формулировка Клаузиуса).
В п. 6.4, мы показали, что при обратимом процессе имеет место равенство Клаузиуса:
|
|
|
(6.5.1) |
при необратимом процессе имеет место неравенство Клаузиуса:
|
|
|
(6.5.2) |
Тогда для произвольного процесса,
|
|
|
(6.5.3) |
где знак равенства – для обратимого процесса; знак больше - для необратимого.
Значит для замкнутой системы
|
|
|
(6.5.4) |
Это выражение – математическая запись второго начала термодинамики.
Выражения (6.5.1) и (6.5.2) можно объединить:
|
|
|
(6.5.5) |
Энтропия замкнутой системы при любых происходивших в ней процессах не может убывать (или увеличивается, или остается неизменной).
Первое и второе начала термодинамики в объединенной форме имеют вид:
|
|
Величина S = Q/T, или приведенная теплота, была названа энтропией. Эта величина является функцией состояния термодинамической системы. Изолированные(замкнутые) системы не обмениваются веществом и энергией с окружающим пространством. В таких системах изменение энтропии ΔS = 0 (для обратимых процессов) и ΔS >0 (для необратимых). Все реальные процессы необратимые и поэтому энтропия в изолированной системе для самопроизвольных процессов может только возрастать, что указывает на однонаправленность всех процессов в природе. Этот вывод получил название закона возрастания энтропии.
С точки зрения статистической термодинамики второе начало термодинамики можно сформулировать следующим образом:
Система стремится самопроизвольно перейти в состояние с максимальной термодинамической вероятностью.
Статистическое толкование второго начала термодинамики придает энтропии конкретный физический смысл меры термодинамической вероятности состояния системы.
Вопрос№15. Определение термодинамической функции
Все
расчеты в термодинамике основываются
на использовании функций состояния,
называемых термодинамическими функциями.
Каждому наборунезависимых параметров
соответствует своя термодинамическая
функция. Изменения функций, происходящие
в ходе каких-либо процессов, определяют
либо совершаемую системой работу,
либо получаемую системой теплоту.
Термодинамические
функции являются функциями состояния.
Поэтому приращение любой из функции равно
полному дифференциалу функции, которой
она выражается. Полный дифференциал
функции f(x,у)
переменных х и у определяется
выражением
![]() (1)
Поэтому,
если в ходе преобразований мы получим
для приращёния некоторой
величины f выражение
вида
(1)
Поэтому,
если в ходе преобразований мы получим
для приращёния некоторой
величины f выражение
вида
![]() (2)
можно
утверждать, что эта величина является
функцией параметров
(2)
можно
утверждать, что эта величина является
функцией параметров ![]() и
и![]() ,
причем функции
,
причем функции ![]() и
и ![]() представляют
собой частные производные
функции
представляют
собой частные производные
функции![]() :
:
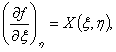
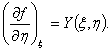 (3)
При
рассмотрении термодинамических
функций мы
будем пользоваться неравенством
Клаузиуса, представив его
в виде
(3)
При
рассмотрении термодинамических
функций мы
будем пользоваться неравенством
Клаузиуса, представив его
в виде
![]() (4)
Знак
равенства относится к обратимым, знак
неравенства - к необратимым процессам.
(4)
Знак
равенства относится к обратимым, знак
неравенства - к необратимым процессам.
Свобо́дная эне́ргия Гельмго́льца (или просто свобо́дная эне́ргия) — термодинамический потенциал, убыль которого в квазистатическомизотермическом процессе равна работе, совершённой системой над внешними телами.
Свободная энергия Гельмгольца для системы с постоянным числом частиц определяется так:
![]() ,
где
,
где ![]() — внутренняя
энергия,
— внутренняя
энергия, ![]() —
абсолютная температура,
—
абсолютная температура, ![]() — энтропия.
— энтропия.
Отсюда дифференциал свободной энергии равен:
![]() .
.
Видно,
что это выражение является полным
дифференциалом относительно независимых
переменных
и ![]() .
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию
.
Поэтому часто свободную энергию
Гельмгольца для равновесного состояния
выражают как функцию ![]() .
.
Для системы с переменным числом частиц дифференциал свободной энергии Гельмгольца записывается так:
![]() ,
,
где ![]() — химический
потенциал, а
— химический
потенциал, а ![]() —
число частиц в системе. При этом свободная
энергия Гельмгольца для равновесного
состояния записывается как функция
—
число частиц в системе. При этом свободная
энергия Гельмгольца для равновесного
состояния записывается как функция ![]() .
.
В приложениях «свободной энергией» иногда называют не свободную энергию Гельмгольца, а энергию Гиббса. Это связано с тем, что энергия Гиббса также является мерой максимальной работы, но в данном случае рассматривается только работа над внешними телами, исключая среду:
![]() ,
где
,
где ![]() —
энергия Гиббса.
—
энергия Гиббса.
Электрохимический потенциал — физическая величина, связывающая химический потенциал (μ) и электрический потенциал (φ) некоторой электрохимической системы соотношением:
A = μ + e·φ
где А — работа, нарушающая электрохимическое равновесие системы; e — элементарный заряд частицы.
Для растворенного вещества:
μ = μ0 + R*T*lnC + z*F*φ
где
μ0 - Стандартный химический потенциал, зависящий от природы растворителя.
С - концентрация вещества
R - газовая постоянная
T - температура
z - валентность иона
F - число Фарадея
φ - электрический потенциал
![]() или
(1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил. Выражение (1) в дифференциальной
форме будет иметь вид
или
(1)
Уравнение
(1) выражает первое
начало термодинамики:
теплота, сообщаемая системе, расходуется
на изменение ее внутренней энергии и
на совершение ею работы против внешних
сил. Выражение (1) в дифференциальной
форме будет иметь вид
![]() или
в более корректной форме
(2)
где
dU — бесконечно малое изменение
(приращение) внутренней энергии системы,
δA — элементарная работа, δQ — бесконечно
малое количество теплоты. В этом выражении
dU является полным дифференциалом, а δA
и δQ таковыми не являются. В дальнейшем
будем использовать запись первого
начала термодинамики в форме (2).
Из
формулы (1) мы видим, что в СИ количество
теплоты выражается в тех же единицах,
что работа и энергия, т. е. в джоулях
(Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии равно нулю: ΔU=0.
Тогда, согласно первому началу
термодинамики,
или
в более корректной форме
(2)
где
dU — бесконечно малое изменение
(приращение) внутренней энергии системы,
δA — элементарная работа, δQ — бесконечно
малое количество теплоты. В этом выражении
dU является полным дифференциалом, а δA
и δQ таковыми не являются. В дальнейшем
будем использовать запись первого
начала термодинамики в форме (2).
Из
формулы (1) мы видим, что в СИ количество
теплоты выражается в тех же единицах,
что работа и энергия, т. е. в джоулях
(Дж).
Если
система периодически возвращается в
первоначальное состояние, то изменение
ее внутренней энергии равно нулю: ΔU=0.
Тогда, согласно первому началу
термодинамики,
![]() т.
е. вечный двигатель первого рода —
периодически действующий двигатель,
совершающий бoльшую работу, чем сообщенная
ему извне энергия, — невозможен (одна
из формулировок первого начала
термодинамики).
т.
е. вечный двигатель первого рода —
периодически действующий двигатель,
совершающий бoльшую работу, чем сообщенная
ему извне энергия, — невозможен (одна
из формулировок первого начала
термодинамики).
Вопрос №16.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
где p — давление; V - объем T — температура; Zr = Zr (p,T) — коэффициент сжимаемости газа; m - масса; М —молярная масса; R — газовая постоянная.

Межмолекулярное взаимодействие, взаимодействие между электрически нейтральными молекулами или атомами; определяет существование жидкостей и молекулярных кристаллов, отличие реальных газов от идеальных и проявляется в разнообразных физических явлениях.Межмолекулярное взаимодействие зависит от расстояния r между молекулами и, как правило, описывается потенциальной энергией взаимодействия U(r) (потенциалом Межмолекулярное взаимодействие), так как именно средняя потенциальная энергия взаимодействия определяет состояние и многие свойства вещества.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Хотя модель идеального газа хорошо описывает поведение реальных газов при низких давлениях и высоких температурах, в других условиях её соответствие с опытом гораздо хуже. В частности, это проявляется в том, что реальные газы могут быть переведены в жидкое и даже в твёрдое состояние, а идеальные — не могут.
Считается также, что силы притяжения суммируются с внешним давлением. С учетом этих соображений уравнение состояния идеального газа преобразуется в уравнение Ван-дер-Ваальса:
 (1.5)
(1.5)
или для одного моля
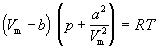 .
.
Проанализируем изотермы уравнения Ван–дер–Ваальса – зависимости Р от V для реального газа при постоянной температуре. Умножив уравнение Ван-дер-Ваальса на V 2 и раскрыв скобки, получаем
PV 3 – (RT + bP) vV 2 + av2V - abv3 = 0.
Поскольку данное уравнение имеет третью степень относительно V, а коэффициенты при V действительны, то оно имеет либо один, либо три вещественных корня, т.е. изобара Р = const пересекает кривую Р = Р(V) в одной или трех точках, как это изображено на рисунке 7.4. Причем с повышением температуры мы перейдем от немонотонной зависимости Р = Р(V) к монотонной однозначной функции. Изотерма при Ткр, которая разделяет немонотонные T < Tкр и монотонные T > Ткр изотермы, соответствует изотерме при критической температуре. При температуре выше критической зависимость Р = Р(V) является однозначной монотонной функцией объема. Это означает, что при T > Ткр вещество находится только в одном, газообразном состоянии, как это имело место у идеального газа. При температуре газа ниже критической такая однозначность исчезает, а это означает возможность перехода вещества из газообразного в жидкое и наоборот. На участке АСВ изотермы Т1 давление растет с увеличением объема (dP/dV) > 0. Данное состояние неустойчиво, поскольку здесь должны усиливаться малейшие флуктуации плотности. Поэтому область ВСА не может устойчиво существовать. В областях DLB и AGE давление падает с увеличением объема (dP/dV)Т < 0 – это необходимое, но не достаточное условие устойчивого равновесия. Эксперимент показывает, что система переходит из области устойчивых состояний GE (газ) в область устойчивых состояний LD(жидкость) через двухфазное состояние (газ – жидкость) GL вдоль горизонтальной изотермы GCL.
При квазистатическом сжатии, начиная с точки G, система распадается на 2 фазы – жидкость и газ, причем плотности жидкости и газа остаются при сжатии неизменными и равными их значениям в точках L и G соответственно. При сжатии количество вещества в газообразной фазе непрерывно уменьшается, а в жидкой фазе – увеличивается, пока не будет достигнута точка L, в которой все вещество перейдет в жидкое состояние.
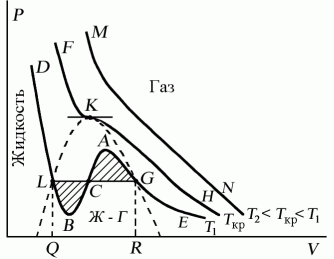 Рис.
7.4
Рис.
7.4
Наличие критической точки на изотерме Ван–дер–Ваальса означает, что для каждой жидкости существует такая температура, выше которой вещество может существовать только в газообразном состоянии. К этому заключению пришел и Д.И. Менделеев в 1861 г. Он заметил, что при определенной температуре прекращалось поднятие жидкости в капиллярах, т.е. поверхностное натяжение обращалось в нуль. При той же температуре обращалась в нуль скрытая теплота парообразования. Такую температуру Менделеев назвал температурой абсолютного кипения. Выше этой температуры, согласно Менделееву, газ не может быть сконденсирован в жидкость никаким увеличением давления.
Критическую точку K мы определили как точку перегиба критической изотермы, в которой касательная к изотерме горизонтальна (рис. 7.5). Ее можно определить также как точку, в которую в пределе переходят горизонтальные участки изотерм при повышении температуры до критической. На этом основан способ определения критических параметров Pk, Vk, Тk, принадлежащий Эндрюсу. Строится система изотерм при различных температурах. Предельная изотерма, у которой горизонтальный участок LG (рис. 7.4) переходит в точку, будет критической изотермой, а указанная точка – критической точкой (рис. 7.5).
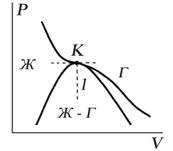 Рис.
7.5
Рис.
7.5
Отличия изотерм Ван-дер-Вальса и Эндрюса.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 92), видим, что последняя имеет прямолинейный участок 2—6,соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабильными. Участок 2—3 изображает перегретую жидкость, 5—6 —пересыщенный пар. Обе фазы ограниченно устойчивы.
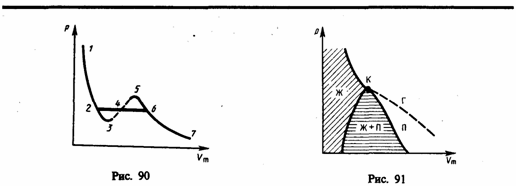
При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. 92). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8—9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости.
Вопрос№17.
Критическое состояние вещества
Сходство свойств ненасыщенных паров и газов натолкнуло М. Фарадея на предположение: не являются ли газы ненасыщенными парами соответствующих жидкостей? Если предположение верно, то можно попытаться сделать их насыщенными и сконденсировать. Действительно, сжатием удалось сделать насыщенными многие газы, кроме шести, которые М. Фарадей назвал "постоянными": это азот, водород, воздух, гелий, кислород, оксид углерода CO.
Чтобы понять, в чем здесь дело, изучим подробнее изотермический процесс сжатия (расширения) пара. Мы видели, что изотерма реального газа отличается от изотермы идеального газа наличием горизонтального участка, соответствующего области существования двухфазной системы: насыщенного пара и жидкости.
Если проводить опыты при более высоких температурах (T1 < T2 < T3 < Tk < T4), то можно обнаружить закономерность, общую для всех веществ (рис. 1).
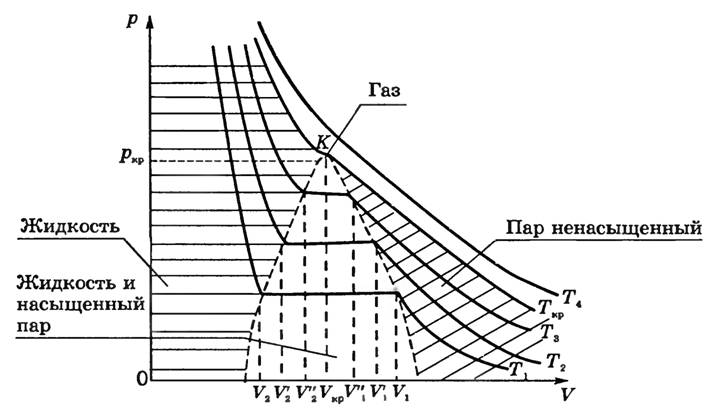
Рис. 1
Во-первых, чем выше температура, тем меньше объем, при котором начинается конденсация газа: V1 > V’1 > V’’1, если T1 < T2 < T3.
Во-вторых, чем выше температура, тем больше объем, занимаемый жидкостью после того, как весь пар конденсируется:
V2 < V’2 < V’’2 .
Следовательно, длина прямолинейного участка изотермы с ростом температуры уменьшается.
Это легко объяснить: с ростом Τ давление насыщенного пара быстро нарастает, и для того, чтобы давление ненасыщенного пара сравнялось с давлением насыщенного, необходимо уменьшение объема. Причина увеличения объема V2 — в тепловом расширении жидкости при нагревании. Так как объем V1 уменьшается, то плотность паров при увеличении температуры увеличивается; увеличение объема V2 свидетельствует об уменьшении плотности жидкости. Это значит, что различие между жидкостью и ее насыщенным паром в процессе такого нагревания сглаживается и при достаточно высокой температуре должно исчезнуть совсем.
Д. Менделеев установил, что для каждой жидкости должна существовать такая температура, которая экспериментально впервые была установлена для многих веществ Т. Эндрюсом и носит название критической температуры.
Критическая температура Tкр — это такая температура, при которой плотность жидкости и плотность ее насыщенного пара становятся одинаковыми (рис. 2).
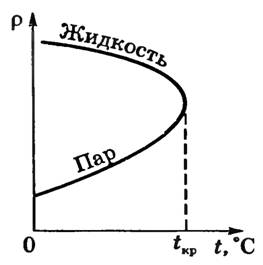
Рис. 2
На изотермах при Т = Tкр горизонтальный участок превращается в точку перегиба К.
Давление насыщенного пара какого-либо вещества при его критической температуре называется критическим давлением pкр. Оно является наибольшим возможным давлением насыщенных паров вещества.
Объем, который занимает вещество при pкр и tкр, называется критическим объемом Vкр. Это наибольший объем, который может занимать имеющаяся масса вещества в жидком состоянии.
При критической температуре различие между газом и жидкостью исчезает, и поэтому удельная теплота парообразования становится равной нулю.
Совокупность точек, соответствующих краям горизонтального участка изотерм (см. рис. 1), выделяет в плоскости p-V области существования двухфазной системы и отделяет ее от областей однофазных состояний вещества. Пограничная кривая области двухфазных состояний со стороны больших значений объема описывает состояние насыщенного пара и одновременно представляет собой кривую конденсации (начинается конденсация пара при изотермическом сжатии). Пограничная кривая со стороны меньших объемов представляет собой кривую, на которой заканчивается конденсация при сжатии насыщенного пара и начинается испарение жидкости при изотермическом расширении. Ее называют кривой испарения.
Существование критической температуры вещества объясняет, почему при обычных температурах одни вещества могут быть как жидкими, так и газообразными, а другие остаются газами.
Выше критической температуры жидкость не образуется даже при очень высоких давлениях.
Причина заключается в том, что здесь интенсивность теплового движения молекул оказывается настолько большой, что даже при относительно плотной их упаковке, вызванной большим давлением, молекулярные силы не могут обеспечить создание даже ближнего, а тем более дальнего порядка.
Таким образом, видно, что принципиальной разницы между газом и паром нет. Обычно газом называют вещество в газообразном состоянии, когда его температура выше критической. Паром называют также вещество в газообразном состоянии, но когда его температура ниже критической. Пар можно перевести в жидкость одним только увеличением давления, а газ нельзя.
В настоящее время все газы переведены в жидкое состояние при очень низких температурах. Последним в 1908 г. переведен гелий (tкр = -269 °С).
Критическая опалесценция - резкое усиление рассеяния света чистыми в-вами в критических состояниях, а также р-рами жидкостей или газов при достижении ими критических точек растворимости. O.К. объяснена в 1907 польск. физиком М. Смолуховским, показавшим, что при критич. темп-ре сжимаемость в-ва сильно возрастает, в связи с чем энергия теплового движения его ч-ц становится достаточной для “внезапного” сильного увеличения числа микроскопич. флуктуации плотности. В результате этого среда, практически прозрачная при темп-pax выше и ниже критической, в критическом состоянии становится мутной средой.
Вопрос №18.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава.
Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры. Когда внешнее давление падает ниже давления насыщенного пара, происходит кипение (жидкости) или возгонка (твёрдого тела); когда оно выше — напротив, конденсация или десублимация.