
- •Химическая термодинамика Пример решения вариант № 5
- •Величину ∆g для заданной температуры.
- •Величину Кр для заданной температуры.
- •Пример решения вариант №11
- •Величину ∆g для заданной температуры.
- •Величину Кр для заданной температуры.
- •Химическая кинетика
- •Химическая кинетика
- •Пример решения вариант №29
- •Химическая кинетика
- •Химическая кинетика
- •Пример решения вариант №10
- •Домашнее задание №2 диаграммы плавкости
- •Диаграммы плавкости Пример решения вариант №5
- •Растворы электролитов
- •Растворы электролитов Пример решения вариант №7
- •Растворы неэлектролитов
- •(Задача №2)
- •Равновесие в растворах электролитов (Задача №2) Пример решения вариант № 3
- •Экстракция
- •Экстракция Пример решения вариант №1
- •Решение:
- •Электропроводность
- •Электропроводность Пример решения вариант №12
- •Пример решения вариант №13
- •Пример решения вариант №15
- •Домашнее задание №3 поверхностные явления. Адсорбция (задача №1)
- •Поверхностные явления. Адсорбция (задача №1) Пример решения вариант №3
- •Пример решения вариант №19
- •Поверхностные явления. Адсорбция (задача №2)
- •Поверхностные явления. Адсорбция (задача №2) Пример решения вариант №9
- •Гальванические элементы (задача №1)
- •Гальванические элементы (задача №1) Пример решения №1
- •Пример решения №2
- •Пример решения №3
- •Гальванические элементы (задача №2)
- •Гальванические элементы (задача №2) Пример решения вариант №6
Гальванические элементы (задача №1) Пример решения №1
Напишите токообразующие реакции и общую суммарную реакцию, рассчитайте рН водного раствора хлороводородной кислоты, если ЭДС гальванического элемента:
Pt | H2 (101,3 кПа) | HCl || KCl | AgCl(т), Ag
При 298 К равна 0,3224 В. Потенциал хлорсеребряного электрода равен 0,2224 В.
Решение:
Токообразующие реакции:
на правом (хлорсеребряном) электроде AgCl + ē → Ag + Cl-
на левом (водородном) электроде ½ Н2 – ē → Н+
Суммарная реакция: AgCl + ½ H2 ↔ Ag + HCl
ЭДС гальванического элемента равна разности потенциалов правого и левого электродов:
Е=φправ. – φлев.
φправ.(хсэ)=0,2224 В
φлев.=![]() =
-0,059pH
=
-0,059pH
Тогда Е = 0,2224 – (-0,059рН)
Е = 0,3224 = 0,2224 + 0,059рН
![]()
Ответ: рН = 1,659.
Пример решения №2
ЭДС элемента
Pt, Н2(Р=101,ЗкПа) | NaOH || НСl (ан+ = 0,09) | (р = 101,ЗкПа), Pt
равна 0,6 В при Т = 298 К. Напишите токообразующие и суммарную реакции. Определите рН раствора гидроксида натрия, считая, что диффузионный потенциал устранен.
Решение:
Концентрационный гальванический элемент
Анод:Н2 - 2ē → 2Н+
Катод: 2Н+ + 2 → Н2
Н2+2Н+ ↔ 2Н+ +Н2
Е=φк – φа
φк
= ![]() ,
φк
= -0,059pH
,
φк
= -0,059pH
φк
= ![]()
E
= ![]()
![]()
![]()
![]()
![]()
pH = -lg aH+ = lg (10-11,21) = 11,21
Ответ: рН = 11,21.
Пример решения №3
Вычислить ЭДС следующего элемента при 298 К:
Zn| ZnCl || CdCl2 | Cd
С1=0,005 M C2=2M
Стандартные электронные пoтeнциaлы Cd2+|Cd и Zn2+|Zn
Соответственно равны -0,402 и -0,763 В. Средние коэффициенты активности CdCl2 и ZnCl в растворах указанных концентрацией равны 0,044 и 0,789.
Возможно ли за счет изменения концентрацией ионов кадмия и цинка в растворах изменить направление тока в элементе?
Решение:
Имеем электрохимический элемент, составленный из двух разных электродов первого рода: цинкового (-) и кадмиевого (+). На электродах протекают реакции:
(-)Zn = Zn2+ + 2e-
(+) Cd2+ + 2e- = Cd
Суммарная реакция, протекающая при работе электрохимического элемента, имеет вид:
Zn + Cd2+ = Zn2+ + Cd
Значения потенциалов каждого электрода равны:
![]()
![]()
Значение ЭДС элемента равно:
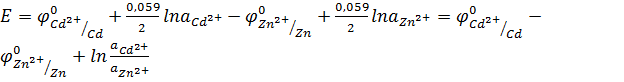
Подставим числовые значения, учитывая, что
![]()
![]()
![]()
Ответ: Е = 0,38466 В
Гальванические элементы (задача №2)
Для приведенной в таблице схемы гальванического элемента:
1)
Запишите
электродные и токообразующую реакции.
Рассчитайте величину стандартной ЭДС
(Е°)
по
значениям ![]() и
и ![]() взятых для соответствующих веществ в
справочнике и сравните полученный
результат с вычисленным по табличным
значениям стандартных электродных
потенциалов.
взятых для соответствующих веществ в
справочнике и сравните полученный
результат с вычисленным по табличным
значениям стандартных электродных
потенциалов.
2) Вычислите константу химического равновесия токообразующей реакции для Т=298 К. Будет ли эта реакция протекать в данном гальваническом элементе для стандартных условий самопроизвольно?
3)
Используя
значения активности электролитов,
рассчитайте величину электродвижущей
силы элемента при температуре Т,
К
на основании величины ![]() приняв, что в узком интервале
температур
зависимость Е
=f(Т)
линейная.
приняв, что в узком интервале
температур
зависимость Е
=f(Т)
линейная.
4)
Вычислить
![]() токообразующей
реакции при температуре Т,
К.
токообразующей
реакции при температуре Т,
К.
5)
Рассчитайте
![]() токообразующей реакции при температуре
Т,
К.
токообразующей реакции при температуре
Т,
К.
6) Вычислите тепловой эффект реакции при Т, К.
7) Сделайте вывод с нагреванием или охлаждением работает данный элемент?
№ варианта |
Гальванический элемент |
|
Природа электролита |
Величина активности электролита |
Т, К |
1. |
Pb, PbI2 |HI|AgI, Ag | Pb |
1,380 |
HI |
0,05 |
308 |
2. |
Pb, PbCl2 |KCl| Hg2Cl2, Hg| Pb |
1,454 |
KCl |
0,10 |
318 |
3. |
Hg, Hg2Cl2 |KCl| |KOH| HgO, Hg |
8,372 |
KCl; KOH |
0,50 |
308 |
4. |
Ag, AgCl |CdCl2| Cd | Ag |
-0,650 |
CdCl2 |
0,10 |
318 |
5. |
Hg, Hg2Cl2|KCl| AgCl, Ag|Hg |
3,384 |
KCl |
0,10 |
323 |
6. |
Zn|ZnSO4| |CdSO4|Cd|Zn |
1,018 |
ZnSO4; CdSO4 |
0,01 |
318 |
7. |
Hg, Hg2Cl2|KCl| |KBr| Hg2Br2, Hg |
1,017 |
KCl; KBr |
0,50 |
308 |
8. |
Tl, TlCl|KCl| AgCl, Ag|Tl |
1,028 |
KCl |
0,20 |
300 |
9. |
Zn|ZnCl2| AgCl,Ag|Zn |
-4,020 |
ZnCl2 |
0,10 |
313 |
10. |
Cd|CdSO4|Hg2SO4,Hg| Cd |
-0,406 |
CdSO4 |
0,10 |
308 |
11. |
Cu|CuSO4| |ZnSO4|Zn|Cu |
-0,830 |
CuSO4; ZnSO4 |
0,15 |
308 |
12. |
Pt, H2|HCl|AgCl, Ag|Pt |
-6,600 |
HCl |
0,25 |
313 |
13. |
Cd| CdCl2|AgCl,Ag| Cd |
6,500 |
CdCl2 |
0,50 |
318 |
14. |
Cd|CdCl2|PbCl2, Pb|Cd |
-4,800 |
CdCl2 |
0,25 |
308 |
15. |
Hg,Hg2Cl2|ZnCl2|Zn|Hg |
0,940 |
ZnCl2 |
0,25 |
313 |
16. |
Cu|CuCl2| |KOH| PbO, Pb|Cu |
3,850 |
CuCl2; KOH |
0,25 |
318 |
17. |
Pt, H2|HBr| AgBr, Ag|Pt |
-4,990 |
HBr |
0,10 |
323 |
18. |
Hg, Hg2SO4|H2SO4|H2,Pt|Hg |
-8,020 |
H2SO4 |
0,10 |
308 |
19. |
Hg, HgO|KOH| |KCl|Hg2Cl2, Hg |
-8,372 |
KOH; KCl |
0,25 |
313 |
20. |
Ag, AgCl|KCl|Hg2Cl2, Hg|Ag |
-3,284 |
KCl |
0,01 |
323 |
21. |
Hg, Hg2Br2|KBr| |KCl|Hg2Cl2,Hg |
-1,017 |
KBr; KCl |
0,01 |
318 |
22. |
Zn|ZnSO4| |CuSO4|Cu|Zn |
0,830 |
ZnSO4; CuSO4 |
0,50 |
308 |
23. |
Zn|ZnCl2|Hg2Cl2, Hg|Zn |
-0,940 |
ZnCl2 |
0,50 |
313 |
24. |
Pb, PbO|KOH| |CuCl2|Cu|Pb |
-3,850 |
KOH; CuCl2 |
0,10 |
318 |
25. |
Pt, H2|H2SO4|Hg2SO4, Hg|Pt |
8,020 |
H2SO4 |
0,20 |
323 |
