
- •Химическая термодинамика Пример решения вариант № 5
- •Величину ∆g для заданной температуры.
- •Величину Кр для заданной температуры.
- •Пример решения вариант №11
- •Величину ∆g для заданной температуры.
- •Величину Кр для заданной температуры.
- •Химическая кинетика
- •Химическая кинетика
- •Пример решения вариант №29
- •Химическая кинетика
- •Химическая кинетика
- •Пример решения вариант №10
- •Домашнее задание №2 диаграммы плавкости
- •Диаграммы плавкости Пример решения вариант №5
- •Растворы электролитов
- •Растворы электролитов Пример решения вариант №7
- •Растворы неэлектролитов
- •(Задача №2)
- •Равновесие в растворах электролитов (Задача №2) Пример решения вариант № 3
- •Экстракция
- •Экстракция Пример решения вариант №1
- •Решение:
- •Электропроводность
- •Электропроводность Пример решения вариант №12
- •Пример решения вариант №13
- •Пример решения вариант №15
- •Домашнее задание №3 поверхностные явления. Адсорбция (задача №1)
- •Поверхностные явления. Адсорбция (задача №1) Пример решения вариант №3
- •Пример решения вариант №19
- •Поверхностные явления. Адсорбция (задача №2)
- •Поверхностные явления. Адсорбция (задача №2) Пример решения вариант №9
- •Гальванические элементы (задача №1)
- •Гальванические элементы (задача №1) Пример решения №1
- •Пример решения №2
- •Пример решения №3
- •Гальванические элементы (задача №2)
- •Гальванические элементы (задача №2) Пример решения вариант №6
Поверхностные явления. Адсорбция (задача №2) Пример решения вариант №9
При изучении адсорбции брома углем из воды были получены следующие данные:
Равновесная молярная концентрация (Вг2), моль/л |
0,00259 |
0,00659 |
0,01708 |
0,029975 |
Г, моль/кг |
3,10 |
4,27 |
5,44 |
6,8 |
Определите константы b и Г∞ в уравнении Ленгмюра графическим методом.
Решение:
Переведем моль/л в моль/м3, получим:
С (Вг2), моль/м3 |
2,59 |
6,59 |
17,08 |
29,975 |
Г, моль/кг |
3,10 |
4,27 |
5,44 |
6,8 |
1/Г, кг/моль |
0,32258 |
0,234 |
0,1838 |
0,147 |
1/С, м3/моль |
0,3861 |
0,1517 |
0,58548 |
0,03336 |
1/Г∞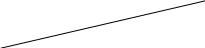

![]() → Г∞
= 8 моль/кг
→ Г∞
= 8 моль/кг
![]() → b
= 0,25
→ b
= 0,25
Уравнение
Ленгмюра:
![]()
![]()
Гальванические элементы (задача №1)
1. ЭДС электрохимического элемента
Hg, Hg2Cl2 | KCl(aq) || AgNO3(aq) | Ag
c1=0,1M c2=0,1M
при 298 К равна 0,399 В. Определите стандартный электродный потенциал серебряного электрода, если известно, что потенциал децимолярного каломельного электрода равен 0,336 В, а средний коэффициент активности AgNO3 в 0,1 М растворе равен 0,77.
2. Вычислите ЭДС гальванического элемента
Zn | ZnCl2(aq) | AgCl, Ag
c = 0,0102M
если средний коэффициент активности ZnCl2 в указанном растворе равен 0,714, а стандартные потенциалы электродов Zn2+/ Zn и Сl-/AgCl, Ag соответственно равны - 0,758 и 0,226 В.
3. Пользуясь данными справочника о стандартных электродных потенциалов рассчитайте ЭДС при 298 К. Напишите схему гальванического элемента в котором обратимо протекает реакция:
МnO2 + 4Н+ + 2Fe2+ ↔ Mn2+ + 2Fe3+ + 2Н2O
4. Вычислите ЭДС цепи при 298 К:
Pt, H2 | HCl(aq) Cl2, Pt
е сли:
а) концентрация НС1
равна
1,0
М
и парциальные давления газов по 1,013·105
Па;
б) концентрация НС1
равна 0,1
М
и парциальные давления газов по 1,013·104
Па.
Средний коэффициент активности НС1
в 1
М
растворе равен 0,809
и в 0,1
М
НС1
- 0,796.
Стандартный потенциал электрода
сли:
а) концентрация НС1
равна
1,0
М
и парциальные давления газов по 1,013·105
Па;
б) концентрация НС1
равна 0,1
М
и парциальные давления газов по 1,013·104
Па.
Средний коэффициент активности НС1
в 1
М
растворе равен 0,809
и в 0,1
М
НС1
- 0,796.
Стандартный потенциал электрода
Pt, Cl2 | Сl- равен 1,360 В.
5. Элемент состоящий из водородною и каломеньного электродов, имеет ЭДС, равную 0,66 В при температуре 298 К. Рассчитайте рН раствора в водородном электроде, φ0кал.эл. = 0,2412В.
6. Определите активность ионов кадмия в 0,025М растворе CdCl2, если ЭДС элемента
Cd | CdCl2(aq) || KCl(aq)| Hg2Cl2, Hg
c1=0,025M c2=0,1M
при 290 К равна 0,824 В. Потенциал децимолярного каломельного электрода равен 0,334 В, а стандартный потенциал кадмиевого электрода - 0,403 В.
7. Пользуясь таблицами стандартных потенциалов установите, в каком направлении идет химическая реакция в гальваническом элементе, составленном из следующих электродов:
Pt | Т13+, Тl+ и Pt | Fe3+, Fe2+, если aTl3+/ аTl+ = 0,5; aFe3+/ aFe2+ =0,1.
Рассчитайте ЭДС при 298 К и напишите схему гальванического элемента.
8. Определите стандартный потенциал для каломельного электрода при 298 К, если ЭДС цепи
Pt, Н2 | HCl(aq) | Hg2Cl2, Hg
pH2=1,013·105 Па с=0,1М
равна 0,398 В, а средний коэффициент активности для 0,1 М раствора соляной кислоты равен 0,796.
9. Вычислите ЭДС элемента:
Hg, Hg2Cl2| KCl(aq) || Ag N03(aq) | Ag
a = 1 c = 3
Стандартный электродный потенциал серебряного электрода равен 0,799 В. Средний коэффициент активности Ag NO3 в 3,0 М растворе равен 0,252. Потенциал стандартного каломельного электрода равен 0,268 В.
10. Определите при 298 К ЭДС элемента
Н2, Pt | CH3COOH(aq) | HCOOH(aq) | Pt, Н2
c1=0,5M c2=1M
Константа диссоциации муравьиной кислоты 1,8·10-4, уксусной - 1,8·10-5. Укажите знаки электродов элемента. Давление газообразного водорода в обоих электродах одинаково.
11. Вычислите при 298 К ЭДС и напишите схему концентрационного элемента, составленного из двух серебряных электродов, погруженных в растворы 0,01 и 0,1 М AgNO3 соответственно. Число переноса аниона NO3- в растворе равно 0,527. Коэффициент активности нитрата серебра для более концентрированного раствора равен 0,872; для 0,01 М раствора примите равным 1.
12. Рассчитайте ЭДС элемента при 298 К
Н2, Pt | CH3COOH(aq) || NH4OH(aq) | Pt, H2
p1 c1=0,1M c2=0,01M p2
при одинаковых значениях давления газообразного водорода. Константа диссоциации уксусной кислоты и гидроксида аммония соответственно равны 1,8·10-5 и 1,7·10-5. Произведение растворимости воды примите равным 1,2·10-14. Расставьте знаки электродов в элементе.
13. Под каким давлением находится водород в левом полуэлементе, если ЭДС элемента
H2, Pt | HCl(aq) | Pt, H2
p1(H)=? c=0,1M p2=1,013·105 Па
при 298 К равна 0,0059 В, если средний коэффициент активности ионов HCl в 0,1 М растворе равен 0,8.
14.Расчитайте ЭДС элемента при 298 К
Н2, Pt | KOH(aq) || HCl(aq) | Pt, H2
с1=0,1М с2=0,1М
если средний коэффициент активности ионов НСl в 0,1 М растворе равен 0,796, а средний коэффициент активности ионов КОН в 0,1 М растворе равен 0,8.
15. ЭДС элемента
Н2, Pt | HCl(aq) | AgCl, Ag
при 298 К и РH2 = 1,013·105 Па равна 0,322 В. Напишите токообразующие реакции и рассчитайте рН раствора НСl.
16. Какова при 298 К ЭДС элемента
H2, Pt | HCOOH(aq) || CH3COOH(aq) | Pt, H2
p2 = 1,013·105 Па с1 = 0,01М с2 = 0,1М
Средние коэффициенты активности принять одинаковыми. Константы диссоциации уксусной и муравьиной кислот соответственно равны 1,8·10-5 и 1,8·10-4.
17. Вычислите активность лития в амальгаме при 298 К, если ЭДС элемента
Li, Hg | LiCl(aq) | AgCl, Ag
c = 1M
равна 2,2 В. Стандартный потенциал амальгамы лития равен - 2,044 В. Коэффициент активности раствора хлорида лития примите равным 0,744.
18. Рассчитайте активность НСl и средний коэффициент активности в водном 0,01 M растворе, если при 298 К ЭДС элемента равна 0,463 В.
Н2, Pt | HCl(aq) | AgCl, Ag
pH2 = 1 c = 0,01M
Значение стандартного потенциала хлорсеребряного электрода равно 0,2224 В.
19. Для электрохимического элемента
Zn | ZnSO4(aq) | PbSO4, Pb
при 298 К ЭДС равна 0,558 В при концентрации ZnSO4 равной 0,005 М. Напишите химические уравнения для процессов протекающих в цепи и определите средний коэффициент активности раствора ZnSO4.
20. Вычислите при 298 К ЭДС элемента
Pt, H2 | H2SO4(aq) | Hg2SO4, Hg
pH2 = 1,013*105 Па c = 2M
если средний коэффициент активности раствора H2SO4 равен 0,12.
21. Вычислить ЭДС элемента.
Pt | Ti4+, Ti3+ || Sn4+, Sn2+| Pt
a=l, a=l a=l, a=l
Значение стандартных потенциалов для электродов Ti4+, Ti3+ и Sn4+, Sn2+ соответственно равны 0,04 и 0,15 В. Написать окислительно-восстановительную реакцию работы элемента.
22. Рассчитать ЭДС и дать схему гальванического элемента, в котором обратимо протекает реакция
2FeCl2 + H3AsO4 + 2HC1 ↔ 2FeCl3 + HAsO2 + 2H2O
при Р=1,013·105 Па, Т=298 К.
Активность ионов, участвующих в реакции aFe2+= 0,005М, ah3AsO4 = 0,2М
aFe3+ = 0,02M, aHAsO2 = 0,1М
аH+ = 0,01М
aH2O = 1M
23. Определите знаки электродов амальгамного концентрационного элемента Cd(Hg) | CdSO4(aq) | Cd(Hg)
a1 a2
Рассчитайте ЭДС этого элемента при 298 К. если a1=4,3·10-2 моль/л и а2=4,3·10-3 моль/л.
24. Вычислите при 298 К концентрационного элемента
Pt | Fe3+, Fe3+ || Fe2+, Fe3+ | Pt, если активности ионов равны:
a1(Fe3+) = 0,l a2(Fe3+) = 0,4
a1(Fe2+) = 0,5 a2(Fe2+) = 0,04
25. ЭДС гальванического элемента при 298 К составленного из 2-х стеклянных электродов, погруженных в растворы хлорводородной кислоты равна 0,118 В. Вычислите рН водного раствора НСl в первом электроде, если рН раствора НСl во втором электроде равна 3. Считаем, что мембраны стеклянных электродов идентичны.
