
Галогены.
К галогенам относятся фтор ("разрушающий"), хлор ("жёлто-зелёный"), бром ("зловонный"). йод ("фиолетовый"), астат ("неустойчивый"). Астат радиоактивно получен, существует короткий промежуток времени (период полураспада наиболее долгоживущего изотопа 2l,)At равен 8,3 часа). В связи с этим астат мало изучен, сведения о нём противоречивы, поэтому мы рассматриваем его свойства.

,35 Br -2е,8е,18е,7е 1S22S22P63S:3P"4S:4I>- Вал 1,3,5,7.
,53 I -2е,8е,18е,18е,7с IS22S221>63S23P64S24Pb5S25I>5 Вал 1,3,5,7.
Молекулы галогенов двухатомны, имеют ковалентную неполярную связь, молекулярную кристаллическую решётку.
Физические свойства.
F2- газ светло-зелёного цвета, с раздражающим запахом, ядовит. Clj - газ жёлто-зелёного цвета, токсичен, вызывает воспаление дыхательных путей, мучительный кашель, а при длительном воздействии хлора может развиться отёк лёгких. Растворим в воде (в 1 объёме воды растворяется 2 объёма хлора).
Вг2- тяжёлая красно-бурая жидкость, с удушливым резким запахом. Бром в чистом виде сильно раздражает слизистые оболочки верхних дыхательных путей, лёгких. Действие брома на кожу ведёт к появлению ожогов и язв.
1г - серое кристаллическое вещество с металлическим блеском.
От фтора к йоду плотность, температура кипения и плавления, молярная масса увеличиваются. Химическая активность и окислительная способность от фтора к йоду уменьшается.
Нахождение в природе. Фтор более распространён в природе, чем другие галогены. В свободном состоянии не встречается вследствие своей высокой химической активности. Содержание его в земной коре составляет 0,065%. В природе встречаются соли фтора:
OiF:- флюорит, плавиковый шпат CarfPQjjF- фторапатит NayilFf,- криолит.
В свободном состоянии хлор в природе не встречается вследствие своей высокой химической активности. Большое количество хлоридов сосредоточено в воде океанов, морей и соляных озёр.Широко распространены его соединения - хлориды щелочных и щелочноземельных металлов:
NaCI каменная, поваренная соль
KCI ' NaCI -сильвинит
КО' MgCh6Н20 карналлит
В свободном состоянии бром в природе не встречается. Он не образует самостоятельных минералов. Широко распространены соединения брома соли щелочных металлов. Бром входи! как примесь в состав минералов, содержащих хлор.
Мол встречается в небольших концентрациях в морской воде, в золе морских водорослей сто содержится 0.4%. Соли йода содержатся в водах буровых скважин, в составе солей щелочных, металлов, содержащих хлор;
.Меднко - биологическое tiiu'ieniie галогенов.
Фтор входит в состав жали зубов (соединение фтора в эмали по химическому характеру близко к апатиту). При недостатке фтора развивается кариес, при его избытке происходит разрушение эмали зубов.
Хлорид натрии необходим для поддержания жизни в организме человека содержится 0,25% хлора в виде ионов. Солевой обмен связан с водным балансом организма. Повышенное содержание хлорида натрия удерживает воду в тканях, ('лишком большое количество соли вредно: развивается гипертония, склероз сосудов.
Йод содержится в щитовидной железе и надпочечниках. Гормон щитовидной железы
(тироксин) определяет общий темп процессов жизнедеятельности и развития. 11рн недостатке
йода рашииистея заболевание шдемячеекнз+ зоб -которое часчч* наблюдается в горных районах, где вода содержит недостаточное количество этого элемента. Малые дозы йодистых солей, добавленных в пищу, благоприятно влияют на состояние больных атеросклерозом. Увеличение доз йода может привести к развитию простудных заболеваний, так как йод ннактивирует витамин Л.
Химические свопе i пл.
1. С металлами образуют галл иды.
2Fe I ЗСЬ = 2FeCl3 2Sb 5СЬ - 2SbCl5
2К т Вг:-2КВг 2Л1 »- ЗЬ- 2ЛП,
2. С неметаллами
С кислородом, углеродом и азотом галогены непосредственно не реагируют.
а) с водородом Химическая активность от фтора к йоду уменьшается.
\\i +- l:2 = 2HF + Q (в темноте со взрывом) Иг + СЬ - 2HCI + Q (на свету со взрывом) Н2 + Вг2 = 2ИВг + Q 200"С H2+I2 = 2HI-Q Свободно-радикальный механизм реакции.
hv
Н2+СЬ = 2НС1
С1:С1 ->2С1* з
CI* + H2-> HC1 + H* H* + C12->HC1 + C1* и т.д.
б) с серой
S + F2 = SF2 (SF4,SF6) - газы
S + Cl2 = S2C12 (SCJ2.SCI4) - жидкости
в) с фосфором
2Р + 5С12 = 2РС1< 2Р + ЗС12 = 2РС13
г) с кремнием
Si + 2CI2 = SiCL,
3. С водой
Вода горит во фторе, поэтому приготовить раствор фтора в воде нельзя. F2 + Н20 = 2HF + О+Q Идут побочные реакции.
F2 + 0 = OF2 0 + 0 = 02
Н20 + 0 = Н202 02 + 0 = 03
Раствор хлора в воде называется хлорной водой. Она применяется для отбелки тканей бумаги, соломы и для дезинфекции питьевой воды (атомарный кислород убивает микроорганизмы и разрушает красители).
hv hv
Cl2 + Н20 = НС1 + НСЮ 2С12 + 2Н20 = 4НС1 + 02 НСЮ = НС1 + О
хлорная вода
При нагревании хлорноватистой кислоты в темноте в присутствии её соли реакция разложения протекает согласно уравнению ЗНС10- 2НС1 4 НСЮз
хлорноватая кислота
Аналогично хлору реагируют бром и йод с водой. В1л воды при 20°С растворяется 35г брома. Значительно лучше растворяется бром в органических растворителях.
Йод при нагревании возгоняется, образуя фиолетовые пары. Йод слабо растворим в воде: в1л
ВОДЫ при 20 С растворяется 0,2г, НО ХОРОШО растворим В органических растворителях. Лучшим
растворителем йода является раствор йодида калия. KI +12 = К13 (KI' 12).
4. Со щелочами.
2NaOH + 2 F2 = 2NaF + OF2 + H20 2KOH + CI2 = KCI + КСЮ + H2Q холодный жавелевая вода применяется для отбелки ткани, бумаги.
Механизм отбелки.
■г НС1
КСЮ + С02 + Н20 = КНСОз + НСЮ ^ гипохлорит О
калия
6 КОН - ЗСЬ = 5КС1 + КСЮз + 3 Н20 горячий хлорат
коиц. калия, бертолетовая соль используется для изготовления спичек
(на коробке находится красный фосфор, на головке спички -бертолетовая соль), гербицидов, в пиротехнике, как окислитель.
5КС103 + 6Р - 5KCI • ЗР;()< - О
150°С,МпО, 2КСЮ3 = 2КС1 +302
'. 4оо°с 4КС10з = KCI + ЗКСЮ,
перхлорат калия
500°С
2КС103 = 2KCI +302 500°С
КСlO.i = КС! ь 202
Хлорная белильная известь применяется для дезинфекции, дегазации, отбелки ткани, бумаги, соломы.
2Са(0НЬ • CI2 СаС'1- • Са(ОС1)2 » 2Н20
хлорная белильная известь Са(,ОН)2 + С12 = СаОС12 + И20 ХДбрИая белильная известь
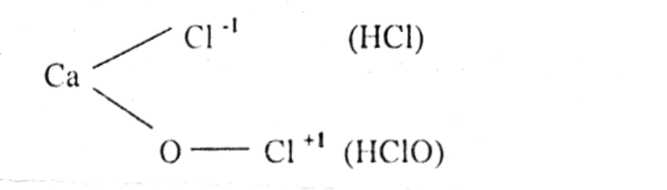
Механизм отбелки.
СаОСЬ + С02 - СаСОз + С12 у 2 ! IC1
2 СаОСЬ + С02 + Н20 = СаСЬ i CaCOj <- 2 НСЮ ^
20_
5. Более активный галоген вытесняет менее активный галоген из растворов его солей.
2NaBr + Cl2=2NaCl + Br2 2KI + С12 - 2КС1 + 12 2KI + Br2=2KBr + I2
6. Галогены вытесняют серу из сульфидов и сероводородной кислоты.
H2S + C12=2HC1 + S Na2S + I2 = 2NaI + S
7. Галогены являются окислителями для многих веществ.
S02 + Br2 + 2Н20 = H2S04 + 2НВг (аналогично хлор, йод) Na2S03 + С12 + Н20 = Na2S04 + 2НС1 12 + 5С12 + 6Н20 = 2НЮ3 + 10НС1 2FeCl2 + Cl2=2FeCl3
Получение галогенов.
Выделение фтора в свободном состоянии сильно затруднено ввиду его чрезвычайно высокой активности. Получают его в небольших количествах электролизом расплава дифторида калия KF ' HF в свинцовой аппаратуре. В промышленности хлор получают электролизом расплава или раствора хлоридов щелочных металлов.
эл. ГОК 2NaCl = 2Na ' СГ2
р-U )Л. ГОК
2NaCl ь2!ЬО 2\'а()Н 1Ь • СЬ Р-Р
В .забора горим хлор получают действием концентрированной соляной кислоты на окислители.
Мп(Ь + 4НС1 - МпС'Ь - СЬ + 2Н:()
2КМп()| * I6HC1 2КС1 • 2МпСЬ i- 5СЬ >• 81 ЬО
КС10з*6НС! = КС1 • ЗС12 + ЗН2б
К2Сг207 ► I4HC1 - 2KCI + 2СгСЬ + ЗСЬ + 71 ЬО
2СЮз+ 12ИС1 - 2СгСЬ+ ЗС12+ 6Н20
РЬ02 + 411С! = РЬС12 + СЬ + 2Н20
СаОСЬ + 2 НС! = СаС12+С12+ Н20
В промышленности бром получают, вытесняя его хлором из бромидов. 2NaBr • СЬ - 2NaCl + Вг2
В лаборатории бром получают действием концентрированной бромоводородной кислоты на окислители.
МпО: + 4HBr = MnBr 2 + Вг2 + 2Н20
2КМпО^ + 16ИВг = 2КВг + 2МпВг2 + 5Вг2 + 8Н20
КСЮ;, + 6НВг = КС! + ЗВг2 + ЗН20
В промышленности йод получают из золы морских водорослей и вод буровых скважин действием хлора на йодиды. 2К1 + СЬ-2КС1 + 12
В лаборатории йод получают аналогично хлору, действием концентрированной йодоводородной кислоты на окислители. КВЮ3 + 6HI = КВг + 312 + ЗН20 2FeCl3+ 2HI = 2FeCl2 + I2 + 2НС1 2CuS04 + 4HI = 2CuI + 2H2S04 + I2
_ — " Применение.
Свободный фтор используется редко. Применяется для получения фторированных зубных паст. Его используют для производства пластмасс - тефлон, высокотемпературных смазочных масел, жидкостей для холодильных машин - фреон -12(CF2C12).
Хлор используется для отбелки ткани, бумаги, соломы, для дезинфекции питьевой воды, для производства ядохимикатов, хладоагентов, соляной кислоты, бертолетовой соли, красителей, лекарственных препаратов, пластмасс.
Бром используется для получения различных бромоорганических соединений, используемых в лакокрасочной и фармацевтической промышлености. Значительное его количество расходуется на производство бромида серебра,используемого как светочувствительное вещество в кинопромышленности, hv
2AgBr = 2Ag + Br2 hv
2AgCl = 2Ag + (светочувствительное вещество в стёклах - хамелеонах) Йод применяют в медицине в виде йодной настойки, в составе многих лекарственных препаратов.
