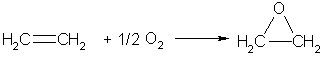- •II. Реакции окисления
- •III. Термические превращения алканов
- •53. Алкены. Изомерия и номенклатура. Электронное строение. Р-ции в боковой цепи. Использование в лабораторной практике и промышленности.
- •Галогенирование Механизм электрофильного присоединения.
- •Гидрогалогенирование
- •Присоединение протонных кислот и воды
- •Реакция полимеризации
- •7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
- •54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
- •55. Алкины. Изомерия и номенклатура. Применение алкинов. Образование ацетиленид-анионов и их использование в орг синтезе.
- •56. Реакции присоединения по кратной связи алкинов (гидрогенирования, галогенирования, гидрогалогенирования, гидратации, полимеризации, окисления): механизмы и основные закономерности.
- •57. Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Химические свойства, понятие о термодинамическом и кинетическом контроле реакций присоединения к сопряженным диенам.
- •II. Пространственная
- •58. Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы.
- •58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
- •60. Реакции бензола и его конденсированных аналогов с нарушением ароматичности (гидрогенирование, окисление, галогенирование).
- •61. Примеры синтетич. Использования р-ций аренов(нитрования, галогенирования, сульфирования, ацилирования, алькилирования по Фриделю Крафтцу). Синтез жирноароматических альдегидов и кетонов
- •62. Представление о реакциях нуклеофильного замещения и элиминирования как конкурентных процессах в ряду монофункционально замещенных углеводородов (галогеналканы, спирты, амины).
- •63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
- •65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
- •66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
- •67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
- •69. Фенолы. Номенклатура, строение, изомерия. Химические свойства: кислотность (влияние заместителей), р-ции по он-группе (в сравнении с алканами) и ароматическому кольцу (в сравнении с аренами).
- •71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
- •72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
Галогенирование Механизм электрофильного присоединения.
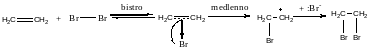
π-комплекс σ-компленк (карбкатион)
Гидрогалогенирование
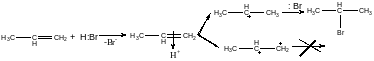 π-комплекс
σ-комплекс
π-комплекс
σ-комплекс
Современная трактовка правила Марковникова:присоединение протона к алкену протекает в направлении обр-ния наиболее стабильного карбкатиона (Н присоед-ся к наиболее гидрогенизированного атому С).
Исключения
из правила Марковника:Причиной
протекания против правила Марковникова
может служить изменение мех-ма р-ции.
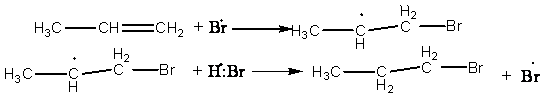
Р-ция присоед-я НBr
к алкенам в присутствии перекиси
протекает не по электрофильному, а по
радикальному О способствует гомолитическому
распаду НBr,
освобождая атом Br,
кот атакует двойную связь по пространственно
более доступному атому С, образуя более
устойчивый вторичный радикал:
![]()
Присоединение протонных кислот и воды
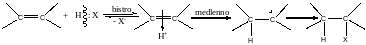 Где Х=
--Наl,
--OSO3H,
--OH.
Где Х=
--Наl,
--OSO3H,
--OH.
Гидратация . Взаимодействие с водой, только в присутствии кислот.
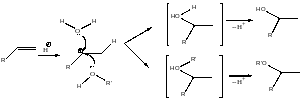
Реакция полимеризации

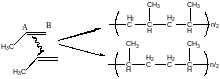
«голова-хвост»
«голова-голова»
Полимеризация может пойти по типу «голова-голова» или «голова-хвост».
6. Реакции окисления. Реакция Вагнера служит качественной реакцией на двойную связь. Окисление по Вагнеру — взаимодействие алкена с водным р-ром KMnO4 на холоду (+10 °С). В таких мягких условиях окисление протекает без полного разрыва двойной связи и приводит к образованию диолов:
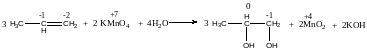
Пропилен 1,2-пропандиол
7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
Этен преимущественно используют для получения полиэтилена и для превращения полученного из него винилхлорида в поливинилхлорид:
 Большие
кол-ва этена перерабатываются в эпоксид
и далее в этиленгликоль, основную часть
кот используют для получения
полиэтилентерефталата (лавсана).
Тетрахлор-этен
(перхлорэтилен) и 1,1,1-трихлорэтан
применяют в кач-ве растворителей для
сухой химчистки.
Большие
кол-ва этена перерабатываются в эпоксид
и далее в этиленгликоль, основную часть
кот используют для получения
полиэтилентерефталата (лавсана).
Тетрахлор-этен
(перхлорэтилен) и 1,1,1-трихлорэтан
применяют в кач-ве растворителей для
сухой химчистки.
54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
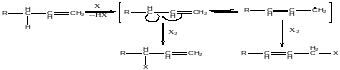
Хим св-ва алкенов определяются наличием в их молекулах двойной связи. Электронная плотность -связи достаточно подвижна и легко вступает в реакции с электрофильными частицами. Поэтому многие реакции алкенов протекают по механизму электрофильного присоединения. Реакции злектрофильного присоединения - это ионные процессы, протекающие в несколько стадий. На первой стадии электрофильная частица (чаще всего это бывает протон H+) взаимодействует с -электронами двойной связи и образует -комплекс, который затем превращается в карбокатион путем образования ковалентной -связи между электрофильной частицей и одним из атомов углерода:
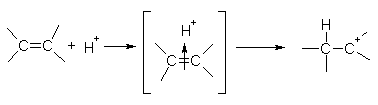
алкен π-комплекс карбкатион
На второй стадии карбокатион реагирует с анионом X-, образуя вторую π-связь за счет электронной пары аниона:
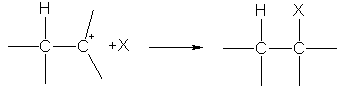
Ион водорода в реакциях электрофильного присоединения присоединяется к тому из атомов углерода при двойной связи, на котором больше отрицательный заряд. Распределение зарядов определяется смещением π-электронной плотности под влиянием заместителей:
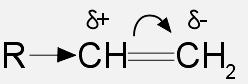
Электронодонорные заместители смещают π-электронную плотность к более гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд. Этим объясняется правило Марковникова: при присоединении полярных молекул типа НХ (X= Hal, ОН, CN и т.п.) к несимметричным алкенам водород преимущественно присоединяется к более гидрогенизированному атому углерода при двойной связи.
1) Гидрогалогенирование. При взаимодействии алкенов с галогеноводородами (HCl, НВr) образуются алкилгалогениды:
СН3-СН=СН2 + НВr →СН3-СНВr-СН3.
Продукты реакции определяются правилом Марковникова. В присутствии какого-либо органического пероксида полярные молекулы НХ реагируют с алкенами не по правилу Марковникова:
-
R-O-O-R
СН3-СН=СН2 + НВr
→
СН3-СН2-Н2Вr
Это связано с тем, что присутствие перекиси обусловливает радикальный, а не ионный механизм реакции.
2) Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова:
СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
3) Галогенирование. Алкены обесцвечивают бромную воду:
СН2=СН2 + Вr2 → ВrСН2-СН2Вr.
Эта реакция является качественной на двойную связь.
4) Гидрирование. Присоединение водорода происходит под действием металлических катализаторов: |
t, Ni |
|
СН3-СН=СН2 + Н2 |
→ |
СН3-СН2-СН3 |
5) Полимеризация алкенов и их производных в присутствии кислот протекает по механизму АE:
-
nCH2=CHR
→(-CH2-CHR-)n
6) Реакции окисления. При мягком окислении алкенов водным раствором перманганата калия (реакция Вагнера) образуются двухатомные спирты:
ЗСН2=СН2 + 2КМnО4 + 4Н2О → ЗНОСН2-СН2ОН + 2MnO2↓ + 2KOH.
реакция является качественной на двойную связь. При жестком окислении алкенов кипящим раствором перманганата калия в кислой среде происходит полный разрыв двойной связи с образованием кетонов, карбоновых кислот или СО2, например:
-
[О]
СН3-СН=СН-СН3
→
2СН3-СООН
По продуктам окисления можно установить положение двойной связи в исходном алкене.
Если смешать алкен с кислородом и пропустить эту смесь над нагретым до 200°С серебряным катализатором, то образуется оксид алкена (эпоксиалкан), например: