
- •II. Реакции окисления
- •III. Термические превращения алканов
- •53. Алкены. Изомерия и номенклатура. Электронное строение. Р-ции в боковой цепи. Использование в лабораторной практике и промышленности.
- •Галогенирование Механизм электрофильного присоединения.
- •Гидрогалогенирование
- •Присоединение протонных кислот и воды
- •Реакция полимеризации
- •7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
- •54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
- •55. Алкины. Изомерия и номенклатура. Применение алкинов. Образование ацетиленид-анионов и их использование в орг синтезе.
- •56. Реакции присоединения по кратной связи алкинов (гидрогенирования, галогенирования, гидрогалогенирования, гидратации, полимеризации, окисления): механизмы и основные закономерности.
- •57. Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Химические свойства, понятие о термодинамическом и кинетическом контроле реакций присоединения к сопряженным диенам.
- •II. Пространственная
- •58. Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы.
- •58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
- •60. Реакции бензола и его конденсированных аналогов с нарушением ароматичности (гидрогенирование, окисление, галогенирование).
- •61. Примеры синтетич. Использования р-ций аренов(нитрования, галогенирования, сульфирования, ацилирования, алькилирования по Фриделю Крафтцу). Синтез жирноароматических альдегидов и кетонов
- •62. Представление о реакциях нуклеофильного замещения и элиминирования как конкурентных процессах в ряду монофункционально замещенных углеводородов (галогеналканы, спирты, амины).
- •63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
- •65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
- •66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
- •67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
- •69. Фенолы. Номенклатура, строение, изомерия. Химические свойства: кислотность (влияние заместителей), р-ции по он-группе (в сравнении с алканами) и ароматическому кольцу (в сравнении с аренами).
- •71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
- •72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
В зависимости от количества ОН групп в молекуле спирты делят на: одноатомные (1 ОН-группу), метанол СН3ОН, этанол С2Н5ОН. Многоатомные (2 и более ОН групп), этиленгликоль HO–СH2–CH2–OH, глицерин HO–СH2–СН(ОН)–CH2–OH.
В зависимости от атома С, с которым связана группа ОН, спирты делят на: первичные, у которых ОН-группа связана с первичным атомом С (этанол СH3–CH2–OH, пропанол СH3–CH2–CH2–OH); б) вторичные, у которых ОН-группа связана с вторичным атомом С: вторичный пропанол, вторичный бутанол.
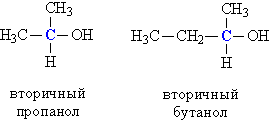
Третичные спирты: третичный бутанол и пентанол.
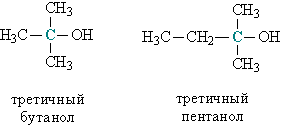
По строению органических групп, связанных ОН-группой, спирты подразделяют на предельные (метанол, этанол, пропанол), непредельные (аллиловый спирт СН2=СН–СН2–ОН), ароматические (бензиловый спирт С6Н5СН2ОН).
Физические свойства спиртов. Растворимы в большинстве органических растворителей, первые три представителя – метанол, этанол и пропанол, а также третичный бутанол – смешиваются с водой в любых соотношениях. При увеличении кол-ва атомов С начинает сказываться гидрофобный эффект, растворимость в воде становится ограниченной. Наличие водородной связи между молекулами спирта объясняет более высокую температуру их кипения. С1–С11 – при комнатной t – жидкости, с С12 тв. вещ-ва. С1–С3 – характерный алкогольный запах.
Метанол – сильнейший яд, употребление нескольких грамм приводит к слепоте и к смерти. Этанол применяют в отраслях промышленности: лакокрасочной, фармацевтической, бытовой химии; является наркотиком для организма чел.(небольш. дозы снижают остроту зрения и реакции; длительн. употребление – заболевания нервн. и СС систем, разрушение печени).
Реакции, протекающие по связи О–Н (образуются алкоголяты или алкоксиды)
2CH3OH + 2Na → 2CH3OK + H; C2H5OК + H2O→C2H5OH + КOH.
HO–CH2–CH2–OH + 2NaOH →NaO–CH2–CH2–ONa + 2H2O
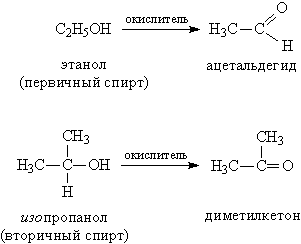
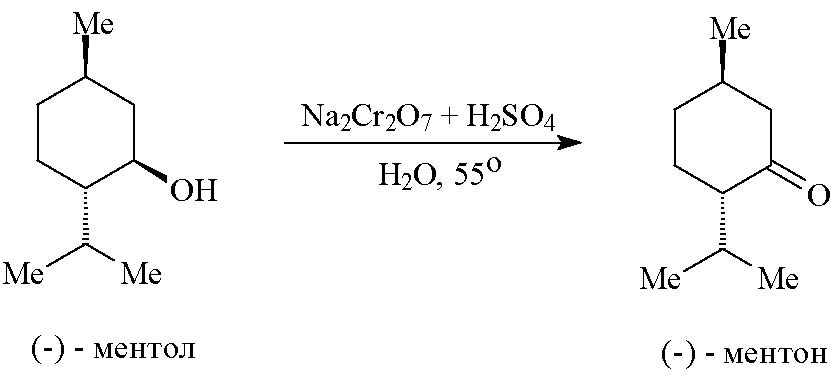
При действии окислителей (К2Cr2O7, KMnO4) первичные спирты образуют альдегиды, а вторичные – кетоны
Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С, что молекула исходного спирта. Н3С–СН2–СН2–СН2–ОН→(LiAlH4/ -Н2О) Н3С–СН2–СН2–СН3
2. Реакции, протекающие по связи С–О.
Разрыв связи С–О в спиртах происходит также при замещении ОН-группы галогеном, или аминогруппой.
Реакция этерификации (образование простых эфиров):
С2Н5ОН+С2Н5ОН→СН3СН2–О–СН2СН3+Н2О (диэтиловый эфир)
Глицерин +Na(+НNО3; + Сu(ОН)2)
СН2ОН–СНОН–СН2ОН+3НNО3→СН2ОNО2–СНОNО2–СН2ОNО2+3Н2О
68. Кислотность спиртов, образование и свойства алкоголятов. Окисление спиртов. Биохимические особенности окислительно-восстановительной системы NAD+-NADH.
Это слабые ОН-кислоты. R-OH↔RO- + H+.
Т. к. кислотность спиртов определяется концентрацией Н+, а их количество равно количеству алкоксид-анионов (RO-) рКа (константа кислотности (рН)) коррелирует (соотносится) со стабильностью алк-аниона (чем стабильнее RO-, тем больше равновесие смещено вправо), чем менее активны RO-, тем слабее кислота.
Алк-анионы будут стабильны: а) арильные кольца; б) электроноакцепторные заместители.
При окислении спиртов, в зависимости от используемого метода окисления, можно получать альдегиды, кетоны, карбоновые кислоты. Как правило, в окислении спиртов до кислот необходимости нет, так как кислоты чаще всего оказываются доступнее спиртов. Алкоголята одноатомных спиртов. Их общая ф-ла M(OR)n, где n-степень окисления металла. А. щелочных, щел.-зем. металлов, Т1(1) и первичных спиртов-ионные соед.; неплавки, нелетучи; т. разл. 200-300 °С; раств. в спиртах и жидком NH3; электролиты в р-ре. Из спиртовых р-ров обычно выделяются в виде кристаллосольватов. Производные металлов III-VIII групп и спиртов (начиная с С2Н5ОН), а также M1OR-mpem- молекулярные мономерные или олигомерные соед.; имеют низкие т-ры плавления и кипения; хорошо раств. в неполярных р-рителях, плохо-в спиртах; р-ры не проводят ток. Метилаты тех же элементов-обычно координац. полимеры; неплавки, нелетучи; не раств. ни в одном из р-рителей. Большинство А. элементов середины периодич. системы сочетают св-ва ионных и молекулярных соед. (см. табл.). Все А. очень гигроскопичны.

Биохимические аспекты алкоголизма: под действием спирта NAD восстанавливается до NADH+.
СН3СН2ОН + NAD+ ↔ СН3СНО + NAD·Н + Н+
NAD+ и NADР+ -- дегидрогиназы.
