
- •II. Реакции окисления
- •III. Термические превращения алканов
- •53. Алкены. Изомерия и номенклатура. Электронное строение. Р-ции в боковой цепи. Использование в лабораторной практике и промышленности.
- •Галогенирование Механизм электрофильного присоединения.
- •Гидрогалогенирование
- •Присоединение протонных кислот и воды
- •Реакция полимеризации
- •7. Реакции замещения (реакции радикального замещения аллильного атома водорода). Реакция алкенов в боковой цепи.
- •54. Алкены. Р-ции присоединения по двойной связи (гидрогенирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление) мех-мы и основные закономерности.
- •55. Алкины. Изомерия и номенклатура. Применение алкинов. Образование ацетиленид-анионов и их использование в орг синтезе.
- •56. Реакции присоединения по кратной связи алкинов (гидрогенирования, галогенирования, гидрогалогенирования, гидратации, полимеризации, окисления): механизмы и основные закономерности.
- •57. Алкадиены. Классификация, номенклатура, изомерия, электронное строение. Химические свойства, понятие о термодинамическом и кинетическом контроле реакций присоединения к сопряженным диенам.
- •II. Пространственная
- •58. Арены. Номенклатура, изомерия. Ароматичность, правило Хюккеля. Полициклические ароматические системы.
- •58А. Реакции боковой цепи аренов, представление о механизме, закономерности галогенирования и окисления.
- •60. Реакции бензола и его конденсированных аналогов с нарушением ароматичности (гидрогенирование, окисление, галогенирование).
- •61. Примеры синтетич. Использования р-ций аренов(нитрования, галогенирования, сульфирования, ацилирования, алькилирования по Фриделю Крафтцу). Синтез жирноароматических альдегидов и кетонов
- •62. Представление о реакциях нуклеофильного замещения и элиминирования как конкурентных процессах в ряду монофункционально замещенных углеводородов (галогеналканы, спирты, амины).
- •63. Представление о механизмах мономолекулярного и бимолекулярного нуклеофильного замещения. Факторах, влияющих на направление процесса.
- •65. Взаимодействие галогеналканов с металлами. Представление о строении и использовании в синтезе металлорганических соединений.
- •66. Номенклатура, строение, применение галогеналканов, хим. Св-ва. Р-ции нуклеофильного замещения (с о-, Hal-, n-, с- нуклеофилами). Элиминирование.
- •67. Одноатомные и многоатомные спирты. Номенклатура, изомерия. Физические и медико-биологические свойства. Химические св-ва: реакции нуклеофильного замещения, элиминирования и ацилирования.
- •69. Фенолы. Номенклатура, строение, изомерия. Химические свойства: кислотность (влияние заместителей), р-ции по он-группе (в сравнении с алканами) и ароматическому кольцу (в сравнении с аренами).
- •71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
- •72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
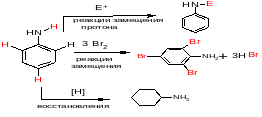
71. Особенность поведения ароматических аминов. Основность и нуклеофильность аминов. Использование аминов в органическом синтезе.
Для анилина характерны реакции
протекающие по бензольному кольцу – при этом реакции протекают в более мягких условиях по сравнению с бензолом (влияние NH2-группы!!!),
NH2-группы, аналогичны реакциям насыщенных аминов.
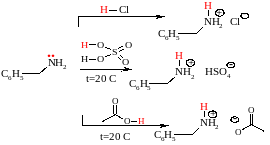
Основность аминов связана с их способностью быть донором электронной пары.
Основность↑ – введение электронно-донорных заместителей ↑ – нуклеофильность↑
72. 73. Альдегиды и кетоны. Изомерия и номенклатура. Физические и медико-биологические свойства. Взаимодействие альдегидов и кетонов с водородом и нуклеофильными реагентами.
Карбонильные соединения содержат в молекуле карбонильную группу. Карбонильные соединения делятся на альдегиды и кетоны. Строение карбонильной группы C=O. Альдегиды содержат в молекуле карбонильную группу, обязательно связанную с атомом Н, т.е. альдегидную группу: ─C─HО
Кетоны содержат в молекуле карбонильную группу, связанную с 2 углеводородными радикалами, т.е. кетонную группу: R─CО─R
Св-ва альдегидов и кетонов определяются строением карбонильной группы >C=O.
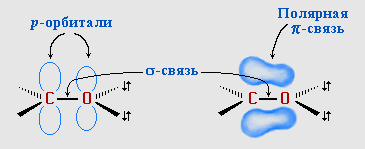
Атомы С и О в карбонильной группе нах-ся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 s-связи (одна из них - связь С–О), кот расп-ся в одной плоскости под углом около 120° др к др. 1 из 3 sp2-орбиталей О участвует в s-связи С–О, две др содержат неподеленнные электронные пары. π-связь образована р-электронами атомов углерода и кислорода.
С
 вязь
С=О сильно полярна. Ее дипольный момент
(2,6-2,8D) значительно выше, чем у связи С–О
в спиртах (0,70D). Электроны кратной связи
С=О, в особенности более подвижные
p-электроны, смещены к электроотрицательному
атому О, что приводит к появлению на нем
частичного отрицательного заряда.
Карбонильный С приобретает частичный
положительный заряд. Поэтому С подвергается
атаке нуклеофильными реагентами, а О -
электрофильными, в том числе Н+.
вязь
С=О сильно полярна. Ее дипольный момент
(2,6-2,8D) значительно выше, чем у связи С–О
в спиртах (0,70D). Электроны кратной связи
С=О, в особенности более подвижные
p-электроны, смещены к электроотрицательному
атому О, что приводит к появлению на нем
частичного отрицательного заряда.
Карбонильный С приобретает частичный
положительный заряд. Поэтому С подвергается
атаке нуклеофильными реагентами, а О -
электрофильными, в том числе Н+.
В
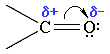 мол-лах альдегидов и кетонов отсутствуют
атомы Н, способные к образованию Н-связей.
Поэтому их температуры кипения ниже,
чем у соотв-щих спиртов. Метаналь
(формальдегид) - газ, альдегиды С2–C5 и
кетоны С3–С4 - жидкости, высшие - твердые
в-ва. Низшие гомологи растворимы в воде,
благодаря образованию Н-связей между
атомами Н молекул воды и карбонильными
атомами О. С увеличением углеводородного
радикала растворимость в воде падает.
Формальдегид имеет резкий неприятный
запах. Средние гомологи ряда альдегидов
обладают устойчивым хар-ным запахом.
Высшие альдегиды обладают цветочными
запахами и широко применяются в парфюмерии
(фенилуксусный альдегид C6H5CH2CHO
называют гиацинтом, т. к. имеет запах
гиацинтов).
мол-лах альдегидов и кетонов отсутствуют
атомы Н, способные к образованию Н-связей.
Поэтому их температуры кипения ниже,
чем у соотв-щих спиртов. Метаналь
(формальдегид) - газ, альдегиды С2–C5 и
кетоны С3–С4 - жидкости, высшие - твердые
в-ва. Низшие гомологи растворимы в воде,
благодаря образованию Н-связей между
атомами Н молекул воды и карбонильными
атомами О. С увеличением углеводородного
радикала растворимость в воде падает.
Формальдегид имеет резкий неприятный
запах. Средние гомологи ряда альдегидов
обладают устойчивым хар-ным запахом.
Высшие альдегиды обладают цветочными
запахами и широко применяются в парфюмерии
(фенилуксусный альдегид C6H5CH2CHO
называют гиацинтом, т. к. имеет запах
гиацинтов).
Наибольшее применение имеют метаналь и этаналь. Большое кол-во метаналя используется для получения фенолформальдегидной смолы, кот получают при взаимодействии метаналя с фенолом. Эта смола необходима для производства различных пластмасс. Пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями, называются фенопластами. При растворении фенолформальдегидной смолы в ацетоне или спирте получают различные лаки. Из метаналя получают карбамидную смолу, а из нее — аминопласты. Из этих пластмасс изготовляют микропористые материалы для нужд электротехники. Метаналь идет также на производство некоторых лекарственных веществ и красителей. Широко применяется водный раствор, содержащий в массовых долях 0,4, или 40%, метаналя. Он называется формалином. Его использование основано на свойстве свертывать белок. Так, например, в кожевенном производстве дубящее действие формалина объясняется свертыванием белка, в р-те чего кожа твердеет и не подвергается гниению. На этом же св-ве основано применение формалина для сохранения биол-ких препаратов. Иногда формалин исп-ся для дезинфекции и протравливания семян. Этаналь в основном идет на производство уксусной кислоты. Ацетон (пропанон, диметилкетон) п. с. бесцветную жидкость с хар-ным запахом. Температура кипения ацетона 56,2 С. Хорошо растворим в воде, и сам явл-ся растворителем орг соединений. Ацетон - важный продукт хим промышленности. Его получают совместно с фенолом кумольным методом. Ацетон применяется как растворитель. Явл-ся исходным в-вом для синтеза многих орг соединений.
Номенклатура и изомерия. По номенклатуре ИЮПАК назв. альдегидов производят прибавлением к названию соотв-щего углеводорода суффикса "аль" или к назв. углеводорода, содержащего на один атом С меньше, суффикса "карбальдегид"; в первом случае углерод альдегидной группы нумеруется цифрой 1, во втором - альдегидная группа в нумерацию цепи не включается. В полифункциональных соединениях альдегидная группа обозначается приставкой "формил".

По номенклатуре ИЮПАК, название кетонов образуют путем присоединения к названию соответствующих углеводородов суффикса "он" или к назв. радикалов, связанных с кетогруппой С=О, слова "кетон"; при наличии старшей группы кетогруппу обозначают префиксом "оксо". Напр., соединение СН3СН2СОСН2СН2СН3 наз. 3-гексанон или этилпропилкетон, соединение СН3СОСН2СН2СООН - 4-оксопентановая кислота.
С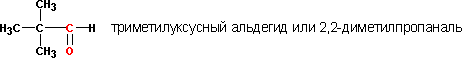 труктурная
изомерия альдегидов обусловлена только
изомерией углеводородного радикала.
Для кетонов возможна как изомерия
углеродной цепи, так и изомерия положения
карбоксильной группы.
труктурная
изомерия альдегидов обусловлена только
изомерией углеводородного радикала.
Для кетонов возможна как изомерия
углеродной цепи, так и изомерия положения
карбоксильной группы.
Изомерия альдегидов и кетонов изомерия углеродного скелета, начиная с С4
→м
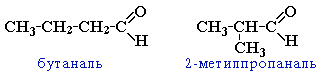 ежклассовая
изомерия с кетонами, начиная с С3
ежклассовая
изомерия с кетонами, начиная с С3
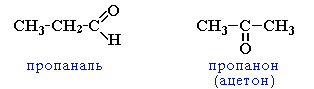
циклическими оксидами (с С2) →
непредельными спиртами и простыми эфирами (с С3)
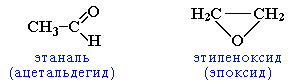
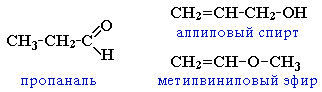
И
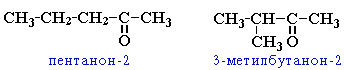 зомерия
кетонов: углеродного скелета (c C5)
→
зомерия
кетонов: углеродного скелета (c C5)
→
положения
карбонильной группы (c C5)
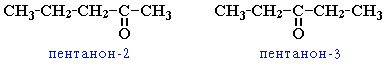
с О - нуклеофилами: 1. с H2O
О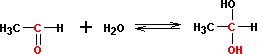 бразующиеся
гем-диолы неустойчивы и равновесие в
этой реакции сильно смещено влево. Искл
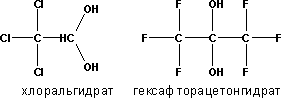
составляют альдегиды и кетоны с
электроноакцепторными гр (хлораль или
гексафторацетон, кот в водной среде
существуют в виде гем-диолов):
бразующиеся
гем-диолы неустойчивы и равновесие в
этой реакции сильно смещено влево. Искл
составляют альдегиды и кетоны с
электроноакцепторными гр (хлораль или
гексафторацетон, кот в водной среде
существуют в виде гем-диолов):
со спиртами При присоединении первой молекулы спирта обр-ся полуацетали. Реакция катализируется к-ми или основаниями:
П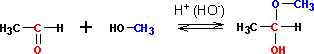 рисоединение
второй молекулы спирта приводит к
образованию ацеталей. Образование
ацеталей катализируется только в кислой
среде:
рисоединение
второй молекулы спирта приводит к
образованию ацеталей. Образование
ацеталей катализируется только в кислой
среде:
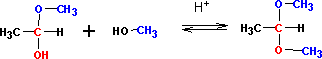 Ацетали
устойчивы в нейтральной и щелочной
среде, поэтому могут быть использованы
для временной защиты альдегидных групп.
Ацетали широко распространены в природе.
Ацетали
устойчивы в нейтральной и щелочной
среде, поэтому могут быть использованы
для временной защиты альдегидных групп.
Ацетали широко распространены в природе.
присоединение бисульфита Присоединение идет через более нуклеофильный атом S, а не O, хотя на нем и имеется отрицательный заряд. Обр-ся производные алкансульфокислот (соли алканоксисульфокислот).
О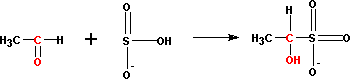 бр-щиеся
аддукты нераство-римы в насыщенном р-ре
бисульфита Na
или спиртах и выпадают в осадок в виде
кристаллов. Так отделяют карбонильные
соед-я из смеси со спиртами. Карбонильное
соед-е выделяется в свободном виде из
аддукта при обработке его к-той.
бр-щиеся
аддукты нераство-римы в насыщенном р-ре
бисульфита Na
или спиртах и выпадают в осадок в виде
кристаллов. Так отделяют карбонильные
соед-я из смеси со спиртами. Карбонильное
соед-е выделяется в свободном виде из
аддукта при обработке его к-той.
При р-ции с кетонами бисульфиты присоед-ся только к метилкетонам СН3-СО-R.
присоединение цианидов

Реакция катализируется цианистым калием или натрием. Обр-еся оксинитрилы (или циангидрины) могут быть гидролизованы до оксикарбоновых кислот:
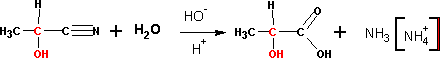
Взаимодействие с формальдегидом, альдегидами, кетонами - приводит к первичным, вторичным и третичным спиртам, соответственно.

Из кетонов получаются третичные спирты. Так, из метилэтилкетона (бутанон-2) получается 2-метилбутанол-Альдегиды в подобной реакции дают вторичные спирты. Из пропионового альдегида (пропаналь) получается бутанол-2:
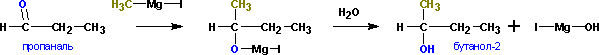
Из формальдегида образуются первичные спирты.
Присоединение аммиака и аминов Первичные амины присоединяются к альдегидам и кетонам с образованием иминов (оснований Шиффа):
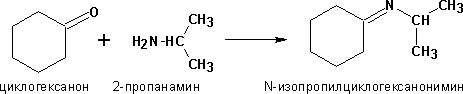
Аналогичная р-ция вторичных аминов с карбонильными соед-ми дает енамины:

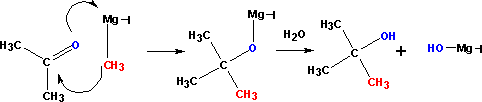
Взаимодействие с C - нуклеофилами
Взаимодействие металлорганических соединений типа R-Mg-X (реактивы Гриньяра), где Х= галоген, с карбонильными группами (нуклеофильное присоединение по кратной связи С=О):
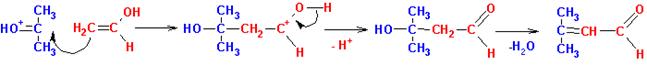
Альдольно-кротоновая конденсация
Конденсация может происходить как в кислой среде, так и в щелочной. Катализируемая кислотой конденсация. В конденсацию вступают енол и протонированная карбонильная группа второй молекулы соединения:
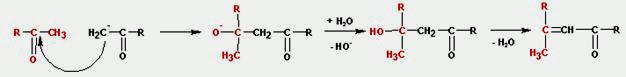
Конденсация, катализируемая основанием. Образование енолят-иона, генерирующего карбанион, протекает по схеме:

Далее карбанион присоед-ся к карбонильной группе 2ой мол-лы, причем протекает С-алкилирование, в отличие от термодинамически невыгодного О - алкилирования:
Образующийся альдегидоспирт (альдоль) легко теряет воду в присутствии каталитических количеств оснований или кислот, а также при незначительном нагревании, с образованием a,b- ненасыщенного карбонильного соединения, этим завершается реакция конденсации (R,Х= алкил или Н):
В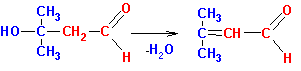 реакцию альдольно - кротоновой конденсации
(в том числе и самоконденсации) могут
вступать как альдегиды, так и кетоны,
им-е альфа-углеродные атомы Н. В случае
кетонов положение равновесия невыгодно
для образования продуктов, но проводя
р-цию в особых условиях (исключая контакт
продукта с катализатором основного
хар-ра) можно добиваться существенных
выходов. Перекрестные р-ции между
альдегидами и кетонами не имеют
лабораторного применения, поскольку
обр-ся трудноразделяемая смесь из 4
продуктов и непрореагировавших исходных
соед-й. Чаще в синтетических целях
проводят р-цию между 2 карбонильными
соед-ми, 1 из кот явл-ся источником
карбанионов (метиленовая компонента),
а др служит карбонильной компонентой
(не им-й альфа-углеродных атомов Н).
Обычно в роли карбонильной компоненты
исп-ся формальдегид, ароматические
альдегиды, эфиры угольной, щавелевой и
муравьиной к-т. В кач-ве метиленовой
компоненты применяют в том числе и С-Н
кислоты и даже производные ацетиленовых
углеводородов с концевой тройной связью.
реакцию альдольно - кротоновой конденсации
(в том числе и самоконденсации) могут
вступать как альдегиды, так и кетоны,
им-е альфа-углеродные атомы Н. В случае
кетонов положение равновесия невыгодно
для образования продуктов, но проводя
р-цию в особых условиях (исключая контакт
продукта с катализатором основного
хар-ра) можно добиваться существенных
выходов. Перекрестные р-ции между
альдегидами и кетонами не имеют
лабораторного применения, поскольку
обр-ся трудноразделяемая смесь из 4
продуктов и непрореагировавших исходных
соед-й. Чаще в синтетических целях
проводят р-цию между 2 карбонильными
соед-ми, 1 из кот явл-ся источником
карбанионов (метиленовая компонента),
а др служит карбонильной компонентой
(не им-й альфа-углеродных атомов Н).
Обычно в роли карбонильной компоненты
исп-ся формальдегид, ароматические
альдегиды, эфиры угольной, щавелевой и
муравьиной к-т. В кач-ве метиленовой
компоненты применяют в том числе и С-Н
кислоты и даже производные ацетиленовых
углеводородов с концевой тройной связью.
Реакция Канниццаро Альдегиды, не имеющие альфа-углеродных атомов Н при нагревании с сильными основаниями вступают в р-цию окисления-восстановления, когда 1 из молекул восстанавливается до спирта за счет окисления 2ой мол-лы до карбоновой кислоты → реакции Канниццаро, и протекают по схеме:
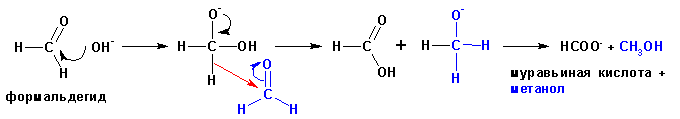
Известны и внутримолекулярные реакции окисления-восстановления:
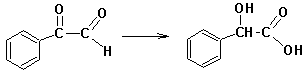
Своеобразной разновидностью внутримолекулярного окисления-восстановления является Бензиловая перегруппировка:

74. Образование и свойства (алкилирование, альдольная и альдольно-кротоновая конденсация) енолят-анионов карбонильных соединений. Реакции енольной формы (галогенирование, алкилирование, альдольная и альдольно-кротоновая конденсации, реакция Манниха).


