
- •32. Галогеноводородные кислоты, их соли: строение, получение и химические свойства. Соединения, галогенов в положительной степени окисления. Биологическая роль галогенов.
- •3. Состояние вещества. Критерии, определяющие состояние вещества:
- •9. Ионная связь, ее свойства. Ионные кристаллические решетки и свойства веществ с ионной кристаллической решеткой. Поляризуемость и поляризующее действие ионов, их влияние на свойства веществ.
- •8.Ковалентная связь, ее свойства и основные характеристики.
- •7. Типы химической связи. Металлическая связь, общ. Физ. И химич. Свойства металлов.
- •12. Механизм процесса растворения. Тепловой эффект растворения. Растворимость твёрдых веществ в воде и других растворителях.
- •15. Состав и строение молекул воды. Полярность молекул. Водородная связь. Ассоциации молекул воды. Аномалии воды, их объяснение. Роль воды в биологических процессах.
- •16. Основные положения тэд. Причины и механизмы тэд с различным типом химической связи. Сольватация (гидратация) ионов.
- •17. Степень электролитической диссоциации. Сильные и слабые электролиты. Истинная и кажущаяся степень диссоциации. Коэффициент активности. Константа диссоциации.
- •19. Константы кислотности и основности. Электролитическая диссоциация воды. Ионное произведение воды, pH среды. Индикаторы. Буферные растворы. Гидролиз солей. Константа гидролиза.
- •20. Строение комплексных соединений, их классификация и номенклатура.
- •21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
- •22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
- •23. Электродный потенциал. Понятие о гальваническом элементе. Уравнение Нернста. Роль среды в протекании окислительно-восстановительных процессах.
- •25. Сера, ее аллотропные модификации. Бинарные соединения серы, их получение и строение молекул. Серная кислота, строение молекул, получение.
- •26. Свойства разбавленной и концентрированной серной кислоты (реакции с металлами и неметаллами). Представление о строении и химических свойствах других серосодержащих кислот.
- •28. Азотная и азотистая кислота, их соли: строение и получение. Химические свойства разбавленной и концентрированной азотной кислоты (реакции с металлами и неметаллами), нитратов и нитритов.
- •27. Азот, его бинарные соединения, их получение и строение молекул. Получение и свойства аммиака. Представления об азотных удобрениях.
- •31.Галогены, их бинарные соединения: получение и строение молекул. Особые свойства фтора и его соединений.
- •33. Металлы групп ia и iia: простые вещества, их реакционная способность. Строение, свойства и биологическая роль соединений щелочных и щелочноземельных металлов.
- •34. Металлы групп iiia и iva: простые вещества, их реакционная способность. Строение, свойства их бинарных соединений и гидроксидов.
- •1.Основные хим.Понятия: относительная молекулярная и атомная массы, моль, молярная масса, молярный объем, число Авогадро.
- •29.Фосфор его аллотропные модификации. Бинарные соединения фосфора, их получение и строение молекул.
21. Электролитическая диссоциация комплексных соединений. Константа нестойкости. Образование и разрушение комплексных ионов в растворах. Кислотно-основные свойства комплексных соединений.
Компл. соед. – молекулярные соединения, образующие комплексные ионы, способные к существованию как в р-ре, так и в кристалле.
[Cr(NH3)6]Cl3 - Имеют внешнюю и внутреннюю [ ] сферы. Cr – комплексообразователь, расположенные около него атомы – лиганды. При диссоциации сначала отщепляются атомы внешней сферы (первичная), затем диссоциирует внутренняя (вторичная).
K4[Fe(CN)6] = 4K+ + [Fe(CN6)]4- первичная
К1 нестойкости = [Fe(CN6)]-*[4K+] /[ K4[Fe(CN)6]]
Fe(CN)6 4-= Fe2+ + 6CN - вторичная
К2 нестойкости = [Fe 2+] * [CN-]6 / [Fe(CN6)]
Кнест = К1*К2 = [Fe2+]* [CN-]6 / [Fe(CN)64-]
Чем больше константа нестойкости, тем более устойчиво комплексное соединение.
Кислотно-основные свойства: Al(OH)3 + 3NaOH = Na3[AL(OH)6]
Na[ Al(OH)6]+ 6HCl = AlCl3 + 3NaCl + 6H2O
Амфотерность: (основание) Zn2+ + OH- = OH- + ZnOH+ ← Zn(OH)2 → H+ + HZnO22- (кислота)
22. Классификация окислительно-восстановительных реакций. Правила составления уравнений окислительно-восстановительных реакций. Методы расстановки коэффициентов.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР)
ОВР – реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ |
|
Восстановление – процесс принятия электронов |
Окисление – процесс отдачи электронов |
Окислитель принимает электроны, при этом восстанавливается. Степень окисления элемента понижается. |
Восстановитель отдает электроны, при этом окисляется. Степень окисления элемента повышается. |
Э + n
|
Э – n → Э +n |
Важнейшие окислители |
Вещества, проявляющие ОВ двойственность (могут выступать в качестве О и В) |
Важнейшие восстановители |
Азотная кислота (разбавленная и концентрированная) HNO3, серная концентрированная кислота H2SO4, перманганат калия KMnO4, манганат калия K2MnO4, оксид марганца (IV) MnO2, хромат калия K2CrO4, бихромат калия K2Cr2O7, оксид свинца(IV) PbO2, фтор F2, хлор Cl2, кислород O2, озон O3, катионы некоторых металлов Ag+, Au3+.
|
Азотистая кислота HNO2, сера S, оксид серы (IV) SO2, сернистая кислота H2SO3, катионы железа Fe2+ |
Металлы, водород H2, углерод C, оксид углерода (II) CO, сероводород H2S, галогеноводородные кислоты HCl, HBr, HI (кроме фтороводородной), аммиак NH3, гидразин N2H4, некоторые катионы металлов Mn2+, Cr3+
|
Классификация окислительно-восстановительных реакций
Межмолекулярные: атомы окислителя и восстановителя являются атомами различных химических элементов и входят в состав разных веществ |
Mn+4O2 + 4HCl– → Mn+2Cl2 + Cl02 + 2H2O Mn+4 + 2ē → Mn+2 окислитель 2Cl– – 2ē → Cl02 восстановитель |
Внутримолекулярные: атомы окислителя и восстановителя являются атомами различных химических элементов и входят в состав одного вещества |
2KN+5O-23
N+5 + 2 ē → N+3 окислитель 2O-2 – 4ē → O02 восстановитель |
Диспропорционирование: атомы окислителя и восстановителя являются атомами одного химического элемента, входят в состав одного вещества и имеют одинаковую степень окисления |
3Cl02 + 6KOH 5KCl + KCl+5O3 + 3H2O Cl02 + 2ē → 2Cl– окислитель Cl02 – 10ē → 2Cl+5 восстановитель |
Компропорционирование: атомы окислителя и восстановителя являются атомами одного химического элемента с различной степенью окисления и могут входить как в состав одного вещества, так и в состав различных веществ |
2H2S -2 + S+4O2 → 3S0 + 2H2O S+4 + 4ē → S0 окислитель S-2 – 2ē → S0 восстановитель N-3H4N+5O3 N+2O + 2H2O N+5 + 4ē → N+ окислитель N-3 – 4ē → N+ восстановитель |
Составление уравнений ОВР
Метод электронного баланса
Ионно-электронный метод (для водных растворов)

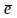 → Э –n
→ Э –n
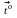 2KN+3O2
+ O02
2KN+3O2
+ O02