
- •Динамическая биохимия
- •Обмен веществ в организме человека
- •1. Обмен веществ — необходимое условие существования живого организма
- •2. Анаболические и катаболические реакции – две стороны обмена веществ
- •3. Виды обмена веществ
- •Биологическое окисление Биологическое окисление — центральный процесс диссимиляции
- •Транспорт электронов и водорода в процессах биологического окисления
- •Энергетический эффект биологического окисления
- •Макроэргические соединения
- •Обмен углеводов в организме человека
- •Расшепление углеводов в процессе пищеварения и их всасывание в кровь
- •Внутриклеточный обмен углеводов
- •Гликолиз
- •Аэробное окисление углеволов
- •Энергетическая эффективность аэробного окисления молекулы глюкозы
- •Цикл трикарбоновых кислот биохимические превращения липидов в организме человека Переваривание и всасывание липидов
- •Окисление липидов в тканевом липолизе
- •Превращение глицерина
- •Превращение жирных кислот.
- •Превращения белков в организме
- •Пищеварение белков
- •Внутриклеточные превращения аминокислот
Аэробное окисление углеволов
Аэробное окисление глюкозы — это многостадийный процесс распада ее молекулы до конечных продуктов обмена СО2 и Н2О с образованием 38 молекул АТФ и выделением тепловой энергии. Протекает оно при участии кислорода, который доставляется в ткани с участием белка гемоглобина. Этот процесс окисления углеводов— один из главных механизмов образования АТФ в тканях организма. Он включает такие основные стадии:
гликолитический распад молекулы глюкозы до двух молекул пировинограднои кислоты (ПВК);
превращение ПВК в ацетилКоА;
окисление ацетилКоА в цикле лимонной кислоты и на дыхательной цепи.
Процесс распада молекулы глюкозы до пировиноградной кислоты протекает одинаково в анаэробных и аэробных условиях, как описано выше (см. "Гликолиз"). Образовавшаяся в гликолитической стадии пировиноградная кислота подвергается далее окислительному декарбоксилированию, в результате чего образуются макроэргическое вещество ацетилКоА, восстановленная форма НАДН2 и одна молекула СО2. Если в процессе гликолиза образовалась молочная кислота, то в аэробных условиях она превращается в пировиноградную кислоту.
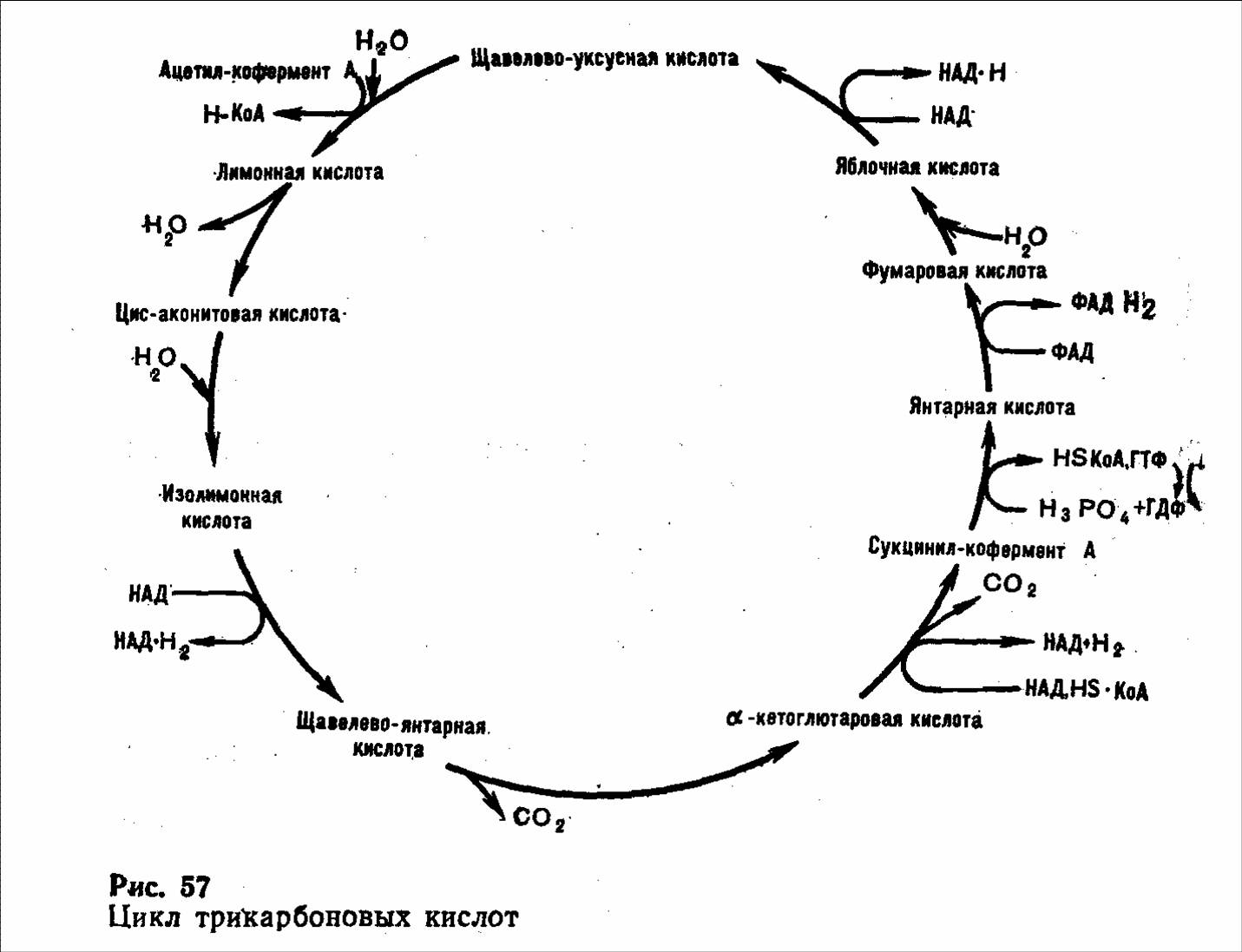
АцетилКоА далее включается в цикл лимонной кислоты, где расщепляется до СО2 и Н2О. Вода образуется на системе дыхательных ферментов при взаимодействии водорода, образовавшегося в реакциях биологического окисления, с атомарным кислородом вдыхаемого воздуха.
Химические реакции окисления молекулы ацетилКоА в цикле лимонной кислоты рассмотрены (см. рис.).
Энергетическая эффективность аэробного окисления молекулы глюкозы
При полном окислении одной молекулы глюкозы до СО2 и Н2О энергия накапливается в виде 10 НАДН2 (2 из них образуются в гликолизе, 2 – при превращении ПВК в ацетилКоА и 6 – в цикле лимонной кислоты), а также 2 ФАДН2. Передача водорода по системе дыхательных передатчиков от НАДН2 на кислород сопряжена с образованием трех молекул АТФ, а от ФАДН2 — двух молекул АТФ. Следовательно, из 10 НАДН2 образуется 30 АТФ, а из 2 ФАДН — 4 АТФ. Суммарный выход АТФ на одну молекулу глюкозы составляет 38 АТФ. Однако в мышечной и нервной тканях 2 молекулы НАДН2, которые образуются в цитоплазме в процессе гликолиза, сами в митохондрии не поступают, а передают водород на переносчик ФАД, поэтому в дыхательную цепь водород уже передается от 2 ФАДН2, что сопровождается образованием не 6 АТФ, а только 4 АТФ. Поэтому в скелетных мышцах при полном окислении молекулы глюкозы образуется 36 АТФ.
Аэробный метаболизм, глюкозы по накоплению АТФ в 18 раз, более эффективен, чем анаэробный. Он имеет большой коэффициент полезного действия (около 45 %), так как из 2880 кДж свободной энергии окисления глюкозы 1311 кДж аккумулируется в АТФ. Аэробное окисление углеводов — основной механизм энергообеспечения аэробной мышечной работы в течение нескольких часов.
Цикл трикарбоновых кислот биохимические превращения липидов в организме человека Переваривание и всасывание липидов
Нейтральные жиры, поступающие в организм с пищей, подвергаются гидролитическому расщеплению на глицерин и жирные кислоты, катализируемому ферментами липазами.
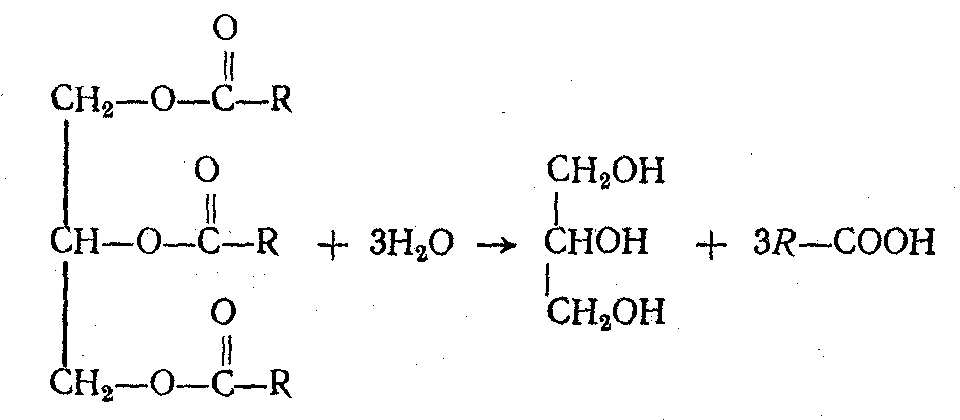
Подобно нейтральным жирам в кишечнике, расщепляются и фосфатиды. Гидролиз их, катализируемый фосфолипазами, приводит к образованию глицерина, жирных кислот, фосфорной кислоты и азотистого основания. Стериды, подвергаясь действию ферментов холестераз, гидролитически расщепляются на холестерин и соответствующую жирную кислоту.
Решающее значение для переваривания и использования пищевых липидов имеет их эмульгирование, обеспечивающее большую доступность нерастворимых в воде липидов воздействию расщепляющих их липолитических ферментов, находящихся в водной фазе. Условий для эмульгирования в желудке нет. Поэтому липаза желудочного сока расщепляет лишь уже эмульгированные жиры пищи (например, жир молока). Основное переваривание жиров липазами сока поджелудочной железы и кишечника происходит в тонких кишках, чему способствуют соли желчных кислот, поступающие в кишечник с желчью и обладающие мощным эмульгирующим действием.
Желчные кислоты по строению близки к холестерину. Это производные холановой кислоты (продукта окисления холестерина).
Желчные кислоты располагаются на поверхности раздела между жиром и водой, причем в жировой фазе располагается гидрофобная (циклическая) часть молекулы, а в водной фазе — гидрофильный остаток. Это препятствует слиянию мелких капель в крупные. Кроме того, желчные кислоты вызывают уменьшение поверхностного натяжения на границе раздела фаз, способствуя неустойчивости крупных жировых капель и образованию из них более мелких, что увеличивает поверхность соприкосновения жировой и водной фаз.
Увеличение поверхности жировых капель повышает эффективность действия липолитических ферментов. Благоприятные условия для их действия создаются и в ходе расщепления жиров, так как образующиеся при этом соли жирных кислот (мыла) также обладают эмульгирующими свойствами.
Глицерин, образующийся при гидролизе липидов, хорошо растворяется в воде и легко всасывается слизистой оболочкой кишечника. Высшие жирные кислоты — стеариновая, пальмитиновая, олеиновая и др. в воде нерастворимы и могут всасываться лишь в виде водорастворимых комплексов с желчными кислотами так называемых холеиновых кислот.
Холеиновые кислоты, всасываясь, распадаются в эпителии кишечных ворсинок на свободные жирные и желчные кислоты. Часть освободившихся желчных кислот поступает обратно в просвет кишечника, способствуя дальнейшему всасыванию высших жирных кислот, другая их часть доставляется с кровью в печень, откуда переходит в состав желчи.
Из всосавшихся жирных кислот и глицерина в кишечном эпителии происходит частичный ресинтез специфических триглицеридов; здесь же часть свободных жирных кислот включается в фосфатиды, преимущественно в лецитин, осуществляющий функцию транспорта жирных кислот. Большая часть жиров, ресинтезированных в эпителии кишечника или всосавшихся из полости кишечника без предварительного гидролиза благодаря высокой степени диспергирования, поступает в кровь через лимфатическую систему. Меньшая часть жиров (около 20—30%) поступает непосредственно в кровеносные капилляры и через систему воротной вены попадает в большой круг кровообращения. Основная масса жиров после всасывания откладывается в жировых депо организма: подкожной и забюшинной жировой клетчатке, сальнике.
По мере надобности (например, при усиленном расходе энергии во время длительной мышечной деятельности, в условиях голодания и т. п.) происходит мобилизация запасных жиров из депо при участии липаз жировой ткани. Жиры и продукты липолиза — глицерин и жирные кислоты — поступают в кровь и ею разносятся к местам их использования.
В плазме крови имеется сложная смесь липидов, в состав которой входят нейтральные жиры (триглицериды), фосфатиды, холестерин, его эфиры и свободные жирные кислоты. Транспорт нерастворимых в воде липидов осуществляется при участии белков плазмы и фосфатидов. Гидрофобные липиды с помощью фосфатидов (при посредстве их гидрофильных групп — фосфорной кислоты и азотистого основания) связаны с гидрофильным белком, обволакивающим (окутывающим) липиды. Образуются комплексные транспортные формы липидов — хиломикроны и липопротеиды плазмы крови. Диаметр первых — около 0,5 ммк. Вторые обладают меньшими размерами; их находят во фракциях глобулинов плазмы.
Свободные жирные кислоты транспортируются кровью в виде растворимых в воде комплексов с альбуминами плазмы.
