
Реферат
на тему:
«Комплекси органічних молекул як інтермедіати та їх дослідження»
Виконав
студент 4-го курсу
групи органічна хімія
Крикун Сергій
2012
Зміст
1. Вступ 3
2. Ароматичне електрофільне заміщення 3
3. Ароматичне нуклеофільне заміщення - Комплекси Мейзенгеймера 8
4. Аліфатичні π-комплекси 11
5. Металорганічні інтермедіати 12
6. Література 14
Вступ
Інтермедіат (лат. intermedius — середній) — проміжна речовина з коротким періодом існування, що утворюється у одному з етапів хімічної реакції, а далі вступає в реакції у наступних періодах, що призводять до утворення продуктів реакції. Зазвичай інтермедіатами є атоми чи молекули з назавершеними електроними оболонками, наприклад вільні радикали, карбокатіони, карбоаніони. Оскільки інтремедіати дуже швидко реагують, їх концентрація в реакційній суміші дуже незначна. Тому їх утворення або теоретично постулюються, або детектують за допомогою сучасних фізико-хімічних методів аналіза. Іноді інтермедіат плутають з перехідним станом, що неправильно, оскільки інтермедіат може бути, в принципі, виділений та охарактеризований, тоді як існування перехідного стану може бути зафіксоване лише у виключних випадках.
Зазвичай приводять таку класифікацію інтермедіатів:
Карбокатіони
Карбоаніони
Вільні радикали
Йон-радикали
Комплекси з переносом заряду (КПЗ)
Карбени
В даній роботі ми розглянемо комплекси органічних молекул як інтермедіати. Тут можна виділити два основних підтипи – σ та π комплекси, також можна проводити розділення за механізмами реакцій. Певною мірою окремо можна виділити метал-органічні комплекси.
Ароматичне електрофільне заміщення
При ароматичному нуклеофільному заміщенні спочатку відбувається утворення π-комплексу із подальшим перегрупування в σ-комплекс, який вже в свою чергу переходить в кінцевий продукт.

Найбільш ранні статті по генерації реакційноздатних інтермедіатів датуються 1950-1960-ми роками. Так, Дорінг синтезував гексаметилбензенієвий йон як стабільну модель інтермедіату Уіланда наступною реакцією:

Перші ж довгоживучі σ-комплекси були отримані в роботах Ола в 1972 із розвитком низькотемпературного ЯМР при -70 0С. Також методом темепературо-залежного ЯМР була показана міграція електронної густини нітрогрупи на ароматичне кільце із енергією активації 17 ккал/моль. Для порівняння, спектр хлоргексаметилбензенієвого йону не змінюється із температурою (від -70 0С до -20 0С), що вказує на дуже високий бар’єр активації для міграції Cl+. Всі ці результати базувались на 1H ЯМР та були підтвердженні методом 13С ЯМР у 1973 в роботах Коптіга.
Також, в 1994 було вперше проведено рентгеноструктурний аналіз при -78 0C.

Надалі, було досліджено генерування таких σ-комплексів Уіланда для гексаметилбензолу (HMB) та різноманітних електрофілів. Нижче наведено порівняльні спектри 1Н та 13С ЯМР, спектри знімались в дейтерованому дихлорметані при -80 0С

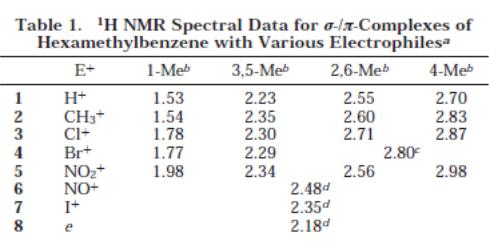
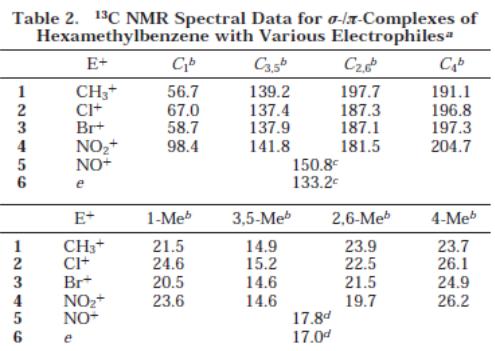
Інтегрування чотирьох протоних сигналів показує чітку картину 2:2:2:1 та 1:2:2:1 для електрофілів 2 та 1,3,5. Це розділення сигналів є характерним, поруч із синглетом 18Н, для утворення інтермедіату Уіланда. Таким чином, утворення катіону збільшує частковий позитивний заряд, що веде до характерного зміщення хімічних зсувів. В контрасті до цього, спектри електофілів 6 та 7 дають лише одиночні сигнали при 2,48 (18Н) та 2,35 (18Н) відповідно. Тобто, для них є характерний зсув у порівнянні із чистим гексаметилбензолом (2,13), проте заряд рівномірно розподіляється по всім атомам.
Спектр 13С підтверджує ці дані. Так, електрофіли CH3+, Cl+, Br+ та NO2+ дають розподілення сигналів 1:2:2:1. Хімічні зсуви також показують на розподілення розитивного заряду. Проте, доволі відмінним є спектр для нітрозо-електрофілу. Для нього мають місце лише два сигнали – 150,8 (6С) та 17,8 (6С). Відповідно, ми маємо рівномірне розподілення заряду по молекулі для даного електрофілу.
Таким чином, можна зробити висновок, що відмінність у спектрах для нітрозо- та йод-електрофілів зумовлена формуванням не σ-, а π-комплексу.
При
дослідженні даних сполук методом
УФ-видимої спектроскопії було показано
існування для гексаметилбензолу
в HF
та
HCl
вузьких
піків на 395 та 397 нм відповідно. Катіону
гексаметилбензолу
відповідає пік при 410 нм.
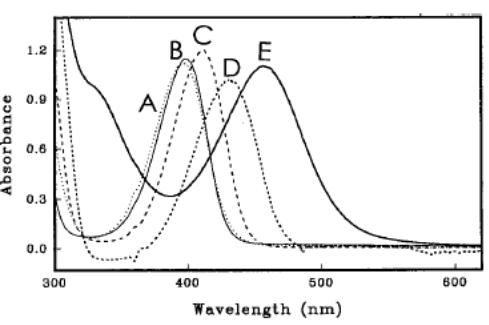
На спектрі ми бачимо чіткий перехід при зміні електрофілу від 395 нм для протонового гексаметилбензолу до 460 нм для йону бромогексаметилбензолу.

Для порівняння, π-комплекси гексаметилбензолу/нітрозо та гексаметилбензолу/йоду в дихлорметані дають два абсорційні піки – вузький на 337 та 390 нм та слабкий широкий на 500 та 466 нм. Існування двох абсорбційних піків пояснується переносом заряду через донорно-акцепторний π-комплекс. Також, пік в 400 нм було описано раніше для циклогексадієнільного катіону, де позитивний заряд делокалізований по кільцю. Електронні спектри для інших субстратів – ТМТ та ТЕТ – показують такі ж ефекти як і для HMB. Проте для них показана більш суттєва залежність від електрофілів ніж для HMB. Так, хлоро-, бромо-, та нітрокомплекси для ТМТ та ТЕТ показують помаранчевий або ж червоний максимум при 530 нм у порівнянні із жовтим для НМВ.

Незважаючи на швидку зйомку в електронній спектроскопії, спектри для інтермедіату Уіладнда пентаметилбензолу не вдалось записати. Проте, було показано перенос Cl+ між ТМТ та НМВ із майже кількісним виходом:


Повертаючись до нітрозо-НМВ, електронний спектр чітко вказує на існування π-комплексу. Проте, його можна перевести в σ-комплекс дією опромінення. При кімнатній температурі такі σ-комплекси доволі нестабільні, проте при 77 К їх час існування вимірюється годинами. Таким чином, основним методом генерування є флеш-фотоліз у дихлорметані при -78 0С. В результаті, σ-комплекс має одну вузьку лінію при 430 нм. Також було показано, що перехід π-σ відбувається через швидкий (k~1011 с-1) радикал-радикальне здвоювання аренового катіону із NO.


Найбільш ефективним методом дослідження на даний момент являється рентгеноструктурний аналіз. Всі результати РСА непогано узгоджуються із попередніми даними ЯМР та елекронної спектроскопії. Так, розподіл 1:2:2:1 в ЯМР, наявність однієї вузбкої полоси в УФ та аналогічна структура хромофору в РСА добре узгоджуються між собою. З іншої сторони, також були зняті РСА для π-комплексів, які показують розташування нітрозокатіону в більш або менш центральній позиції над площиною кільця (β=0, vide supra), що вказує на π-(η6) комплекс. Також методом РСА було досліджено протонування пентаметилбензолу сильними кислотами і чітко показано неметильований атом карбону як місце протонування. Також було показано, що кут між двома гідрогенами α=β=500.


