
Контрольные вопросы.
Первое начало термодинамики. Представляет собой формулировку обобщённого
закона
сохранения энергии для термодинамических
процессов. В наиболее простой форме его
можно записать как ![]() ,
где
,
где ![]() есть
полный дифференциал внутренней энергии
системы, а
есть
полный дифференциал внутренней энергии
системы, а ![]() и
и ![]() есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
есть
элементарное количество теплоты,
переданное системе, и элементарная
работа, совершенная системой соответственно.
Нужно учитывать, что
и
нельзя
считать дифференциалами в обычном
смысле этого понятия, поскольку эти
величины существенно зависят от типа
процесса, в результате которого состояние
системы изменилось.
Коли́чество теплоты́ — энергия, которую получает или теряет тело при теплопередаче. Количество теплоты является одной из основныхтермодинамических величин.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние.
Внутренняя энергия термодинамическая функция состояния системы, ее энергия, определяемая внутренним состоянием. Внутренняя энергия складывается в основном из кинетической энергии движения частиц (атомов, молекул, ионов, электронов) и энергии взаимодействия между ними (внутри- и межмолекулярной).
Постоянное эквивалентное соотношение между теплотой и работой при их взаимных переходах установлено в классических опытах Джоуля. Типичный эксперимент Джоуля заключался в следующем: падающий с известной высоты груз вращает мешалку, погружённую в воду, находящуюся в калориметре (груз, мешалка и калориметр с водой составляет термодинамическую систему); при этом совершается работа силы тяжести А = mgh. Вращение лопастей мешалки в воде вызывает нагревание воды в калориметре; теплота, переданная воде, равна произведению теплоёмкости калориметра с водой на произошедшее изменение температуры: Q = cΔt. После того, как указанный процесс закончен, система должна быть приведена к исходному состоянию. Это можно сделать путём мысленного эксперимента. Груз поднимается на исходную высоту, при этом извне над системой совершается работа, которая увеличивает энергию системы. Кроме того, от калориметра при охлаждении его до исходной температуры отнимается (передаётся в окружающую среду) теплота. Эти операции возвращают систему к исходному состоянию: все измеримые свойства системы приобретают те же значения, которые они имели в исходном состоянии. Процесс, в течение которого система изменяла свои свойства и в конце которого вернулась к исходному состоянию, называется круговым (циклическим) процессом или просто циклом.
Единственным результатом описанного цикла является отнятие работы от среды, окружающей систему, и переход в эту среду теплоты, взятой у калориметра. Сравнение двух величин (работы и теплоты) показывает постоянное отношение между ними, не зависящее от величины груза, размеров калориметра и конкретных количеств теплоты и работы в разных опытах.
Теплоту и работу в циклическом процессе целесообразно записать как интегральную сумму бесконечно малых (элементарных) теплот δQ и бесконечно малых (элементарных) работ δА ,
![]() (1)
(1)
Здесь J - коэффициент пропорциональности, называемый механическим эквивалентом теплоты; его можно принять равным единице, выразив теплоту и работу в одних и тех же единицах измерения. Уравнение (1) представляет собой закон сохранения энергии для частного случая превращения работы в теплоту.
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой. Адиабатическими можно считать быстро протекающие процессы. Так как передачи теплоты при адиабатическом процессе не происходит, то
 и
уравнение I начала термодинамики
принимает вид dQ = du + dA
и
уравнение I начала термодинамики
принимает вид dQ = du + dA
или
![]()
т.е. внешняя работа газа может производиться вследствие изменения его внутренней энергии. Адиабатное расширение газа (dV>0) сопровождается положительной внешней работой, но при этом внутренняя энергия уменьшается и газ охлаждается (dT<0).
Сжатие газа (dV0, т.е. адиабатное сжатие газа сопровождается его нагреванием.
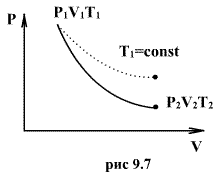
Линию,
изображающую адиабатический процесс
в диаграмме состояния, называют адиабатой.
На рисунке сплошной линией показан вид
адиабаты в (P-V) диаграмме. Для сравнения
в том же рисунке пунктирной линией
изображена изотерма, соответствующая
температуре газа в начальном состоянии
1. Так как для любого идеального газа
показатель адиабаты ![]() ,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
,
то в (P-V) диаграмме адиабата всегда идет
круче, чем изотерма. Объясняется это
тем, что при адиабатическом сжатии
увеличение давления обусловлено не
только уменьшением объема газа, как при
изотермическом сжатии, то также еще и
увеличения температуры. При адиабатическом
расширении температура газа уменьшается,
поэтому давление газа падает быстрее,
чем при изотермическом расширении.
5.Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Молярная теплоемкость вещества – теплоемкость 1 моля данного вещества. Единица измерения – Дж/(моль К).
6. Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным. Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю и сообщаемая газу извне теплота вдет только на увеличение его внутренней энергии:
![]()
Если газ нагревается при постоянном давлении, то выражение можно записать в виде
![]()
Теплоемкость при постоянном давлении всегда больше, чем теплоемкость при постоянном объеме. Теплоемкость вещества не является постоянной величиной и обычно возрастает с повышением температуры.
Объяснением того, почему сp превышает сv, является работа по расширению, которую газ должен выполнить при постоянном давлении. Отношение сp к сv , называемое k, является функцией от количества атомов в молекуле:
|
|
|
7. Точки 1 и 2 лежат на одной адиабате, следовательно, (Р1V1)γ = P0V2 отсюда
(1)
Точки 1 и 3 должны лежать на одной изотерме (T=T0=const) и можно записать P1V1=P2V2
(2)
возведём в степень с учётом (1) получим или учитывая найденные значения P1, P2
(3)
Логарифмируем (3)
Lg(P + h ) - lgP = lg(P + h ) – lg(P + h )
Отсюда =
Так как давления P0, P0+h1 и P0+h2 мало отличаются друг от друга, то разность логарифмов можно принять пропорциональными разности самих давлений и приближённо принять
=
И мы получаем окончательную расчётную формулу для определения коэффициента Пуассона .
