
- •Электроёмкость конденсатора,
- •Энергия электрического поля.
- •Механическое движение и его относительность;
- •Уравнения прямолинейного равноускоренного движения.
- •Движение по окружности с постоянной по модулю скоростью;
- •Период и частота;
- •Центростремительное ускорение.
- •Электрический ток в растворах и расплавах электролитов;
- •Закон Фарадея;
- •Технические применения электролиза.
- •Первый закон Ньютона;
- •Инерциальная система отсчёта.
- •Понятие о массе и силе, принцип суперпозиции сил;
- •Формулировка второго закона Ньютона;
- •Классический принцип относительности.
- •Формулировка третьего закона Ньютона;
- •Характеристика сил действия и противодействия;
- •Модуль, направление, точка приложения, природа.
- •Закон сохранения импульса: импульс тела и импульс силы;
- •Выражение второго закона Ньютона с помощью понятий изменения импульса тела и импульса силы;
- •Реактивное движение.
- •Закон всемирного тяготения.
- •Сила тяжести: вес и невесомость.
- •Природа сил упругости;
- •Виды упругих деформаций;
- •Закон Гука
- •Вынужденные электромагнитные колебания.
- •Переменный ток: генератор переменного тока, мощность переменного тока;
- •Действующие значения силы переменного тока и напряжения.
- •Равновесие твёрдых тел: момент силы;
- •Условия равновесия твёрдого тела, устойчивость тел;
- •Виды равновесия, принцип минимума потенциальной энергии.
- •Электромагнитное поле,
- •Открытие электромагнитных волн: гипотеза Максвелла;
- •Опыты Герца.
- •Связь между давлением идеального газа и средней кинетической энергией теплового движения его молекул.
- •Уравнение состояния идеального газа.
- •Изопроцессы.
- •Постулаты специальной теории относительности (сто).
- •Полная энергия покоя.
- •Релятивистский импульс.
- •Дисперсия и поглощение света;
- •Спектроскоп и спектрограф.
- •Радиоактивность;
- •Радиоактивные излучения;
- •Закон радиоактивного распада.
- •Необратимость тепловых процессов;
- •Второй закон термодинамики и его статистическое истолкование.
- •Построение изображений в тонких линзах.
- •Оптическая сила линзы.
Связь между давлением идеального газа и средней кинетической энергией теплового движения его молекул.
Уравнение состояния идеального газа.
Изопроцессы.
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––Состояние данной массы полностью определено, если известны давление, температура и объем газа. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа единичное состояние газа описывается уравнением Менделеева— Клапейрона: pV = mRT/M,
где р — давление,
V — объем,
т — масса,
М — молярная масса,
R — универсальная газовая постоянная.
Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 Дж/моль • К).
Уравнение Менделеева—Клапейрона показывает, что возможно одновременно изменение пяти параметров, характеризующих состояние идеального
газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра из пяти. Особую роль в физике и технике играют три процесса: изотермический, изохорический и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля-Мариотта. pV = const.
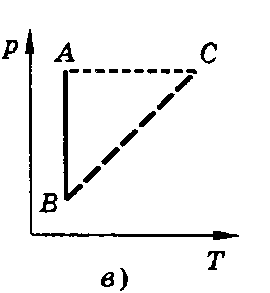
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля. V = const. p/T = const.
И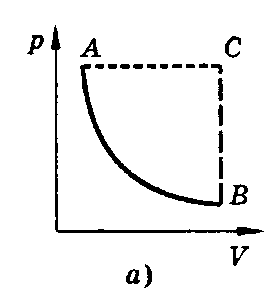
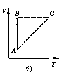 зобарным
называют процесс, протекающий при
постоянном давлении. Уравнение этого
процесса имеет вид V/T
== const
при р
= const
и называется законом Гей-Люссака.
Все процессы можно изобразить графически
(рис. 11).
зобарным
называют процесс, протекающий при
постоянном давлении. Уравнение этого
процесса имеет вид V/T
== const
при р
= const
и называется законом Гей-Люссака.
Все процессы можно изобразить графически
(рис. 11).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда, в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
Билет №18 (2)
Постулаты специальной теории относительности (сто).
Полная энергия покоя.
Релятивистский импульс.
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Два постулата СТО: принцип относительности и абсолютной скорости.
Все инерциальные системы отсчета физически равноправны – любые физические процессы протекают в них одинаково (при одних и тех же начальных условиях). Любая система отсчета, которая движется относительно ИСО равномерно и прямолинейно, так же является инерциальной. ИСО ничем не отличаются друг от друга, они полностью физически тождественны, и какие бы физические опыты ни были поставлены в данной ИСО, они дадут совершенно такие же результаты в любой другой ИСО. Не существует абсолютно покоящейся ИСО или абсолютно равномерно движущейся, речь может идти только о движении и покое относительно другой ИСО.
Основные понятия: событие и ИСО. Событие – физическое явление, происходящее в какой-либо пространственной точке в некоторый момент времени в избранной системе отсчета. Relativity(от англ относительность). Умножив неравенство V' ≤ c на выражение 1 – V/c, положительное т.к. V<c, то получим: V'(1 – V/c)≤c(1 – V/c) После раскрытия скобок и перегруппировки следует:
(v' + V/(1 + v'V/c2))≤c. В левой части этого неравенства стоит величина с размерностью скорости, обладающая следующими свойствами: при v'<c ее значение согласно верхнему неравенству так же меньше с; при v'=c получим знак равенства. Наконец, при v'<<c и V<<с рассматриваемая величина превращается в классическое выражение v' + V , имеющие в соответствии с (v = v' + V) смысл скорости v частицы в ИСО К. Значит преобразованное в начале выражение представляет собой релятивистский закон преобразования скоростей. Его сущность заключается в выражении идеи предельности постоянной с: при любых относительных скоростях ИСО V<c нельзя путем перехода от одной из них к другой изменить скорость частицы так, чтобы изменилась ее принадлежность к соответствующему классу частиц. Частицы, движущиеся с абсолютной скоростью, отличаются предельной инерционностью – они всегда движутся только по инерции и не могут быть ни замедлены, ни ускорены. Масса частиц с абсолютной скоростью равна нулю (безмассовые). При взаимодействии безмассовых частиц с частицами вещества выполняются законы сохранения энергии и импульса. Во всех ИСО вектор импульса такой частицы отличен от нуля р*≠ 0, т.к. частицу, движущуюся с абсолютной скоростью, остановить нельзя; Е* ≠ 0. Возможно лишь совместное и одновременное обращение в нуль обеих динамических характеристик частицы, что будет означать прекращение ее существования. Соотношение для безмассовой частицы: Е*2 – р*2с2 = 0 – оно справедливо для всех ИСО. Существуют частицы, которые всегда движутся со скоростью, меньшей скорости света. Скорость таких частиц зависит от их индивидуальных качеств и взаимодействий с другими частицами может изменяться в широких пределах от нуля до любого значения V<c . Это свойство частиц определяется наличием у них массы. Масса частицы абсолютна: она не зависит от выбора ИСО, а значит и от скорости движения частицы. Энергия массовой частицы в ее собственной системе отсчета, где импульс частиц равен нулю, должна быть отлична от нуля, т.е. при р = 0 ; Е0 ≠ 0. Из выше сказанного следует: Е0 = mc2. Соотношение для частицы с V<c Е2 – р2с2 ≠ 0( в любой ИСО). Е2 – р2с2 = m2c4
т.к Е2 – р2с2 = Е02. р = Еv/с2 (релятивистский импульс) подставим в предыдущее: Е = γmc2 =
= mc2/√(1 – v2/c2). Следовательно формула для релятивистского импульса массовой частицы:
p = γmv = mv/√(1 – v2/c2). Применение новой, более общей физической теории к предметной области, где справедлива менее общая теория, должно дать те же результаты, что и при использовании расчетных соотношений последней. Единой физической реальностью является электромагнитное поле, а не отдельно электр – ое и магнитное поля.
Билет №19 (1)
Модель строения жидкостей.
Насыщенные и ненасыщенные пары;
зависимость давления насыщенного пара от температуры;
кипение.
Влажность воздуха; точка росы, гигрометр, психрометр.
––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––––
Испарение и конденсация. Процесс перехода вещества из жидкого состояния в газообразное состояние называется парообразованием, обратный процесс превращения вещества из газообразного состояния в жидкое называют конденсацией. Существуют два вида парообразования - испарение и кипение. Рассмотрим сначала испарение жидкости. Испарением называют процесс парообразования, происходящий с открытой поверхности жидкости при любой температуре. С точки зрения молекулярно-кинетической теории эти процессы объясняются следующим образом. Молекулы жидкости, участвуя в тепловом движении, непрерывно сталкиваются между собой. Это приводит к тому, что некоторые из них приобретают кинетическую энергию, достаточную для преодоления молекулярного притяжения. Такие молекулы, находясь у поверхности жидкости, вылетают из неё, образуя над жидкостью пар (газ). Молекулы пар~ двигаясь хаотически, ударяются о поверхность жидкости. При этом часть из них может перейти в жидкость. Эти два процесса вылета молекул жидкости и ах обратное возвращение в жидкость происходят одновременно. Если число вылетающих молекул больше числа возвращающихся, то происходит уменьшение массы жидкости, т.е. жидкость испаряется, если же наоборот, то количество жидкости увеличивается, т.е. наблюдается конденсация пара. Возможен случай, когда массы жидкости и пара, находящегося над ней, не меняются. Это возможно, когда число молекул, покидающих жидкость, равно числу молекул, возвращающихся в неё. Такое состояние называется динамическим равновесием, а пар, находящийся в динамическом равновесии со своей жидкостью, называют насыщенным. Если же между паром и жидкостью нет динамического равновесия, то он называется ненасыщенным. Очевидно, что насыщенный пар при данной температуре имеет определённую плотность, называемую равновесной.
Это обусловливает неизменность равновесной плотности, а следовательно, и давления насыщенного пара от его объёма при неизменной температуре, поскольку уменьшение или увеличение объёма этого пара приводит к конденсации пара или к испарению жидкости соответственно. Изотерма насыщенного пара при некоторой температуре в координатной плоскости Р, V представляет собой прямую, параллельную оси V. С повышением температуры термодинамической системы жидкость - насыщенный пар число молекул, покидающих жидкость за некоторое время, превышает количество молекул, возвращающихся из пара в жидкость. Это продолжается до тех пор, пока возрастание плотности пара не приводит к установлению динамического равновесия при более высокой температуре. При этом увеличивается и давление насыщенных паров. Таким образом, давление насыщенных паров зависит только от температуры. Столь быстрое возрастание давления насыщенного пара обусловлено тем, что с повышением температуры происходит рост не только кинетической энергии поступательного движения молекул, но и их концентрации, т.е. числа молекул в единице объема
При испарении жидкость покидают наиболее быстрые молекулы, вследствие чего средняя кинетическая энергия поступательного движения оставшихся молекул уменьшается, а следовательно, и температура жидкости понижается (см. §24). Поэтому, чтобы температура испаряющейся жидкости оставалась постоянной, к ней надо непрерывно подводить определённое количество теплоты.
Количество теплоты, которое необходимо сообщить единице массы жидкости, для превращения её в пар при неизменной температуре называется удельной теплотой парообразования. Удельная теплота парообразования зависит от температуры жидкости, уменьшаясь с её повышением. При конденсации количество теплоты, затраченное на испарение жидкости, выделяется. Конденсация – процесс превращения из газообразного состояния в жидкое.
Влажность воздуха. В атмосфере всегда содержится некоторое количество водяных паров. Степень влажности является одной из существенных характеристик погоды и климата и имеет во многих случаях практическое значение. Так, хранение различных материалов (в том числе цемента, гипса и других строительных материалов), сырья, продуктов, оборудования и т.п. должно происходить при определенной влажности. К помещениям, в зависимости от их назначения, также предъявляются соответствующие требования по влажности.
Для
характеристики влажности используется
ряд величин. Абсолютной влажностью
р называется масса водяного пара,
содержащегося в единице объёма воздуха.
Обычно она измеряется в граммах на
кубический метр (г/м3).
Абсолютная влажность связана с парциальным
давлением Р водяного пара уравнением
Менделеева – Клайпейрона
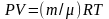 ,
где V
- объём, занимаемый паром, m,
Т и
— масса, абсолютная температура и
молярная масса водяного пapa, R —
универсальная газовая постоянная (см.
(25.5)). Парциальным давлением называется
давление, которое оказывает водяной
пар без учёта действия молекул воздуха
другого сорта. Отсюда
,
где V
- объём, занимаемый паром, m,
Т и
— масса, абсолютная температура и
молярная масса водяного пapa, R —
универсальная газовая постоянная (см.
(25.5)). Парциальным давлением называется
давление, которое оказывает водяной
пар без учёта действия молекул воздуха
другого сорта. Отсюда
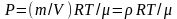 ,
так как р = m/V— плотность водяного пара.
,
так как р = m/V— плотность водяного пара.
В определённом объёме воздуха при данных условиях количество водяного пара не может увеличиваться беспредельно, поскольку существует какое-то предельное количество паров, после чего начинается конденсация пара. Отсюда появляется понятие максимальной влажности. Максимальной влажностью Pm называют наибольшее количество водяного пара в граммах, которое может содержаться в 1 м3 воздуха при данной температуре (по смыслу это есть частный случай абсолютной влажности). Понижая температуру воздуха, можно достичь такой температуры, начиная с которой пар начнёт превращаться в воду — конденсироваться. Такая темпepaтypa носит название точки росы. Степень насыщенности воздуха водяными парами характеризуется относительной влажностью. Относительной влажностью b называют отношение абсолютной влажности р к максимальной Pm т.е. b=P/Pm. Часто относительную влажность выражают в процентах.
Существуют различные методы определения влажности.
1. Наиболее точным является весовой метод. Для определения влажности воздуха его пропускают через ампулы, содержащие вещества, хорошо поглощающие влагу. Зная увеличение массы ампул и объём пропущенного воздуха, определяют абсолютную влажность.
2. Гигрометрические методы. Установлено, что некоторые волокна, в том числе человеческий волос, изменяют свою длину в зависимости от относительной влажности воздуха. На этом свойстве основан прибор, называемый гигрометр ом. Имеются и другие типы гигрометров, в том числе и электрические.
З. Психрометрический метод — это наиболее распространенный метод измерения. Суть его состоит в следующем. Пусть два одинаковые термометра находятся в одинаковых условиях и имеют одинаковые показания. Если же баллончик одного из термометров будет смочен, например, обернут мокрой тканью, то показания окажутся различными. Вследствие испарения воды с ткани так называемый влажный термометр показывает более низкую температуру, чем сухой. Чем меньше относительная влажность окружающего воздуха, тем интенсивнее будет испарение и тем ниже показание влажного термометра. Из показаний термометров определяют разность температур и по специальной таблице, называемой психрометрической, определяют относительную влажность воздуха.
Билет №19 (2)
