
- •Содержание
- •Тема 1. Введение. Твердое тело. Силы
- •1.1 Введение 9
- •Тема 2. Строение твердого тела 23
- •Тема 3. Дефекты. Роль дефектов в твердом теле 57
- •3.2. Точечные дефекты решетки 57
- •Тема 4. Диаграммы состояния двухкомпонентных
- •Тема 5. Некоторые положения квантовой механики 99
- •Тема 6. Элементы зонной теории твердого тела. Взгляд на строение атома и твердого тела с позиций квантовой механики 119
- •Тема 7. Полупроводники. Собственный полупро-
- •Тема 8 . Размерное квантование и квантово-размер-
- •Тема 9. Основные положения термодинамики, механизмы роста пленок и образование зародышей 192
- •Тема 10. Технология получения, механизмы и режимы роста гетероэпитаксиальных структур 232
- •Тема 11. Методы получения нанообъектов и квантово-размерных структур 267
- •Тема 12. Методы исследования наноматериалов 341
- •Тема 1. Введение. Твердое тело. Силы взаимодействия. Типы связи.
- •1.1. Введение
- •1.2. Твердое тело. Силы взаимодействия. Типы связи.
- •Тема 2. Строение твердого тела. Цели и задачи изучения темы:
- •2.1. Кристалл.
- •2.2. Решетка Бравэ. Трансляция. Элементарная ячейка.
- •2.3.Элементы симметрии.
- •2.4. Группы симметрии. Сингонии.
- •2.5. Плотнейшие упаковки частиц в структурах.
- •2.6. Жидкие кристаллы.
- •2.7.Наночастицы с гранецентрированной решеткой. Кубоктаэдр.
- •Элементы симметрии.
- •Тема 3. Дефекты. Роль дефектов в твердом теле.
- •3.1. Дефекты кристаллических решеток.
- •3.2. Точечные дефекты решетки
- •3.3. Линейные дефекты кристаллической решетки.
- •3.4 Поверхностные дефекты кристаллической решетки.
- •3.5. Объёмные дефекты кристаллической решетки.
- •3.6. Энергетические дефекты кристаллической решетки.
- •3.7. Твёрдые растворы
- •Поверхностные дефекты кристаллической решетки.
- •Тема 4. Диаграммы состояния двухкомпонентных систем.
- •4.1. Типы диаграмм состояния.
- •Тема 5. Некоторые положения квантовой механики.
- •5.1.Возникновение квантовой механики.
- •5.2. Волновая функция ψ. Плотность вероятности.
- •5.3. Соотношение неопределенности Гейзенберга.
- •5.4. Общее уравнение Шредингера. Уравнение Шредингера для стационарных состояний.
- •5.5. Принцип причинности в квантовой механике.
- •5.6. Движение свободной частицы
- •5.7. Частица в одномерной прямоугольной «потенциальной яме» с бесконечно высокими «стенками».
- •5.8. Прохождение частицы сквозь потенциальный барьер. Туннельный эффект
- •5.9. Линейный гармонический осциллятор в квантовой механике.
- •Принцип причинности в квантовой механике.
- •Движение свободной частицы.
- •Тема 6. Элементы зонной теории твердого тела. Взгляд на строение атома и твердого тела с позиций квантовой механики.
- •6.1. Взгляд на строение атома и твердого тела с позиций кванто-вой механики.
- •6.1.1. Современный взгляд на строение и свойства
- •6.1.2. Взгляд на строение атома с позиций квантовой механики.
- •6.2. Элементы зонной теории.
- •6.2.1.Основные положения зонной теории.
- •6.2.2. Волновая функция электрона в периодическом поле.
- •6.2. 3. Зоны Бриллюэна.
- •6.2.4. Методы расчета энергетической структуры кристаллов.
- •6.2.4.1. Приближение сильносвязанных электронов.
- •6.2.4.2. Приближение свободных электронов. Энергетический спектр электронов в прямоугольной потенциальной яме.
- •6.2.4.3. Приближение слабосвязанных электронов.
- •6.2.5. Модель Кронига – Пенни.
- •6.2.6. Заполнение зон электронами. Металлы, диэлектрики, полупроводники.
- •Тема 7. Полупроводники. Собственный полупроводник. Генерация и рекомбинация носителей зарядов. Уровень Ферми. Эффективная масса носителя заряда. Примесный полупроводник. Цели и задачи изучения темы:
- •7.1. Полупроводники.
- •7.2.Собственные и примесные полупроводники. Носители заряда в полупроводниках.
- •7.3. Энергия Ферми.
- •7.4. Генерация и рекомбинация носителей зарядов.
- •7.5. Собственная проводимость полупроводника.
- •7.6. Примесные полупроводники.
- •7.6.1. Примесные уровни.
- •7.6.2. Примесная проводимость полупроводников.
- •7.6.3. Полупроводник р-типа.
- •7 .6.4. Сильно легированный полупроводник. Роль беспорядка в кристалле.
- •7.7. Температурная зависимость проводимости примесных полупроводников.
- •7.8. Дрейфовый и диффузионный токи в полупроводнике.
- •А плотность дырочного дрейфового тока
- •Вопросы для повторения:
- •Резюме по теме:
- •Тема 8 . Размерное квантование и квантово-размерные структуры.
- •8.1. Принцип размерного квантования
- •8.2. Условия наблюдения квантовых размерных эффектов.
- •8.3. Структуры с двумерным электронным газом.
- •8.4. Структуры с одномерным электронным газом (квантовые нити).
- •8.5. Структуры с нуль-мерным электронным газом
- •8.6. Структуры с вертикальным переносом.
- •Тема 9. Основные положения термодинамики, механизмы роста пленок и образование зародышей.
- •9.1. Основные понятия термодинамики.
- •9.2. Три начала термодинамики.
- •9.3. Термодинамические потенциалы.
- •9.4. Термодинамическая теория фазовых равновесий.
- •9.4.1. Термодинамические системы.
- •9.4.2. Условия фазового равновесия.
- •9.4.3. Фазовые переходы.
- •9.5. Принцип локального равновесия.
- •9.6. Самоорганизация систем.
- •9.7. Поверхностные явления.
- •9.7.1. Поверхностная энергия.
- •9.7.2. Поверхностное натяжение.
- •9.7.3. Капиллярные явления.
- •9.7.4. Адсорбция, десорбция и испарение с поверхности.
- •9.8. Массоперенос и ионизация на поверхности.
- •9.8.1. Массоперенос и ионизация на поверхности.
- •9.8.2. Межфазные характеристики.
- •9.9. Механизмы роста пленок на реальных подложках.
- •Тема 10. Технология получения, механизмы и режимы роста гетероэпитаксиальных структур.
- •10.1. Гетерогенные процессы формирования наноструктур
- •10.1.1. Молекулярно-лучевая эпитаксия.
- •10.2. Газовая эпитаксия из металлоорганических соединений.
- •10.3. Метод нанолитографии.
- •10.4. Самоорганизация квантовых точек и нитей.
- •10.4.1. Режимы роста гетероэпитаксиальных структур.
- •10.4.2. Рост наноструктур на фасетированных поверхностях.
- •10.4.3. Трехмерные массивы когерентно-напряженных островков.
- •10.4.4. Поверхностные структуры плоских упругих доменов.
- •1 0.4.5. Структуры с периодической модуляцией состава в эпи-таксиальных пленках твердых растворов полупроводников.
- •1 0.5. Изготовление наноструктур и наноприборов с помощью стм и асм.
- •Тема 11. Методы получения нанообъектов и квантоворазмерных структур.
- •11.1. Коллоидная и золь-гельная технология.
- •11.1.1. Формирование структур на основе коллоидных растворов.
- •11.1.2. Организация и самоорганизация коллоидных структур.
- •11.1.3. Оптические и электронные свойства коллоидных кластеров.
- •11.1.4. Коллоидные кристаллы. Формирование упорядоченных наноструктур.
- •11.1.5. Золь-гель технология.
- •11.1.6. Методы молекулярного наслаивания и
- •11.1.7. Методы получения металлов и диэлектриков.
- •11.2. Методы получения упорядоченных наноструктур. Гетероструктуры.
- •11.2.1. Гетероструктуры – основа получения наноструктур.
- •11.2.2. Формирование полупроводниковых и металлических нановолокон и спиралей.
- •11.2.3 Самоорганизация при эпитаксиальном росте.
- •12.2.3.1. Наногофрированные структуры.
- •11.2.3.2. Самоорганизация гетероэпитаксиальных структур.
- •11.3. Пучковые методы нанолитографии.
- •11.3.1. Литографические методы формирования структур.
- •11.3.2. Оптическая литография.
- •11.3.3. Рентгеновская литография.
- •11.3.4. Электронная литография.
- •11.3.5. Ионная литография.
- •11.3.6. Возможности пучковых методов нанолитографии в наноэлектронике.
- •11.3.7. Нанопечатная литография.
- •11.3.8. Ионный синтез квантовых наноструктур.
- •11.4. Рост на активированных поверхностях. Нановискеры.
- •11.5. Методы зондовой нанотехнологии.
- •11.5.1. Физические основы зондовой нанотехнологии.
- •11.5.2. Контактное формирование нанорельефа.
- •11.5.3. Бесконтактное формирование нанорельефа.
- •11.5.4. Локальная глубинная модификация поверхности.
- •11.5.5. Межэлектродный массоперенос.
- •11.5.6. Локальное анодное окисление.
- •11.5.8. Совместное использование лазера и стм
- •Тема 12. Методы исследования наноматериалов.
- •12.1. Введение.
- •12.2. Методы исследования химического состава поверхности.
- •12.2.1. Масс-спектроскопия.
- •12.2.3. Ионная масс-спектроскопия.
- •12.2.4. Фотоэлектронная спектроскопия.
- •12.2.5. Радиоспектроскопия.
- •12.3. Исследования физической структуры поверхности.
- •12.3.1. Рентгеноструктурный анализ.
- •12.3.2. Рентгеновская спектроскопия и дифракция.
- •1 2.3.2.1. Рассеяние на аморфных и частично упорядоченных объектах. Малоугловое рентгеновское рассеяние.
- •12.3.2.2. Рентгеновская спектроскопия поглощения: exafs, xans, nexafs.
- •12.3.3. Анализ поверхности электронным пучком.
- •12.3.4. Полевая эмиссионная микроскопия.
- •12.3.5. Сканирующая зондовая микроскопия.
- •12.3.5.1. Сканирующая туннельная микроскопия.
- •12.3.5.2. Атомно-силовая микроскопия.
- •12.3.6. Магнито – силовая микроскопия.
- •12.3.7. Электронная микроскопия.
- •12.3.8. Эллипсометрия.
- •12.4. Спектроскопия.
- •12.4.1. Инфракрасная и рамановская спектроскопия.
- •12.4.2. Фотоэмиссия и рентгеновская спектроскопия.
- •12.5. Методы исследования кинетических свойств объема и поверхности наноматериалов и наноструктур.
- •12.5.1. Исследование удельного сопротивления.
- •12.5.2. Диагностика поверхностных состояний.
- •12.5.3. Кинетические параметры.
Каково отличие геометрических дефектов от энергетических ?
Перечислите типы точечных дефектов кристаллической решетки.
Механизмы диффузии. Методы исследования диффузии в твердом теле.
Влияние дефектов на свойства твердых тел.
Линейные дефекты в кристалле. Вектор Бюргерса.
Источник дислокаций Франка-Рида.
Дислокации и рост кристаллов.
Поверхностные дефекты кристаллической решетки.
Границы зерен. Свойства малоугловых границ.
Свойства большеугловых границ. Зерна или кристаллиты. Что называется поликристаллом?
Специальные границы зерен. Как зависит энергия границ от угла между ними?
Дать определение и привести примеры объемных дефектов решетки.
Привести примеры энергетических дефектов.
Дать определение твердого раствора. Перечислить типы твердых растворов . Как образуется сверхструктура ?
Резюме по теме
В процессе изучения темы мы ознакомились с механизмами образования различных типов дефектов и их влиянием на свойства твердого тела.
Литература
«Дефекты кристаллического строения, механические свойства металлов и сплавов» под ред.Р. Кана, Мир, М.,1968, с. 484.
М.П. Шаскольская, Кристаллография, М., Высшая школа, 1976., с.392.
Ч. Пул, Ф. Оуэн Нанотехнологии, М., Техносфера, 2007, с.375.
В. Гуртов, Твердотельная электроника, М., Техносфера, 2005, с.406.
Б.К. Вайнштейн, В.М. Фридкин, В.Л. Инденбом, Структура кристаллов, М., Наука, 1979, с.354.
Тема 4. Диаграммы состояния двухкомпонентных систем.
Цели и задачи изучения темы:
Целью изучения данной темы является получение навыков чтения диаграмм состояния двойных систем и изучение закономерностей их постро-ения.
Многие наноматериалы являются многокомпонентными системами. Такими объектами, например, могут быть наночастицы или матрицы заклю-чающие в себе нанокомпозит. Многокомпонентными твердыми растворами являются тонкие пленки во многих полупроводниковых гетероструктурах.
Очень важно установить зависимость между составом и свойствами сложных систем. Экспериментально определяются такие свойства материала, как удельный вес, поверхностное натяжение, вязкость, магнитные, каталити-ческие и многие другие свойства в зависимости от состава.
Технологи и материаловеды очень часто выбирают температуру плав-ления в качестве основного свойства, а также температуры равновесия между жидкой и твердой фазами, и температуры фазовых равновесий в твердом состоянии (при полиморфных превращениях, образовании и распаде твердых растворов).
4.1. Типы диаграмм состояния.
Удобнее всего рассмотреть закономерности построения диаграмм состояния двухкомпонентных систем. Пусть из двухкомпонентной жидкости выделяются твердые фазы. Если система состоит только из одной жидкой фазы, это означает, что в известных пределах можно произвольно изменять и температуру, и состав жидкости, оставляя систему однофазной. Таким образом, на диаграмме равновесия (в координатах состав - температура) однофазной двухкомпонентной системе соответствует плоскость. Если из жидкости при ее охлаждении выделяется одна твердая фаза, то следовательно, это моновариантное равновесие изображается линией. Такие линии ограничивают фазовые поля, т.е. области существования фаз, например, твердой или жидкой. Очевидно, точка пересечения двух линий соответствует одновременному существованию трех фаз - двух твердых и одной жидкой. Такое равновесие является нонвариантным и изменение любого параметра (температуры или состава) приведет к исчезновению одной из фаз. Рассмотрим основные типы диаграмм равновесий (или состояний) в двухкомпонентных системах.
Первый тип диаграмм.
Компоненты
А
и В
неограниченно взаимно растворимы в
жидком состоянии, а в твердом не образуют
ни растворов, ни химических соединений.
Известно, что абсолютной нерастворимости
компонентов друг в друге не существует.
Однако для упрощения в некоторых случаях
с достаточным приближением можно
считать, что из жидкости выделяются
чистые компоненты в виде отдельных фаз.
Это наблюдается, например, для таких
систем, как Pb–As,
Cd–Bi,
Au–Si,
KCl–LiCl,
CaO–MgO.
Диаграмма
равновесия для подобных систем
схематически представлена на рис. 4.1.1,
на котором по оси ординат откладывается
температура плавления, а по оси а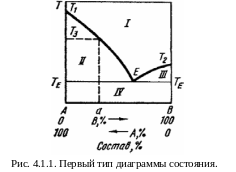 бсцисс
– состав.
бсцисс
– состав.
Жидкий расплав (поле I) характеризуется тем, что в известных преде-лах можно произвольно изменять его температуру и состав, не вызывая появления новых фаз. Линии T1E и Т2Е и горизонталь ТЕЕТЕ ограничивают области (поля II и III), соответствующие моновариантным двухфазным рав-новесиям. В них заданной температуре соответствует определенный состав жидкости, равновесной с кристаллами компонентов (А или В), и, наоборот, данному составу жидкости соответствует своя температура кристаллизации. Так, при температуре Т3 состав жидкости, находящейся в равновесии с твер-дым компонентом А, определяется пересечением горизонтальной прямой, идущей на уровне Т3 с линией Т1Е, т.е. соответствует точке а на оси абсцисс.
В поле II существуют две фазы - расплав переменного состава, завися-щего от Т, и твердый компонент А. Поле III также ограничивает область существования двух фаз - твердого компонента В и расплава переменного состава. Поле IV соответствует механической смеси твердых компонентов А и В.
Диаграммы
равновесия преимущественно строятся
на основании измерений температуры
охлаждающихся сплавов различного
состава, ход которых изменяется при
выделении фаз, и других превращениях.
Результаты этих измерений изображаются
на графиках в координатах температура
- время в виде так называемых кривых
охлаждения. Построение диаграммы первого
типа таким способом пояснено на рис.
4.1.2, где в левой части представлены
кривые охлаждения. Состав
1
– чистый компонент А.
При охлаждении расплава температура
монотонно уменьшается до Т1.
Здесь температура остается некоторое
время постоянной и равной температуре
плавления компонента А(Т).
Это объясняется тем, что при кристаллизации
освобождается теплота плавления. Такая
остановка (горизонтальный участок на
кривой 1)
длится до полного завершения кристаллизации.
Дальнейшее охлаждение твердого компонента
А
описывается плавной кривой. Найден-ную
температуру плавления Т1
отмечают на левой оси ординат,
соответст-в ующей
чистому компоненту на диаграмме
равновесия.
ующей
чистому компоненту на диаграмме
равновесия.
Состав 2 – расплав содержит компоненты А и В. При охлаждении до температуры Т2 достигается насыщение и начинают выделяться кристаллы чистого компонента А. Процесс охлаждения замедляется (излом на кривой), так как освобождается теплота плавления. Температура Т2 отмечается на диаграмме равновесия на перпендикуляре, восстановленном к оси составов в точке 2. В отличие от предыдущего случая здесь не может быть постоянства температуры при кристаллизации, так как вследствие выделения компо-нента А расплав непрерывно становится всё более концентрированным относительно компонента В, и поэтому температура его замерзания пони-жается. Совокупность подобных точек выделения кристаллов компонента А – линия Т1Е, описывающая составы расплавов, равновесных с компонентом Aт. При температуре TE концентрация компонента В настолько увеличивается, что расплав становится насыщенным и этим компонентом. Следовательно, находится в равновесии одновременно с кристаллами компонентов А и В. Расплав такого состава, называющегося эвтектическим, затвердевает цели-ком без изменения состава и при неизменяющейся температуре, подобно чистому компоненту. Это следует из правила фаз, так как компоненты Aт и Bт представляют собой отдельные фазы (жидкость – третья фаза) т.е. равновесие при ТЕ является нонвариантным (остановка на кривой охлаждения). Ниже ТЕ жидкость полностью исчезает и существует лишь смесь из двух твердых фаз А и В. Под микроскопом в полностью затвердевшем сплаве можно увидеть относительно крупные кристаллы А, которые выделились из расплава во время его охлаждения от Т2 до ТЕ. Они находятся в массе, представляющей собой тесную смесь мелких кристалликов А и В, которая образовалась при окончательном затвердевании расплава при ТЕ. Такая смесь называется эвтектикой. Она не является фазой, а есть механическая смесь двух фаз.
Состав 3 - кривая охлаждения имеет такой же вид, как для состава 2, с той разницей, что выделение кристаллов компонента А начинается при более низкой температуре, так как по мере повышения концентрации компонента В от состава 2 до 3 температура начала кристаллизации понижается от Т2 до Т3. Подобные кривые охлаждения и такие же фазы характерны для сплавов, составы которых лежат в интервале концентраций от компонента А до состава 4.
Состав 4 – эвтектический, как отмечалось выше, кристаллизуется при постоянной температуре ТЕ. Эвтектическая точка Е отвечает равновесию трех фаз - одной жидкой и двух твердых, которое изображается уравнением: Расплав (состава 4) ←→ Aт + Bт. Для эвтектического расплава характерна кривая охлаждения такая же, как для чистого вещества. Вследствие одновременной кристаллизации А и В эвтектическая смесь состоит, как уже отмечалось, из мелких, тесно перемешанных кристалликов обоих компо-нентов. Эта смесь имеет самую низкую температуру плавления из всех спла-вов данной системы. При любых других составах эвтектическая состав-ляющая первая начинает выплавляться из любого твердого сплава при его нагревании до TE.
Состав 5 – при охлаждении этого расплава до температуры Т5 начина-ется кристаллизация чистого компонента В. По мере его выделения происходит дальнейшее понижение температуры, а остающаяся жидкость обогащается компонентом А. Составы расплавов, находящихся в равновесии с кристаллами компонента В, описываются линией Т6Е, подобно тому как расплавы, равновесные с кристаллами А описываются линией T1E.
Таким образом, при температуре ТЕ концентрация расплава соответ-ствует точке Е, и происходит кристаллизация эвтектики. Все расплавы, имеющие составы в интервале концентраций 4–6, характеризуются такими же кривыми охлаждения, как расплав 5.
Состав 6 – чистый компонент B, кривая охлаждения которого подобна кривой 1. Кристаллизация происходит при постоянной температуре Т6.
Как видно из рис. 4.1.2, кристаллизация всех сплавов системы А-В заканчивается при температуре ТЕ. При охлаждении расплава любого состава до этой температуры жидкая фаза принимает одну и ту же концентрацию, отвечающую эвтектике (точка Е). Горизонталь TETE называется линией солидуса, так как при более низких температурах существуют только твердые фазы, а жидкость полностью исчезает. Линии Т1Е и Т6Е называются линиями ликвидуса, так как при температурах, лежащих выше этих линий, существует только жидкая фаза.
Построение кривых охлаждения является одним из методов физико-химического анализа и называется термическим анализом. Академиком Н.С. Курнаковым еще в 1904 г. был создан прибор для автоматической записи кривых охлаждения. В настоящее время физико-химический анализ наряду с использованием кривых охлаждения, микроскопическими методами и измерениями твердости включает рентгеноструктурные, рентгеноспект-ральные и др. исследования.
П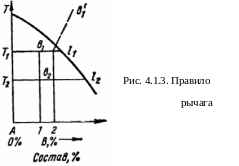 ри
помощи диаграмм равновесия можно
определить соотношение между весовыми
количествами сосуществующих фаз для
сплава данного состава при данной
температуре. Используемое для этого
правило рычага может быть пояснено
рис.4.1.3.
ри
помощи диаграмм равновесия можно
определить соотношение между весовыми
количествами сосуществующих фаз для
сплава данного состава при данной
температуре. Используемое для этого
правило рычага может быть пояснено
рис.4.1.3.
Для сплава состава 1 при температуре Т1 отношение массы жидкости Qж к массе выделившихся кристаллов компонента A Qт равно отношению отрезков T1b1 и b1l1: Qж/Qт = T1b1/b1l1. При температуре Т2 для того же сплава QжQт = T2b2/T2l2. Очевидно, что чем ближе состав расплава к эвтектическому, тем больше доля жидкой фазы при данной температуре. Например, для спла-ва 2 (рис. 4.1.3) при Т1 отношение Qж/Qт = T1b´1/ b´1l1 больше, чем отношение T1b1/b1l1. для сплава 1.
Вследствие этого горизонтальные участки на кривых охлаждения при температуре ТЕ (рис. 4.1.2) тем больше, чем ближе состав расплава к эвтектическому, т.е. чем больше жидкости остается при этой температуре.
Второй тип диаграмм.
Компоненты А и В неограниченно растворимы друг в друге как в жидком, так и в твердом состоянии и не образуют между собой химических соединений. Системы такого типа обычно образуются близкими по своей природе компонентами, например, Cu–Ni, Fe–Ni, Bi–Sb, Ag–Au, FeO–MnO.
На рис. 4.1.4 схематически представлена диаграмма такой системы. Кривые ALB (ликвидуса) и ASB (солидуса) подобны кривым для составов пара и жидкого раствора, т.е. составы твердого и жидкого растворов, находящихся в равновесии, не одинаковы.
Две кривые охлаждения компонентов А и В (в левой части рис. 4.1.4) относятся к чистым компонентам, а средняя – к расплаву состава 1. При охлаждении этого расплава до температуры T1 начинается кристаллизация твердого раствора, и охлаждение замедляется (перегиб на кривой).
Выделяющаяся фаза представляет собой твердый раствор, поэтому равновесие при его кристаллизации является моновариантным, т.е. температура плавления зависит от состава.
Вследствие различия составов твердой и жидкой фаз концентрации компонентов в обеих фазах изменяются в ходе кристаллизации, поэтому на кривых охлаждения отсутствуют остановки. После окончания кристал-лизации (состав твердой фазы совпадает с исходным составом жидкости) скорость охлаждения вновь увеличивается и на кривой появляется второй излом. Кривые охлаждения всех сплавов в этой системе подобны друг другу и различаются только температурами начала и конца кристаллизации.
И з
рис. 4.1.4 видно, что кристаллы твердого
раствора, находящегося в равновесии с
расплавом состава 1
при температуре Т1,
имеют состав, отвечающий точке 2,
т.е. твердая фаза обогащена более
тугоплавким компонентом.
з
рис. 4.1.4 видно, что кристаллы твердого
раствора, находящегося в равновесии с
расплавом состава 1
при температуре Т1,
имеют состав, отвечающий точке 2,
т.е. твердая фаза обогащена более
тугоплавким компонентом.
В процессе охлаждения системы в интервале Т1 – T2 составы равно-весных фаз меняются по линии ликвидуса (отрезок bm) и солидуса (отрезок bm). При этом жидкость обогащается более легкоплавким компо-нентом. Например, порции жидкости, оставшейся при температуре Т2 (точка а) и находящиеся в равновесии с кристаллами твердого раствора состава 1, имеют состав 3 (рис. 4.1.4). Очевидно, средний состав затвердев-шего сплава не отличается от исходного. В зависимости от скорости охлаждения в практике затвердевшие сплавы характеризуются разной степенью неоднородности. То обстоятельство, что во всем интервале температур ТА – ТB составы сосуществующих твердой и жидкой фаз отличаются друг от друга, позволяет осуществлять дробную кристал-лизацию. Повторение такой кристаллизации, т.е. операций расплавления и последующего отделения кристаллизующихся сплавов позволяет выделять один из компонентов в почти чистом состоянии.
Заметим, что в обычных условиях кристаллизации не достигается состояние равновесия, поэтому выделяющиеся твердые растворы не имеют вполне однородной структуры. Приблизиться к такой структуре можно лишь при чрезвычайно медленном охлаждении, когда при каждой температуре успевает установиться равновесие, для достижения которого должно произойти изменение состава ранее выделившихся кристаллов твердого раствора. Скорость последнего процесса определяется диффузией компонентов в твердом состоянии, которая протекает весьма медленно. Этим объясняется тот факт, что в практических условиях при кристаллизации сплавов наблюдается явление ликвации, состоящее в отличии по составу наружных и внутренних областей кристаллов твердых растворов (например, стальных слитков). В некоторых случаях ликвацию устраняют путем длительной выдержки сплавов при высоких температурах ниже линии солидуса.
Отношения масс твердой и жидкой фаз в процессе кристаллизации, как и на диаграммах первого типа, могут быть найдены по правилу рычага. Например, для сплава 1 при Т3 Qж/Qт = gh/fg.
К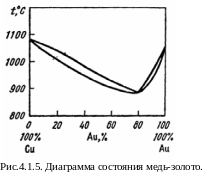 аждый
прямолинейный горизонтальный участок
на рис. 4.1.4, соединяющий кривую ALB
(ликвидус) и кривую ASB
(солидус), называется коннода.
Такой отрезок, например lb,
есть геометрическое место точек,
изображающих двухфазные системы,
состоящие из жидкого и твердого раствора
постоянных составов. При движении вдоль
конноды изменяются соотношения между
массами жидкой и твердой фаз, но составы
фаз остаются постоянными.
аждый
прямолинейный горизонтальный участок
на рис. 4.1.4, соединяющий кривую ALB
(ликвидус) и кривую ASB
(солидус), называется коннода.
Такой отрезок, например lb,
есть геометрическое место точек,
изображающих двухфазные системы,
состоящие из жидкого и твердого раствора
постоянных составов. При движении вдоль
конноды изменяются соотношения между
массами жидкой и твердой фаз, но составы
фаз остаются постоянными.
В тех случаях, когда компоненты имеют близкие температуры плавле-ния, диаграммы равновесия рассмотренного типа часто характеризуются наличием максимумов или минимумов. Пример такой диаграммы с минимумом для системы Cu–Ag приведен на рис. 4.1.5.
Сплав, который имеет состав, отвечающий точке экстремума, кристал-лизуется при постоянной температуре без изменения состава и поэтому не может быть разделен дробной кристаллизацией.
Сплавы, характеризующиеся неограниченной растворимостью в твердом состоянии, да исключением систем, имеющих диаграммы с экстремумами, кристаллизуются в некотором интервале температур, и сплаву каждого состава присущи определенные температуры начала и конца затвердевания.
Третий тип диаграмм.
Компоненты A и B имеют ограниченную взаимную растворимость в твердом состоянии. Рассмотренные выше две диаграммы относятся к предельным случаям абсолютной нерастворимости и полной растворимости компонентов в твердом состоянии. Существуют многочисленные системы, которые занимают промежуточное положение между этими двумя типами. В таких системах однородные твердые растворы компонента В в А, обозначаемые как α-растворы, образуются лишь до определенной концентрации В и твердые растворы А в В (β-растворы) до определенной концентрации А. Для таких систем возможны два случая.
1).Твердые растворы образуют эвтектику, т.е. точка нонвариантного равновесия Е лежит ниже температуры плавления чистых компонентов.
2).Твердые растворы с перитектикой - нонвариантная точка Р лежит между температурами плавления чистых компонентов.
Первый случай (рис. 4.1.6.) является сочетанием двух первых типов диаграмм (рис. 4.1.1. и рис. 4.1.4.). Диаграммы подобного типа наблюдаются, например, в системах Си–Ag, Pb–Sn.
Поле I – область существования одной фазы, в поле II сосуществуют жидкий расплав и твердая фаза α в поле III - жидкий расплав и твердая фаза β, в поле IV – однородный твердый раствор α в поле V – однородный твердый раствор β, и в поле VI – механическая смесь двух твердых фаз α и β.
В эвтектической точке имеет место нонвариантное равновесие трех фаз: жидкого расплава E, твердого раствора α, концентрация которого соответствует точке F, и твердого раствора β с концентрацией, отвечающей точке G.
На рис. 4.1.6 представлены две характерные кривые охлаждения. Сплав состава 1 кристаллизуется в интервале температур Т1 – Т2, в котором из расплава выделяется твердый раствор α. На кривой охлаждения имеются два перегиба, соответствующие началу и концу кристаллизации. Кроме того, при температуре T4 твердый α-раствор становится насыщенным и из него выделяется некоторое количество твердого раствора β состава 3, что сопро-вождается небольшим тепловым эффектом.
При охлаждении сплава 2 кристаллизация α-фазы начинается при температуре Т3 и заканчивается при ТЕ. При этой температуре из расплава одновременно кристаллизуются два твердых раствора α и β, составы которых соответствуют точкам F и G.
Р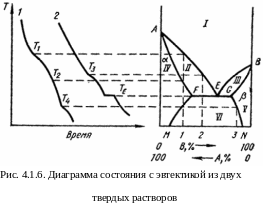 асплав
эвтектического состава затвердевает
без изменения своей концентрации, и
температура при его кристаллизации
остается постоянной. При охлаждении
затвердевших сплавов ниже линии солидуса
FG
происходит изменение концентрации
твердых растворов α и β и соответственно
по линиям FM
и GN,
которые дают температурную зависимость
растворимостей В
в А
и А
в В
в твердом состоянии. Теплота, выделяющаяся
при распаде твердых растворов, невелика
и редко обнаруживается на кривых
охлаждения. Кривые охлаждения сплавов,
составы которых лежат правее точки E,
подобны кривым 1
и 2.
асплав
эвтектического состава затвердевает
без изменения своей концентрации, и
температура при его кристаллизации
остается постоянной. При охлаждении
затвердевших сплавов ниже линии солидуса
FG
происходит изменение концентрации
твердых растворов α и β и соответственно
по линиям FM
и GN,
которые дают температурную зависимость
растворимостей В
в А
и А
в В
в твердом состоянии. Теплота, выделяющаяся
при распаде твердых растворов, невелика
и редко обнаруживается на кривых
охлаждения. Кривые охлаждения сплавов,
составы которых лежат правее точки E,
подобны кривым 1
и 2.
Второй случай представлен на рис. 4.1.7. Здесь также из расплава кристаллизуются два твердых раствора. Поле I – область жидкой фазы. В поле II сосуществуют жидкость и твердый раствор α, в поле III – жидкость и твердый раствор β, в поле IV – однородный α – раствор, в поле V – однородный β – раствор и в VI – механическая смесь двух твердых растворов α и β.
Как видно из хода кривых охлаждения, сплав 1 затвердевает так же, как и сплав 1 на предыдущей диаграмме.
Кривая охлаждения сплава 5 абсолютно подобна кривым на диаграм-мах второго типа, т.е. твердый раствор Р кристаллизуется в определенном интервале температур. В сплавах 2, 3, 4 при охлаждении сначала кристал-лизуется твердый раствор α. При понижении температуры до некоторого значения ТР этот раствор претерпевает превращение, которое называется перитектическим. Оно описывается реакцией α + расплав ←→ β, которая протекает при постоянной температуре и состоит во взаимодействии кристаллов ранее выделившегося α-раствора с жидкостью состава Р и образовании нового, твердого раствора β состава F, TP = const.
В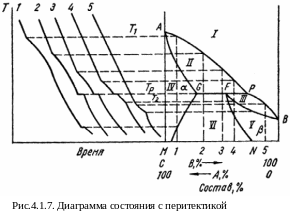 сплаве 4
после окончания перитектической реакции
остается избыток жидкой фазы, и при
дальнейшем его охлаждении в интервале
температур ТP – T2
происходит кристаллизация, твердого
β-раствора. Ниже Т2
про-исходит охлаждение однородного
твердого раствора Р.
При дальнейшем понижении температуры
(ниже линии FN,
точка Т3)
этот раствор становится неустойчивым
и, распадаясь, выделяет некоторое
количество раствора
α–состава,
отвечающего линии GM
(точка Q).
В сплавах 2
и 3
после окончания перитектической реакции
полностью исчезает жидкая фаза и ниже
температуры ТP
остаются в равновесии два твердых
раствора
и ,
составы которых по мере снижения
температуры изменяются в соответствии
с ходом линий GM,
FN.
Примером системы с перитектикой может
служить Cd–Hg.
сплаве 4
после окончания перитектической реакции
остается избыток жидкой фазы, и при
дальнейшем его охлаждении в интервале
температур ТP – T2
происходит кристаллизация, твердого
β-раствора. Ниже Т2
про-исходит охлаждение однородного
твердого раствора Р.
При дальнейшем понижении температуры
(ниже линии FN,
точка Т3)
этот раствор становится неустойчивым
и, распадаясь, выделяет некоторое
количество раствора
α–состава,
отвечающего линии GM
(точка Q).
В сплавах 2
и 3
после окончания перитектической реакции
полностью исчезает жидкая фаза и ниже
температуры ТP
остаются в равновесии два твердых
раствора
и ,
составы которых по мере снижения
температуры изменяются в соответствии
с ходом линий GM,
FN.
Примером системы с перитектикой может
служить Cd–Hg.
Четвертый тип диаграмм.
Компоненты А и В образуют прочные химические соединения, устой-чивые вплоть до температуры плавления.
Диаграмма состояния системы, где компоненты образуют одно хими-ческое соединение АтВп, представлена на рис. 4.1.8.
Точка С соответствует составу химического соединения АтВп постоянного состава. Избыток любого из компонентов (А или В) понижает температуру плавления соединения. Именно поэтому температура его плавления является наиболее высокой, что отражает наличие максимума на линии ликвидус. Если сделать разрез по линии С – АтВп, то диаграмму можно рассматривать как сочетание двух диаграмм первого типа для систем А – АтВп и АтВп – В, в которых полностью отсутствует растворимость в твердом состоянии.
Т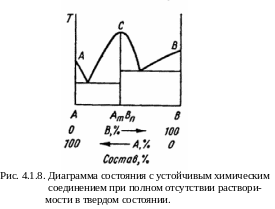 аким
образом, с двух сторон от линии С – АтВп
имеются две различные системы, переход
между которыми совершается скачком.
Точки, соответствующие подобным скачкам
или изломам на кривых состав – свойство,
в данном случае состав – температура
плавления, указывающие на образование
химического соединения, называются
сингулярными.
аким
образом, с двух сторон от линии С – АтВп
имеются две различные системы, переход
между которыми совершается скачком.
Точки, соответствующие подобным скачкам
или изломам на кривых состав – свойство,
в данном случае состав – температура
плавления, указывающие на образование
химического соединения, называются
сингулярными.
С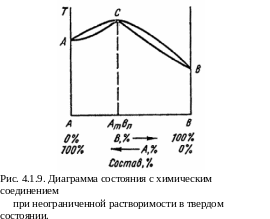 оединения,
в которых отношение между количествами
компонентов выражается целыми числами
(рис. 4.1.8), называются стехиометрическими
или дальтонидами,
так как они удовлетворяют закону кратных
отношений, открытому Дальтоном.
оединения,
в которых отношение между количествами
компонентов выражается целыми числами
(рис. 4.1.8), называются стехиометрическими
или дальтонидами,
так как они удовлетворяют закону кратных
отношений, открытому Дальтоном.
На рис. 4.1.9 представлена диаграмма системы, в которой химическое соединение и образующие его компоненты неограниченно взаимно раство-римы в твердом состоянии. При ограниченной взаимной растворимости химического соединения АтВп и компонентов А и В диаграмма имеет вид, представленный на рис. 4.1.10. Ее можно рассматривать как сочетание двух диаграмм, изображенных на рис. 4.1.6.
В зависимости от устойчивости и температуры степень диссоциации химических соединений изменяется. Соответственно изменяется и вид кривой ликвидус. Для прочных соединений максимум более острый, а для менее устойчивых т- более пологий.
О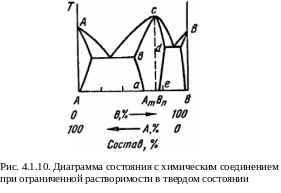 становимся
несколько подробнее на рис. 4.1.10. Из
него (видно, что химическое соединение,
образованное компонентами А
и В,
может содержать их в отношениях, несколько
отличающихся от соответствующих АтВn,
т.е. на диаграмме имеется более или менее
обширная область существования однородной
фазы на основе этого соединения,
ограниченная кривыми ab,
bC,
Cd
и de – так
называемая область гомогенности. Слева
от вертикальной штриховой линии на рис.
4.1.10. в химическом соединении имеется
дефицит атомов В,
а справа – атомов А.
Такие соединения были названы Н.С.
Курнаковым бертоллидами в честь
французского химика Бертолле, который
считал, что все химические соединения
могут иметь переменный состав. Эта точка
зрения в течение более ста лет считалась
неправильной. Победила противоположная
концепция одного из основателей
современной химии – Дальтона. Он
был убежден в том, что в природе могут
существовать только соединения
постоянного состава, подчиняющиеся
закону кратных отно-шений, в которых
отношение между количествами атомов
постоянно и выражается целыми числами.
Такие соединения получили название
дальтонидов.
становимся
несколько подробнее на рис. 4.1.10. Из
него (видно, что химическое соединение,
образованное компонентами А
и В,
может содержать их в отношениях, несколько
отличающихся от соответствующих АтВn,
т.е. на диаграмме имеется более или менее
обширная область существования однородной
фазы на основе этого соединения,
ограниченная кривыми ab,
bC,
Cd
и de – так
называемая область гомогенности. Слева
от вертикальной штриховой линии на рис.
4.1.10. в химическом соединении имеется
дефицит атомов В,
а справа – атомов А.
Такие соединения были названы Н.С.
Курнаковым бертоллидами в честь
французского химика Бертолле, который
считал, что все химические соединения
могут иметь переменный состав. Эта точка
зрения в течение более ста лет считалась
неправильной. Победила противоположная
концепция одного из основателей
современной химии – Дальтона. Он
был убежден в том, что в природе могут
существовать только соединения
постоянного состава, подчиняющиеся
закону кратных отно-шений, в которых
отношение между количествами атомов
постоянно и выражается целыми числами.
Такие соединения получили название
дальтонидов.
На основании изучения диаграмм состояния многих систем, главным образом металлических, Н.С. Курнаков первый показал, что могут существовать соединения обоих типов. Открытие бертоллидов обогатило науку и расширило представления о природе химических соединений и кристаллического состояния тел. В настоящее время бертоллиды приобрели большое практическое значение.
Пятый тип диаграмм.
К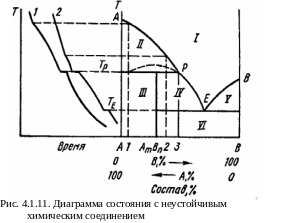 омпоненты
А
и В
образуют непрочное соединение,
разлагающееся ниже температуры плавления.
Этот тип диаграммы со скрытым максимумом
изображен на рис. 4.1.11.
омпоненты
А
и В
образуют непрочное соединение,
разлагающееся ниже температуры плавления.
Этот тип диаграммы со скрытым максимумом
изображен на рис. 4.1.11.
Из-за неустойчивости химического соединения при высоких темпе-ратурах оно не может выделяться при охлаждении расплавов, имеющих составы от чистого А до состава 3. Поэтому в указанной области температур и составов кристаллизуется только чистый компонент А. Химическое соединение становится устойчивым лишь при понижении температуры до Тр. При этом происходит перитектическая реакция.
Aт + расплав состава 3 ←→ AmBnт.
Это равновесие является нонвариантным, так как здесь присутствуют три фазы. Постоянство температуры поддерживается вследствие выделения тепла при образовании химического соединения. В сплаве состава 1 с избытком А против АтBn в результате реакции исчезает жидкая фаза и при дальнейшем охлаждении ниже Тp в области III остается смесь двух твердых фаз А и АтВn.
В сплаве 2 (с недостатком А) в результате реакции полностью исчезают кристаллы А, и оставшаяся жидкость при дальнейшем охлаждении выделяет кристаллы АтВn, изменяя свой состав по кривой ликвидус РЕ. При температуре ТЕ происходит эвтектическая кристаллизация АтВn и В.
На рис. 4.1.11 поле I – однородная жидкость; II – двухфазное рав-новесие между кристаллами А и жидкостью; IV – двухфазное равновесие между кристаллами АтВп и жидкостью; V – двухфазное равновесие между кристаллами В и жидкостью; VI – механическая смесь кристаллов АтВп и В.
Шестой тип диаграмм.
К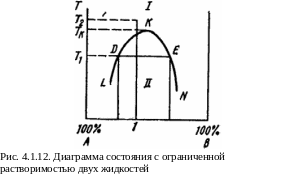 омпоненты
A
и B
не полностью смешиваются в жидком
состоянии. Ограниченная растворимость
в жидком состоянии наблюдается в
некоторых системах, представляющих
интерес для металлургии, например,
состоящих из двух металлов (Pb–Zn, Fe–Cu),
из металла и оксида (Fe–FeO, Cu–Cu2O),
из металла и сульфида (Cu–Cu2S),
силиката и сульфида и т.д. Диаграмма
равновесия для подобных систем
представлена на рис. 4.1.12.
омпоненты
A
и B
не полностью смешиваются в жидком
состоянии. Ограниченная растворимость
в жидком состоянии наблюдается в
некоторых системах, представляющих
интерес для металлургии, например,
состоящих из двух металлов (Pb–Zn, Fe–Cu),
из металла и оксида (Fe–FeO, Cu–Cu2O),
из металла и сульфида (Cu–Cu2S),
силиката и сульфида и т.д. Диаграмма
равновесия для подобных систем
представлена на рис. 4.1.12.
В поле I существует однородный жидкий раствор, в поле II сосу-ществуют два сопряженных насыщенных жидких раствора разного состава, образующих несмешивающиеся друг с другом слои. Так, при температуре T1 в равновесии находятся раствор В в А состава, отвечающего точке D, и раствор A в B состава, отвечающего точке Е. Если однородный раствор состава 1, например, при температуре Т2 охладить до Т1, то он распадается на две жидкие фазы.
Обычно при повышении температуры взаимная растворимость жидкостей увеличивается, и поэтому оба насыщенных раствора, составы которых изменяются по отрезкам кривой LK, и KN, становятся все более близкими. Наконец, при температуре Тк и при составе точки К различие между ними исчезает, и выше этой точки, называемой критической температурой растворения, может существовать лишь одна жидкая фаза.
Следует, однако, отметить, что в некоторых системах наблюдается увеличение взаимной растворимости при понижении температуры.
Несмешиваемость или расслоение имеет место не только в жидких, но и в твердых растворах. Это явление имеет большое значение для понимания процессов термической обработки металлов. Например, некоторые однород-ные твердые растворы, однородные при высоких температурах, претер-певают распад на два других твердых раствора при охлаждении, что вызывает изменения свойств сплавов.
К использованному в этой теме понятию твердых растворов можно смело отнести определение раствора вообще. Раствором называется однородная смесь, состоящая из двух или большего числа ве-ществ(элементов), состав которой в известных пределах может непре-рывно изменяться.
Однородными являются и химические соединения, однако их состав не может изменяться непрерывно, так как они подчиняются законам посто-янства состава и кратных отношений.
Современная термодинамика трактует способность соединений образовывать твердые растворы с общих позиций минимума свободной энергии. Судьба минерала (объемного кристалла, тонкой пленки или квантовой точки) определяется тем, выгодно ли энергетически его сущест-вование в виде чистых соединений, или же, напротив, выигрыш в свободной энергии обеспечивается его нахождением в форме твердого раствора.
Конкретный выбор зависит от конкуренции двух основных факторов противоположной направленности:
затраты энергии на деформацию кристаллической структуры при нарушении ее идеальности в результате появления в регулярных пози-циях структуры атомов иного размера (безразлично - более крупных или более мелких) и/или иного заряда (валентности);
выигрыша энергии за счет роста конфигурационной энтропии при увеличении беспорядка в системе.
Конфигурационная энтропия связана с числом вариантов случайного размещения некоторой определенной доли "своих" и "чужих" атомов в одних и тех же позициях кристаллической структуры. Чем больше число таких вариантов, тем больше значение конфигурационной энтропии Sk . Она может быть рассчитана по известной формуле Больцмана (статистическое истолкование второго начала термодинамики) Sk = k ln W, где k – константа Больцмана, W – термодинамическая вероятность состояния системы. Для твердых растворов W – это просто число перестановок местами атомов разных сортов в заданных позициях структуры; W = 1 для чистого кристалла и всегда больше единицы для смешанного. Ясно, что число таких переста-новок зависит от состава системы, в частности от числа разных типов атомов (два, три или более), причем увеличение числа компонентов ведет к росту значений конфигурационной энтропии. Существенно, что даже появление небольшой доли примеси ведет сразу к большому росту энтропии смешения. Поэтому так трудно получить или найти в природе истинно чистые вещества.
В результате того, что силы деформации (отталкивания молекул) в газовой фазе малы, газы различного типа смешиваются под влиянием роста конфигурационной энтропии в любых пропорциях. Жидкости, которые не имеют собственной формы (они текучи), смешиваются часто также неограниченно, если они одной полярности. Для твердых тел, и особенно кристаллов, которые стремятся сохранить строгую трехмерную периодич-ность, образование смесей или растворов сопряжено с гораздо большими затруднениями.
Н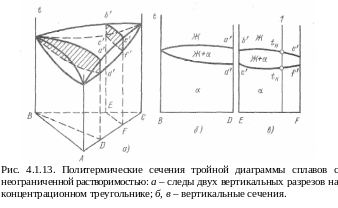 а
практике существует огромное многообразие
сложных диаграмм состояния, которые
можно проанализировать, опираясь на
приведенные в этой теме примеры. Так
общий вид тройных диаграмм состояния
(для системы из трех компонентов)
определяется характером двойных систем,
образующих их боковые грани. Превращения
в тройных сплавах удобнее наблюдать не
по пространственной диаграмме, а по
сечениям (разрезам этих диаграмм) (рис.
4.1.13).
а
практике существует огромное многообразие
сложных диаграмм состояния, которые
можно проанализировать, опираясь на
приведенные в этой теме примеры. Так
общий вид тройных диаграмм состояния
(для системы из трех компонентов)
определяется характером двойных систем,
образующих их боковые грани. Превращения
в тройных сплавах удобнее наблюдать не
по пространственной диаграмме, а по
сечениям (разрезам этих диаграмм) (рис.
4.1.13).
Вопросы для повторения.
Что такое диаграммы состояния ?
Построение диаграмм состояния по кривым охлаждения.
Объяснить диаграмму для веществ А и В неограниченно растворимых друг в друге в жидком состоянии и нерастворимых в твердом.
Нарисовать диаграмму сплошных твердых растворов между компонентами А и В.
Точки эвтектики и перитектики на диаграммах с твердыми растворами. Объяснить их образование.
Привести пример диаграммы с устойчивым химическим соединением.
Приведите пример диаграммы с неустойчивым химическим соединением.
Нарисуйте как выглядит диаграмма состояния с ограниченной растворимостью двух жидкостей.
Как трактует современная термодинамика способность соединений образовывать твердые растворы ?
Резюме по теме
В процессе изучения данной темы студенты получили навыки чтения диаграмм состояния (состав – температура) и ознакомились с принципами их построения.
Литература
1. А.А. Барыбин Электроника и микроэлектроника, физико-технологические основы, М., Физматлит, 2006, с.423.
2. Б.Ф.Ормонт Введение в физическую химию и кристаллохимию полупроводников, М., Высшая школа, 1982, с.528.
