
- •Фізичні властивості альдегідів.
- •Хімічні властивості альдегідів.
- •35) Застосування карбонових кислот.
- •36) Добування карбонових кислот.
- •40) Хімічні властивості
- •41) Жири — органічні речовини, які є сполукою складних ефірів трьохатомного спирту (гліцерину) і жирних кислот.
- •У промисловості
- •Застосування складних ефірів
4) Ізомерія — це явище, при якому речовини однакового складу мають різну просторову будову і, відповідно, властивості. Ізомери мають однаковий склад, але різну будову.
5)Основні положення теорії хімічної будови органічних сполук:
• у хімічних сполуках атоми зєднуються між собою у перному порядку відповідно до їх валентності, що визначає хімічну будову молекул;
• хімічні і фізичні властивості огранічних сполук залежать як від природи і кількості атомів, що входять до їх складу, так і від хімічної будови молекул;
• для кожної емпіричної формули можна вивести певну кількість теоретично можливих структур (ізомерів);
• кожна органічна речовина має лише одну формулу хімічної будови, яка дає уявлення про властивості даної сполуки;
• у молекулах існує взаємний вплив атомів як бепосередно звязаних, так і безпосередньо не звязаних один з одним.
Теорія О.М.Бутлерова має фундаментальне значення для розвитку хімії, оскільки визначає основні особливості хімічної будови молекул.
На основі терії О.М.Бутлерова розроблено сучасну номенклатуру і класифікацію органічних сполук.
6) Ненасиченими називаються вуглеводні, що мають хоча б один подвійний або потрійний (кратний) .
Фізичні властивості етилену й ацетилену. Гази без кольору й запаху, мало розчинні у воді, трохи легші за повітря.
8) Застосування етилену й ацетилену. Ненасичені вуглеводні використовують для синтезу багатьох органічних речовин. Етилен використовують для одержання етилового спирту, поліетилену. Він прискорює дозрівання плодів.
10) Застосування етилену й ацетилену. Ненасичені вуглеводні використовують для синтезу багатьох органічних речовин. Ацетилен використовують для автогенного зварювання металів.
12) Полімеризація — це послідовне з’єднання молекул низькомолекулярної речовини з утворенням високомолекулярної речовини. Продукт полімеризації називається полімером, а вихідна речовина, що вступає в реакцію, — мономером; повторювані в полімері угруповання називаються структурними або елементарними ланками; число елементарних ланок у макромолекулі називається ступенем полімеризації. Назва полімеру складається з назви мономера і префікса полі-, наприклад поліетилен, полівінілхлорид, полістирол.
14) Сьогодні можна говоритити щонайменше про чотири основні напрямки використання полімерних матеріалів у сільському господарстві. І у вітчизняній і у світовій практиці перше місце належить плівкам. Завдяки застосуванню мульчируючої перфорованої плівки на полях врожайність деяких культур підвищується до 30%, а терміни дозрівання прискорюються на 10-14 днів. Два інших головних напрямки використання полімерних матеріалів у сільському господарстві - будівництво, особливо тваринницьких приміщень, і машинобудування.
16)
Хімічні
властивості бензену. Бензен не знебарвлює
розчини бромної води і калій перманганату,
з ним легше йдуть реакції заміщення,
ніж приєднання, для здійснення яких
потрібен розрив зв’язків усього
бензенового кільця.
1)
Окиснення (горіння). Горить полум’ям,
яке сильно коптить:
 2)
Реакції заміщення.
Взаємодія
з галогенами подібно до алканів:
2)
Реакції заміщення.
Взаємодія
з галогенами подібно до алканів:
 Взаємодія
з нітратною кислотою. Бензен тут реагує
з нітруючою сумішшю — сумішшю
концентрованих нітратної і сульфатної
кислот:
Взаємодія
з нітратною кислотою. Бензен тут реагує
з нітруючою сумішшю — сумішшю
концентрованих нітратної і сульфатної
кислот:
 3)
Реакції приєднання, що йдуть із розривом
зв’язків.
—
Взаємодія з воднем:
3)
Реакції приєднання, що йдуть із розривом
зв’язків.
—
Взаємодія з воднем:
 —
Взаємодія з хлором. Реакція відбувається
при взаємодії парів бензену з хлором
тільки під впливом твердого
ультрафіолетового
випромінювання:
—
Взаємодія з хлором. Реакція відбувається
при взаємодії парів бензену з хлором
тільки під впливом твердого
ультрафіолетового
випромінювання:
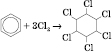 або
або ![]() Утворюється
твердий гексахлорциклогексан
(гексахлоран)
Утворюється
твердий гексахлорциклогексан
(гексахлоран) ![]() .
.
17. Бензол є дуже важливою сировиною для хімічної промисловості. Великі кількості його йдуть для одержання нітробензолу.Значні кількості бензолу використовують для синтезу фенолу, який йде на виробництво фенолформальдегідних смол. Гексахлорциклогексан, який одержують з бензолу (реакція наведена вище), під назвою гексахлоран застосовується в сільському господарстві як один з найбільш ефективних засобів для знищення комах. Крім того, бензол використовують для синтезу багатьох інших органічних сполук і як розчинник. Застосування бензену. Хімічна сировина для виробництва ліків, пластмас, барвників, отрутохімікатів і багатьох інших органічних речовин. Часто застосовується як розчинник. Додавання бензену поліпшує якість моторного пального.
19. 1. Вуглеводні зустрічаються в природі у вигляді переважно природного газу, нафти, кам’яного вугілля. Є 2 способи використання цих горючих копалин:
а) у вигляді палива – як джерело енергії,
б) у вигляді сировини для подальшої переробки – органічний синтез.
З вуглеводнів, виділених з нафти, природний газ і вугілля, можна добути багато різних речовин, а з них виробити ще більше корисних матеріалів.
Природний газ, нафта, вугілля належать до не відновлюваних природних ресурсів. Тому розвідують нові родовища, експлуатують уже відкриті так, щоб максимально вилучити з них копалини і раціонально використовувати їх.
Зрозуміло, що доцільніше хімічно переробляти природні джерела вуглеводів, ніж палити в котельнях, двигунах, промислових печах і т.д.
2.Є різні погляди на походження горючих копалин.
А) прихильники теорії органічного походження вважають, що поклади утворюються із решток вимерлих рослин і тварин, що перетворились на суміші вуглеводів у товщі Землі підприємство дією бактерій, високих тисків і t°.
Б) За теорією мінерального (вулканічного) походження горючих копалин, на первісній стадії формування планети Земля метали сполучались з вуглецем, утворюючи карбіди. У результаті реакції карбідів з водою (водною парою) у глибинах утворюють газуваті вуглеводні (метан, ацетилен), підприємство впливом t°, радіації, каталізаторів з них утворююся інші сполуки, що містяться у нафті. У верхніх шарах літосфери рідкі нафтові компоненти випаровувались, рідина загусала, перетворювалась на асфальт і далі на вугілля.
Цю історію вперше висловив Д. Менделєєв. А на початку ХХ ст.. фр. Вч. П. Сабатьє змоделював описаний процес у лабораторії і добув суміш вуглеводнів, подібну до нафти.
20. Вуглеводнева сировина використовується : в побуті, транспорті, промисловості. При цьому утворюється : діоксиду карбону СО2, який утворює парниковий ефект. Це може призвести до підвищення температури ,та у зв’язку з цим і зміни клімату.
За останні роки вміст вуглекислого газу в атмосфері зростає. Крім вуглекислого газу атмосфера забруднюється шкідливими речовинами: СО оксид карбону (ІІ), оксид сульфуру SО2(ІV), утворюється тому , що в бензині та вугіллі є сірка, метан СН4 сірководень Н2S, оксиди нітрогену NO і NO2.
Щоб позбутися шкідливих викидів потрібно :
А) ощадливо використовувати паливо,
Б) вилучати з палива сірку
В)створювати умови повного згоряння палива за допомогою фільтрів,
Г)використовувати альтернативні джерела вуглеводнів
21)
У
насичених одноатомних спиртів усі
карбонові зв’язки ординарні і лише
один атом Гідрогену заміщений
гідроксигрупою. Назви спиртів утворюються
від назв відповідних вуглеводнів з
додаванням суфікса -ол(наприклад
етанол). Існують також тривіальні назви
(наприклад етиловий спирт).
Загальна
формула насичених одноатомних
спиртів: ![]()
![]() ,
де R — вуглеводневий радикал, або
,
де R — вуглеводневий радикал, або ![]() .
.
Фізичні
властивості спиртів. Спирти з числом
атомів Карбону до 15 — рідини, інші —
тверді речовини. Метанол і етанол —
безбарвні рідини, з характерним запахом,
добре розчинні у воді. Температура
плавлення метанолу — ![]() ,
етанолу —
,
етанолу — ![]() .
Температура кипіння метанолу —
.
Температура кипіння метанолу — ![]() ,
етанолу —
,
етанолу — ![]() .
Біологічна
дія спиртів.
Метанол —
дуже сильна отрута, якщо потрапляє в
організм у малих дозах (5—10 мл), викликає
сліпоту, у великих (30 мл) — смерть.
Етанол —
наркотична речовина, у невеликих дозах
викликає сп’яніння, у великих — смерть.
При постійному вживанні етанолу
розвивається захворювання — алкоголізм.
.
Біологічна
дія спиртів.
Метанол —
дуже сильна отрута, якщо потрапляє в
організм у малих дозах (5—10 мл), викликає
сліпоту, у великих (30 мл) — смерть.
Етанол —
наркотична речовина, у невеликих дозах
викликає сп’яніння, у великих — смерть.
При постійному вживанні етанолу
розвивається захворювання — алкоголізм.
22. У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса -ол(наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт). Загальна формула насичених одноатомних спиртів: , де R — вуглеводневий радикал, або .
Реакція горіння |
С2Н5ОН + 3О2→ 2СО2 +3Н2О +1374кДж. – С→ О ← Н зв'язок поляризований, тому присутня деяка кислотність
|
Взаємодія з активними металами |
С2Н5ОН +2 Na → 2С2Н5ОNa + Н2 (етилат натрію)
|
Реакція етерифікації з органічними кислотами |
СН3СООН + НО- СН3 → (кат. Н2SO4)СН3 – СОО-СН3 +Н2О (естер оцтово метиловий) |
Реакція етерифікації з мінеральними кислотами |
СН3ОН + НО-SО2-ОН↔СН3- SО2-ОН +Н2О(метиловий естер сульфатної кислоти) |
Взаємодія із галоген оводнями |
С2Н5ОН + НСІ → С2Н5СІ +Н2О (хлор етан)
|
Окиснення СuО, КМпО4 Первинних спиртів до альдегідів Вторинних до кетонів Третинних - важко окислюються |
СН3 – СН2 –ОН +СuО → СН3 – СОН + Си + Н2О етаналь СН3 – СНОН – СН3 + О → СН3- СО- СН3 + Н2О ацетон(пропанон – 2)
|
Дегідратація (тем, . Н2SO4 ,АІ2О3) Внутрішньо молекулярна Міжмолекулярна дегідратація |
За правилом Зайцева (гідроген відщеплюється від більш гідрогенізованого карбону) С2Н5ОН → ≥140С СН2=СН2 +Н2О етен С2Н5ОН + НО- Н5С2 → ≤140С С2Н5-О- С2Н5 +Н2О(діетиловий етер)
|
Дегідратація та дегідрування |
2С2Н5ОН→ СН2 = СН- СН = СН2 +2Н2О+Н2↑ бутадієн – 1, 3
|
23. Застосування. На багатьох виробництвах спирти застосовуються як розчинники. У хімічній промисловості вони використовуються для різних синтезів. Метиловий спирт у великих кількостях йде на одержання формальдегіду, використовуваного у виробництві пластмас оцтової кислоти та інших органічних речовин. В даний час розробляється багато нових технологічних процесів на основі використання метилового спирту як вихідного продукту, тому значення його в промисловому виробництві потрібних народному господарству, речовин і матеріалів буде усе більш зростати. Перспективним вважається використання метилового спирту як моторного палива тому добавка його до бензину підвищує актановое кількість горючої суміші і знижує утворення шкідливих речовин у вихлопних газах. Етиловий спирт у великих кількостях йде на виробництво синтетичного каучуку. Окисленням спирту одержують харчову оцтової кислоти. Шляхом його дігідратаціі готують діетіловий (медичний) ефір, із взаємодією з хлороводень отримують хлоретан, для місцевої анестозіі. Спирт застосовується при виготовленні багатьох ліків. У парфумерії він йде на виготовлення парфумів і адеколонов.
24.
Багатоатомними називаються
спирти, у молекулах яких два або більше
атомів Гідрогену заміщені на
гідроксигрупи.
Якщо
в молекулі спирту містяться три
гідроксигрупи, він належить
до триатомних спиртів.
У назві такого багатоатомного спирту
присутній суфікс -тріол.
Загальна
формула триатомних спиртів ![]() .
Наприклад, формула пропантріолу-1,2,3
(гліцерину):
.
Наприклад, формула пропантріолу-1,2,3
(гліцерину):
![]()
Фізичні
властивості гліцерину. Безбарвна,
в’язка, гігроскопічна рідина, солодка
на смак. Змішується з водою в будь-яких
співвідношеннях. Температура плавлення
— ![]() ,
кипіння —
,
кипіння — ![]() .
.
25. Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи. Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол. Загальна формула триатомних спиртів . Наприклад, формула пропантріолу-1,2,3 (гліцерину):
Хімічні
властивості багатоатомних спиртів (на
прикладі гліцерину).
1)
Горіння:
![]() Утворюються
вуглекислий газ і вода (за достатньої
кількості кисню).
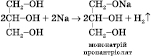
2)
Взаємодія з активними металами (може
відбуватися ступінчасто):
Утворюються
вуглекислий газ і вода (за достатньої
кількості кисню).
2)
Взаємодія з активними металами (може
відбуватися ступінчасто):

 3)
Взаємодія з галогеноводнями (може
відбуватися ступінчасто):
3)
Взаємодія з галогеноводнями (може
відбуватися ступінчасто):
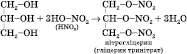
![]() 4)
Нітрування (нітруюча суміш — суміш
концентрованих нітратної і сульфатної
кислот):
4)
Нітрування (нітруюча суміш — суміш
концентрованих нітратної і сульфатної
кислот):
26)
Феноли —
це органічні сполуки, у молекулах яких
гідроксильні групи зв’язані з бензеновим
ядром.
Феноли
з однією гідроксигрупою
називаються одноатомними.
Найпростіший фенол має загальну
формулу ![]() .
Його структурна
формула:
.
Його структурна
формула:
![]() або
або ![]() Радикал
Радикал ![]() називається феніл.
У
молекулі фенолу відбувається взаємний
вплив гідроксигрупи і бензенового
ядра, в результаті якого атом Гідрогену
гідроксигрупи стає більш реакційноздатним,
а фенол виявляє властивості слабкої
кислоти (слабкішої за карбонатну).
Максимуми електронної густини в
бензеновому кільці знаходяться в
положеннях Карбону 2, 4, 6 відносно групи
-ОН, тому атоми Гідрогену в цих положеннях
легше вступають у реакції заміщення.
Фізичні
властивості фенолу. Безбарвна кристалічна
речовина з різким характерним запахом,
частково розчинна у воді (краще
розчиняється в гарячій воді). Температура
плавлення
називається феніл.
У
молекулі фенолу відбувається взаємний
вплив гідроксигрупи і бензенового
ядра, в результаті якого атом Гідрогену
гідроксигрупи стає більш реакційноздатним,
а фенол виявляє властивості слабкої
кислоти (слабкішої за карбонатну).
Максимуми електронної густини в
бензеновому кільці знаходяться в
положеннях Карбону 2, 4, 6 відносно групи
-ОН, тому атоми Гідрогену в цих положеннях
легше вступають у реакції заміщення.
Фізичні
властивості фенолу. Безбарвна кристалічна
речовина з різким характерним запахом,
частково розчинна у воді (краще
розчиняється в гарячій воді). Температура
плавлення ![]() ,
кипіння
,
кипіння ![]() .
Під час зберігання поступово набуває
рожевого забарвлення (окиснюється
киснем повітря). Розчин фенолу у воді
називається ще карболовою
кислотою.
.
Під час зберігання поступово набуває
рожевого забарвлення (окиснюється
киснем повітря). Розчин фенолу у воді
називається ще карболовою
кислотою.
27. Феноли — це органічні сполуки, у молекулах яких гідроксильні групи зв’язані з бензеновим ядром. Феноли з однією гідроксигрупою називаються одноатомними. Найпростіший фенол має загальну формулу . Його структурна формула: або Радикал називається феніл. У молекулі фенолу відбувається взаємний вплив гідроксигрупи і бензенового ядра, в результаті якого атом Гідрогену гідроксигрупи стає більш реакційноздатним, а фенол виявляє властивості слабкої кислоти (слабкішої за карбонатну). Максимуми електронної густини в бензеновому кільці знаходяться в положеннях Карбону 2, 4, 6 відносно групи -ОН, тому атоми Гідрогену в цих положеннях легше вступають у реакції заміщення.
|
|
28. Застосування фенолу. Фенол застосовується як антисептик, дезінфікуючий засіб, використовується у виробництві пластмас (фенопластів), лікарських речовин, барвників, синтетичних волокон, вибухових речовин.
Хімічні властивості фенолу.
Хімічні
реакції за участю гідроксигрупи.
1)
Взаємодія з активними металами:
 У
результаті реакції утворюються феноляти
(у даному випадку натрій фенолят).
2)
Взаємодія з лугами:
У
результаті реакції утворюються феноляти
(у даному випадку натрій фенолят).
2)
Взаємодія з лугами:
 Хімічні
реакції за участю бензенового ядра.
3)
Взаємодія з бромом (без нагрівання і
каталізаторів):
Хімічні
реакції за участю бензенового ядра.
3)
Взаємодія з бромом (без нагрівання і
каталізаторів):
 2,4,6-Трибромфенол
— осад білого кольору. Ця
реакція є якісною для визначення
фенолу.
4)
Також якісною
реакцією на фенол є
взаємодія з розчином феруму(III), у
результаті якої утворюється сполука
фіолетового кольору.
5)
Взаємодія з нітратною
кислотою:
2,4,6-Трибромфенол
— осад білого кольору. Ця
реакція є якісною для визначення
фенолу.
4)
Також якісною
реакцією на фенол є
взаємодія з розчином феруму(III), у
результаті якої утворюється сполука
фіолетового кольору.
5)
Взаємодія з нітратною
кислотою:
 2,4,6-тринітрофенол
(пікринова кислота)
2,4,6-тринітрофенол
(пікринова кислота)
29.
Елементи порівняння |
Етанол С2Н5ОН |
Фенол С6Н5ОН
|
Функціональна група |
– О- ← Н+ атом гідрогену рухливий |
С6Н5 – О- ← Н+ атом Н більш рухливий, погано |
Фізичні властивості |
добре розчиняється воді |
Погано розчиняється у воді |
Хімічні властивості 1)реакція із активними металами |
2С2Н5ОН +Nа→2С2Н5ОNа+Н2↑ |
С6Н5ОН +Nа→ С6Н5ОNа +Н2↑ |
2)реакція із лугами |
Не характерна , але можлива при температурі 120С, тиску |
Проявляє кислотні властивості (карболова кислота), слабкіша за Н2СО3 С6Н5ОН + NаОН →С6Н5ОNа+Н2О |
3) заміщення групи ОН |
С2Н5ОН + НВч → С2Н5Вч +НВч |
Не характерна |
4)утворення естерів |
СН3СООН + НОН5С2 → СН3СОО- С2Н5 + Н2О |
- |
5)заміщення в радикалі |
С2Н5ОН +СІ2 →СН3- СНСІ-ОН +НСІ |
|
Подібність між етанолом і фенолом |
Вступають в реакції заміщення |
В етанолі можливе заміщення гідроксогрупи, а у фенолу це неможливо
|
Якісна реакція |
Етанол горить голубим полум’ям |
Вступає в реакцію з хлоридом заліза (ІІІ) FеСІ3 утворюючи фіолетове забарвлення |
Шкідлива дія |
Наркотична речовина, спричиняє хворобу алкоголізм |
Отруйна речовина, згубно діє на флору та фауну, у людини викликає опіки та отруєння |
30)
Альдегідами називаються
органічні сполуки, у молекулах яких
міститься альдегідна функціональна
група: –![]() Назви
альдегідів за міжнародною номенклатурою
утворюються від назв відповідних
вуглеводнів із додаванням суфікса
-аль.
Тривіальні назви утворюються від назв
кислот, які можуть бути одержані з цих
альдегідів.
Назви
альдегідів за міжнародною номенклатурою
утворюються від назв відповідних
вуглеводнів із додаванням суфікса
-аль.
Тривіальні назви утворюються від назв
кислот, які можуть бути одержані з цих
альдегідів.
Фізичні властивості альдегідів.
Формальдегід —
безбарвний газ із різким задушливим
запахом. Добре розчиняється у воді.
Температура кипіння![]() .
Водний 40%-й розчин формальдегіду
називається формаліном.
Ацетальдегід —
безбарвна легколетка рідина з різким
запахом, добре розчинна у воді. Температура
кипіння
.
Водний 40%-й розчин формальдегіду
називається формаліном.
Ацетальдегід —
безбарвна легколетка рідина з різким
запахом, добре розчинна у воді. Температура
кипіння ![]() .
.
Хімічні властивості альдегідів.
Реакції
окиснення.
1)
Повне окиснення — горіння:
![]() 2)
Часткове окиснення — купрум(II)
гідроксидом до кислоти (у даному випадку
— оцтової):
2)
Часткове окиснення — купрум(II)
гідроксидом до кислоти (у даному випадку
— оцтової):
 Це якісна
реакція для визначення альдегідів.
3)
Окиснення амоніачним розчином аргентум
оксиду — «реакція
срібного дзеркала»:
Це якісна
реакція для визначення альдегідів.
3)
Окиснення амоніачним розчином аргентум
оксиду — «реакція
срібного дзеркала»:
![]() Ця
реакція також є якісною для визначення
альдегідів.
Реакції
приєднання проходять
за рахунок розриву подвійного зв’язку
в альдегідній групі.
4)
Приєднання водню (відновлення альдегідів
до спиртів):
Ця
реакція також є якісною для визначення
альдегідів.
Реакції
приєднання проходять
за рахунок розриву подвійного зв’язку
в альдегідній групі.
4)
Приєднання водню (відновлення альдегідів
до спиртів):
![]()
31) Альдегіди – клас органічних сполук, у яких карбонільна група СО звязна з атомом та органічним радикалом.Застосування: Реакції окиснення зумовлюють застосування для добування оцтової кислоти. У невеликих кількостях оцтовий альдегід утворюється під час обміну речовин в організмі людини, зокрема в результаті метаболізму алкоголю. Надлишок ацетальдегіду шкідливий і викликає неприємні відчуття, що використовується з метою лікування метаболізму
32) Карбонові кислоти – органічні сполуки, що містять одну або декілька карбоксильних груп СООН. За кількістю цих груп розрізняють одноосновні (бензойна, оцтова кислота), двоосновні (щавлева, фталева) та багатоосновні (лимонна)
У молекулах карбонових кислот, як і в молекулах спиртів, містяться гідроксильні групи, унаслідок чого кислоти виявляють деяку схожість із спиртами.
33) За фізичними властивостями карбонові кислоти є рідинами або твердими речовинами. Низькомолекулярні карбонові кислоти добре розчинні у воді. Кислоти розчинні в розчинах лугів з утворенням солей.
34) Хімічні властивості карбонових кислот обумовлені наявністю в молекулі карбоксильної групи. В розчинах вони дисоціюють на іони: Це, як правило слабкі кислоти Kg у них нижче ніж у мінеральних кислотах. 1. Взаємодіють з солями важких металів в нейтральному середовищі з утворенням забарвлених сполук. 2. З спиртом утворюють складні ефіри, які мають характерний запах – реакція етерифікації. Зворотній процес – реакція гідролізу (окислення).
35) Застосування карбонових кислот.
Мурашина кислота застосовується як протрава для фарбування шерсті, консервант фруктових соків і силосу, використовується для дезінфекції місткостей у харчовій промисловості, у хімічних синтезах. Оцтова кислота застосовується для добування пластмас, барвників, ліків, штучних волокон, кіноплівки в хімічних синтезах. Вона використовується як приправа до їжі, для консервації овочів. Солі оцтової кислоти використовують для фарбування тканин, а також для боротьби зі шкідниками сільського господарства
36) Добування карбонових кислот.
Загальний
спосіб добування карбонових кислот —
окиснення альдегідів або спиртів із
гідроксигрупою біля першого атома
Карбону:

38) Похідні карбонових або мінеральних кислот, в яких атом водню в гідроксильній (ОН) групі заміщено на органічний радикал (R').
Назва естер походить від німецького слова Essig-Aether, етилацетат.
В українській мові вживалась в 30-ті роки минулого століття, та згодом була замінена на складний ефір.
За своєю будовою естери на перший погляд схожі з солями. Насправді ж схожість тут лише формальна. Зв’язок між вуглеводневим радикалом, тобто залишком, який виходить, якщо відняти від молекули вуглеводню один атом водню, і рештою частини молекули в естері ковалентний, а не іонний, як у солях.
Естери (складні етери), на відміну від більшості солей, нерозчинні у воді, але розчиняються в органічних розчинниках. Розчини їх не проводять електричного струму.
Реакція утворення естеру із спирту і кислоти є оборотною: пряма реакція називається естерифікацією, а зворотна – омиленням естеру.
39) Фізичні властивості естерів. Естери нижчих карбонових кислот і спиртів — леткі рідини, малорозчинні або нерозчинні у воді, добре розчинні у спирті та інших органічних розчинниках. Багато естерів мають приємний запах. Естери вищих кислот і спиртів — воскоподібні речовини, без запаху, нерозчинні у воді, добре розчинні в органічних розчинниках.

