
- •Часть III
- •Введение
- •Потенциометрическое титрование
- •Лабораторная работа № 1 определение содержания аскорбиновой кислоты методом окислительно-восстановительного титрования
- •Вопросы для контроля усвоения темы
- •Лабораторная работа № 2 определение содержания стрептоцида методом окислительно-восстановительного титрования
- •Вопросы для контроля усвоения темы
- •Вопросы для контроля усвоения темы
- •Определение концентрации хлорид-ионов в растворах
- •Определение концентрации ионов no3− в сельхозпродуктах
- •Вопросы для контроля усвоения темы
- •Кондуктометрия
- •Вопросы для контроля усвоения темы
- •Изучение абсорбционных спектров растворов бихромата калия и перманганата калия
- •Определение хрома и марганца при совместном присутствии
- •Вопросы для контроля усвоения темы
- •Фотометрическое титрование
- •Лабораторная работа № 8 определение содержания меди
- •Определение меди
- •Вопросы для контроля усвоения темы
- •Тонкослойная хроматография
- •Техника выполнения анализа методом тсх
- •Лабораторная работа № 9 разделение галогенидов методом одномерной восходящей тсх
- •Вопросы для контроля усвоения темы
- •Приложение 1 Правила работы на кондуктометре
- •Калибровка электродов.
- •Выбор режима
- •Ионометрические измерения.
- •Приложение 4 инструкция по работе на сф-26
- •Определение оптической плотности
- •Переключение фотоэлемента
- •Переключение лампы
- •Приложение 5 коэффициенты распределения стьюдента
- •Значения q для исключения сомнительных результатов
- •Содержание
Вопросы для контроля усвоения темы
Сущность метода ионометрии.
Что представляет собой метод последовательного разбавления?
Вид градуировочного графика при определении различных катионов и анионов с помощью ИСЭ.
Уравнение Нернста и его параметры для ИСЭ.
Что представляет собой электрохимическая ячейка в данном случае?
Строение и принцип действия электродов, используемых в данной работе.
Основные характеристики ИСЭ.
Расскажите ход Ваших действий при проведении данной работы.
Что такое БРОИС и зачем он нужен?
Приведите расчетные формулы, необходимые для вычисления содержания различных ионов.
Кондуктометрия
Кондуктометрический анализ основан на использовании зависимости между электропроводностью (электрической проводимостью) растворов электролитов и их концентрацией.
В кондуктометрических исследованиях основной экспериментальной величиной, получаемой при прямых измерениях, является сопротивление (R) раствора электролита. Величину, обратную сопротивлению, называют электрической проводимостью: L = 1 / R. Электрическая проводимость зависит от геометрических параметров ячейки:
![]() æ
æ![]() ,
,
где æ – удельная электрическая проводимость; S – площадь электродов; l – расстояние между двумя параллельными электродами. В СИ удельную электрическую проводимость выражают в Смм–1, допускается также использование дольной единицы Ом–1см–1.
Во многих случаях для сравнения различных электролитов с точки зрения их способности проводить электрический ток используют понятие эквивалентной электрической проводимости, которую находят из соотношения:
![]() æ
æ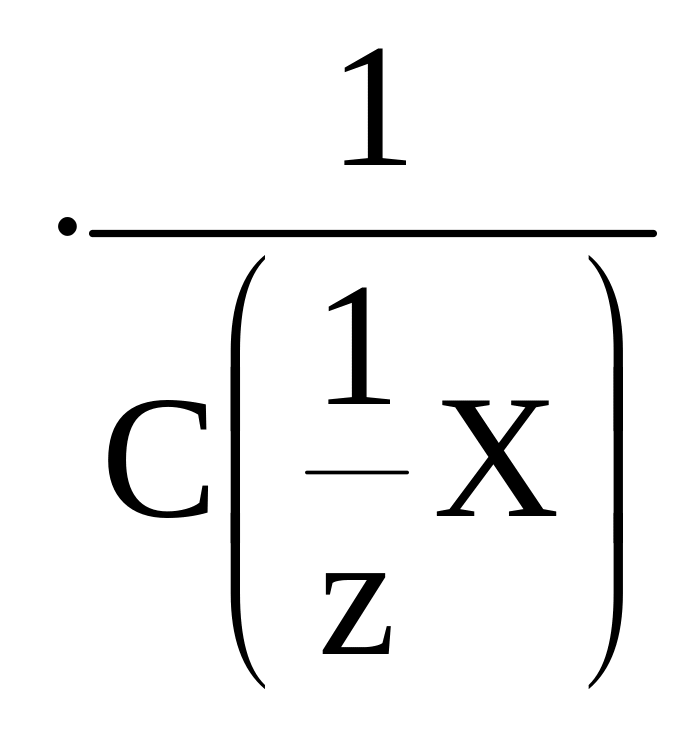 ,
,
где С (1/z X) – молярная концентрация эквивалента электролита. Эквивалентную электрическую проводимость выражают в Смм2моль–1, допускается также использование дольной единицы Ом–1см2моль–1.
В
соответствии с законом независимого
движения ионов Кольрауша эквивалентная
электропроводность раствора электролита
при бесконечном разбавлении
равна сумме предельных подвижностей
катиона
![]() и аниона
и аниона
![]() ,
т.е. их подвижностей при бесконечном
разбавлении раствора:
,
т.е. их подвижностей при бесконечном
разбавлении раствора:
= + .
Предельные подвижности ионов в данном растворителе и при заданной температуре являются константами и приводятся в справочниках.
Кондуктометрический метод широко применяют для определения концентрации электролитов в растворах. Применяют как прямую кондуктометрию, так и кондуктометрическое титрование.
КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
Лабораторная работа № 5
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СОЛЯНОЙ КИСЛОТЫ И ХЛОРИДА АММОНИЯ ПРИ СОВМЕСТНОМ ПРИСУТСТВИИ МЕТОДОМ КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
Цель изучения данной темы
Усвоить основы кондуктометрического титрования. Овладеть навыками работы с установкой, научиться строить кривые титрования и определять концентрацию веществ в растворах их смесей.
Материальное обеспечение
Кондуктометр.
Магнитная мешалка.
Мерная колба на 250 мл.
Мерная пипетка на 25 мл.
Мерный цилиндр на 25 мл.
Мерная бюретка, 0-25 мл.
Стаканчик для титрования.
Промывалки с дистиллированной водой.
Фильтровальная бумага.
Раствор щелочи с установленной концентрацией.
Раствор с неизвестным содержанием соляной кислоты и хлорида аммония.
Полученный раствор-задачу доводят в мерной колбе до метки дистиллированной водой. Содержимое тщательно перемешивают.
В стаканчик для титрования помещают пипеткой аликвотную часть исследуемого раствора. Сюда же добавляют 20 –25 мл дистиллированной воды (уменьшение влияния разбавления) и погружают кондуктометрическую ячейку в анализируемый раствор, включают мешалку и отмечают показания прибора. Титруют раствором гидроксида натрия или калия с известной концентрацией.
Проводят как минимум три параллельных титрования. После проведения каждого титрования ячейку рекомендуется отмыть дистиллированной водой.
По полученным данным строят кривую титрования в координатах: удельная электропроводность раствора - объем добавленного титранта. По кривой титрования рассчитывают величины эквивалентных объемов раствора щелочи, пошедших на титрование соляной кислоты и хлорида аммония соответственно.
Массу (г) соляной кислоты и хлорида аммония, содержащуюся в исследуемом растворе находят по формулам.
m(HCl) = С(OH–)V1(OH–)M(HCl)Vк10-3/ Vп,
m(NH4Cl) = С(OH–)[V2(OH–) – V1(OH–)]M(NH4Cl)Vк10-3/ Vп,
где С(OH–) – молярная концентрация раствора гидроксида натрия или калия, моль/л;
V1(OH–) – эквивалентный объем раствора гидроксида натрия или калия, пошедший на титрование соляной кислоты, мл;
[V2(OH–) – V1(OH–)] – эквивалентный объем раствора щелочи, пошедший на титрование хлорида аммония, мл;
M(HCl) – молярная масса соляной кислоты, г/моль;
M(NH4Cl) – молярная масса хлорида аммония, г/моль;
Vк – объем мерной колбы, содержащей исследуемый раствор, мл;
Vп – объем исследуемого раствора, взятый для титрования, мл.
Представьте результаты анализа для доверительной вероятности 0,95.
