
- •Оглавление
- •Введение
- •Глава 1. Механика
- •Кинематика материально точки
- •1.1.2. Движение материальной точки по окружности
- •1.2. Динамика. Энергия и импульс
- •1.2.1. Динамика вращательного движения тела
- •1.3. Законы сохранения в механике
- •1.4. Закон всемирного тяготения. Движение материальной точки в поле силы тяжести Земли
- •1.5. Движение тел в неинерциальных системах отсчета. Силы инерции
- •1.6. Основы специальной теории относительности
- •Глава 2. Молекулярная физика. Термодинамика
- •2.1. Уравнение состояния идеального газа
- •2.2. Изотермический процесс
- •2.3. Изобарный процесс
- •2.4. Изохорный процесс
- •2.5. Барометрическая формула
- •2.6. Первое начало термодинамики. Адиабатный процесс
- •2.7. Второе начало термодинамики. Энтропия
- •2.8. Уравнение Ван-дер-Ваальса
- •Приложение некоторые сведения из разделов математики
Глава 2. Молекулярная физика. Термодинамика
Термодинамика газов – наука, изучающая изменение состояния газа при вариации температуры. Из свойства газов известно, что газ занимает весь предоставленный ему объем, за исключением тяжелых газов. Например, элегаз (фторид серы VI – SF6) можно переливать, как воду из стакана в стакан. Название этот газ получил ввиду его высоких изоляционных (диэлектрических) свойств, и используется как заполнитель в высоковольтных переключателях.
2.1. Уравнение состояния идеального газа
В термодинамике газов вводится абстракция – идеальный газ. В классической физической литературе – газ называют идеальным, если его молекулы летают от стенки до стенки сосуда не взаимодействуя между собой, или их взаимодействия абсолютно упругие. Если из этого определения убрать вторую часть о взаимодействии молекул, поскольку это утверждение определяет отсутствие диссипации энергии межмолекулярных взаимодействий, то можно определение идеального газа переписать в виде: идеальным газом называется такой газ – молекулы которого летают от стенки, до стенки не взаимодействуя между собой. При этом, молекулы газа считаются материальными точками. Исходя из этой аксиомы, можно записать закон Больцмана, который является прямым определением кинетической энергии поступательного движения частицы под действием температуры:
|
(50) |
где
k – коэффициент
пропорциональности между энергией и
температурой (T),
называемый постоянной Больцмана. При
этом температура измеряется в абсолютных
единицах (![]() ).
Закон Больцмана определяет энергию
элементарного теплового поступательного
движения вдоль одной координаты (энергию
теплового выброса), которая, в рамках
модели идеального газа, прямо
пропорциональна абсолютной температуре.
В рамках теплового закона Больцмана,
постулируется, что при нулевой температуре
колебаний молекул не будет, хотя, как
показывает квантовая механика, при
нулевой температуре существует некоторая
нулевая частота колебаний атомов и
молекул. Поэтому из четырех состояний
вещества (твердое, жидкое, газообразное
и плазма) в рамках модели идеального
газа не осуществимо только конденсированное
состояние вещества (жидкость).
).
Закон Больцмана определяет энергию
элементарного теплового поступательного
движения вдоль одной координаты (энергию
теплового выброса), которая, в рамках
модели идеального газа, прямо
пропорциональна абсолютной температуре.
В рамках теплового закона Больцмана,
постулируется, что при нулевой температуре
колебаний молекул не будет, хотя, как
показывает квантовая механика, при
нулевой температуре существует некоторая
нулевая частота колебаний атомов и
молекул. Поэтому из четырех состояний
вещества (твердое, жидкое, газообразное
и плазма) в рамках модели идеального
газа не осуществимо только конденсированное
состояние вещества (жидкость).
На
сегодняшний день в ряде стран, для
определения температуры атмосферы,
принята шакала Цельсия. За нуль градусов
Цельсия (0 оС)
принята температура замерзания чистой
воды над уровнем моря и за 100 оС – температура
кипения воды над уровнем моря. Абсолютная
температура измеряется в градусах
Кельвина. Один градус Кельвина равен
градусу Цельсия, переводное соотношение
![]() .
К сожалению, данная шкала температур
неудобна, поскольку в результате точных
расчетов переводное соотношение
подправилось до 273,15. Поэтому, на
сегодняшний день в точных термодинамических
расчетах температуру измеряют в
энергетических единицах. Для инженерных
расчетов достаточно использовать
вышеприведенное соотношение.
.
К сожалению, данная шкала температур
неудобна, поскольку в результате точных
расчетов переводное соотношение
подправилось до 273,15. Поэтому, на
сегодняшний день в точных термодинамических
расчетах температуру измеряют в
энергетических единицах. Для инженерных
расчетов достаточно использовать
вышеприведенное соотношение.
Если
представить одну молекулу идеального
газа в объеме параллелепипеда, летающую
от стенки до стенки длиной l
и площадью стенок S
под действием температуры, то работа
внешних постоянных сил температуры по
формуле (11):
![]() ,
с другой стороны эта работа равна (50):
,
с другой стороны эта работа равна (50):
|
(51) |
Если
в (51) подставить вместо силы давление
этой силы по определению
![]() и учесть что объем сосуда равен
и учесть что объем сосуда равен
![]() ,
получим универсальное уравнение,
связывающее все характеристики одной
молекулы газа, а именно: давление, объем
и температуру:
,
получим универсальное уравнение,
связывающее все характеристики одной
молекулы газа, а именно: давление, объем
и температуру:
|
(52) |
Уравнение (52) называют уравнением состояния, поскольку в него входят все характеристики газа.
Как известно из корпускулярной химии 1 Моль любого вещества содержит определенное число молекул называемое постоянной Авогадро NA. тогда уравнение (52) для одного моля идеального газа примет вид:
|
|
Произведение
двух констант постоянной Больцмана и
Авогадро называют универсальной газовой
постоянной
![]() .
И для любого количества вещества
идеального газа, уравнение состояния
перепишется в виде:
.
И для любого количества вещества
идеального газа, уравнение состояния
перепишется в виде:
|
(53) |
где m – масса газа в сосуде, Mr – его молекулярная масса. Уравнение (53) называют уравнением состояния идеального газа или уравнением Менделеева–Клайперона.
Уравнения состояния идеального газа применимо к реальным газам только при приближении их к идеальным – разряженный газ при температуре много выше температуры кипения.
Размерность
давления – [P] – ![]() – Па.
Наряду с единицами давления в паскалях
в технике применяются единицы – атмосфера
(техническая и физическая), миллиметр
ртутного столба и миллиметр водного
столбы или Торр. Одна техническая
атмосфера – давление в один
килограмм на один квадратный сантиметр
(1 ат=1 кгс/см2=0,981∙105 Па).
Одна физическая атмосфера – нормальное
давление атмосферы Земли над уровнем
моря 760 миллиметров ртутного столба
(1 атм=760 мм рт. ст.==1,013∙105 Па).
Переводные коэффициенты в паскали
следующие: 1 мм рт. ст.=133 Па
и 1 мм вод. ст.=1 Торр=9,8 Па.
Давление в атмосферах применяют для
высоких давлениях (сосуды с жатым газом),
а давление в Торрах и миллиметрах
ртутного столба – для малых величин
давлений (разряженные газы и вакуум).
– Па.
Наряду с единицами давления в паскалях
в технике применяются единицы – атмосфера
(техническая и физическая), миллиметр
ртутного столба и миллиметр водного
столбы или Торр. Одна техническая
атмосфера – давление в один
килограмм на один квадратный сантиметр
(1 ат=1 кгс/см2=0,981∙105 Па).
Одна физическая атмосфера – нормальное
давление атмосферы Земли над уровнем
моря 760 миллиметров ртутного столба
(1 атм=760 мм рт. ст.==1,013∙105 Па).
Переводные коэффициенты в паскали
следующие: 1 мм рт. ст.=133 Па
и 1 мм вод. ст.=1 Торр=9,8 Па.
Давление в атмосферах применяют для
высоких давлениях (сосуды с жатым газом),
а давление в Торрах и миллиметрах
ртутного столба – для малых величин
давлений (разряженные газы и вакуум).
Прямыми следствиями из вывода уравнения состояния являются следующие законы:
1. Давление смеси газов равняется сумме давлений компонентов смеси.
2. Идеальный газ при любой положительной температуре только существует в газообразном состоянии.
3. Один моль любого идеального газа при постоянной температуре и давлении занимает постоянный объем.
Газ совершает работу при условии изменении его объема. Работу газа можно определить исходя из (11) заменой координаты и силы через давление и объем, аналогично выводу уравнения Менделеева–Клайперона:
|
(54) |
где V1 и V2 – начальные и конечные объемы.
Для
анализа состояния газа при вариации
функций состояния строят зависимости
![]() ,
которые называют диаграммой состояния.
Наиболее информативной считается
диаграмма состояния давление – объем,
поскольку согласно (54) площадь под кривой
равна работе при изменеии объема газа.
,
которые называют диаграммой состояния.
Наиболее информативной считается
диаграмма состояния давление – объем,
поскольку согласно (54) площадь под кривой
равна работе при изменеии объема газа.
Проанализируем уравнение состояния идеального газа при постоянном количестве вещества и одной постоянной функцией состояния (давление, объем и температура). Такие состояния идеального газа называются изопроцессами.
Изотермическим называется процесс, проводимый над газом, при постоянном количестве вещества и постоянной температуре.
Изобарным называется процесс, проводимый над газом, при постоянном количестве вещества и постоянном давлении.
Изохорным называется процесс, проводимый над газом, при постоянном количестве вещества и постоянном объеме.

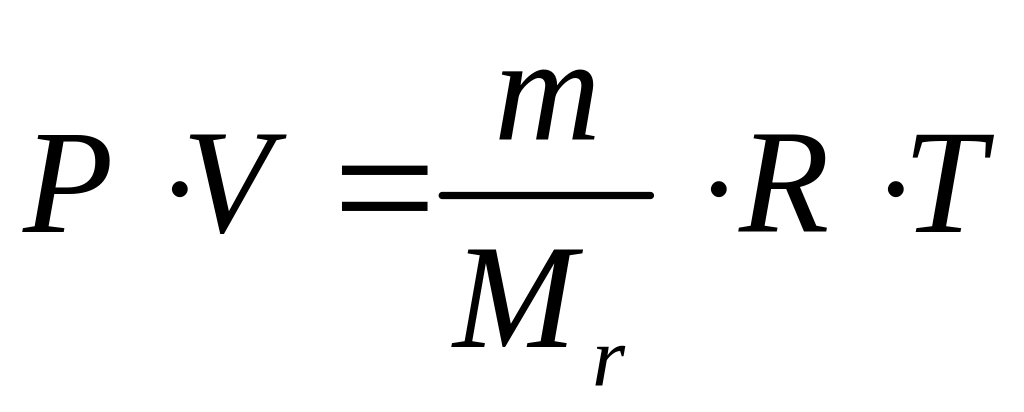 .
.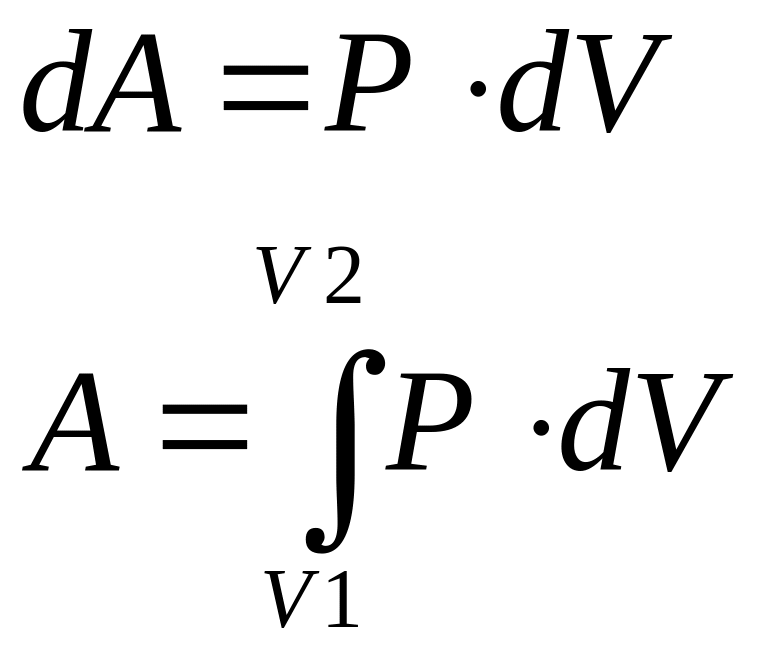 ,
,