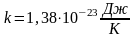- •8. Наведіть порівняння, які дозволяють уявити, наскільки молекули є численними.
- •13. Як пов’язані відносна молекулярна і молярна маса
- •17. Експериментальні факти, що підтверджують взаємодію між молекулами:
- •23. Твердий стан речовини
- •24. Рідкий стан речовини
- •25. Газоподібний стан речовини
- •37. Зв’язок між тиском і температурою ідеального газу
- •40. Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
- •42. Універсальна газова стала
- •47. Графіки ізотермічного процесу – ізотерми.
- •50. Графіки ізобарного процесу – ізобари
- •53. Графіки ізохорного процесу – ізохори
23. Твердий стан речовини
Молекули й атоми твердих тіл розташовані в певному строгому порядку дуже близько одна від одної. Вони так міцно зв’язані між собою, що можуть лише коливатися біля положень рівноваги в яких рівнодійна сил міжмолекулярної взаємодії притягання і відштовхування рівна нулю. Тому тверді тіла зберігають свою форму і об’єм.
24. Рідкий стан речовини
У рідинах зберігається тільки ближній порядок у розташуванні молекул і взаємодія між молекулами слабша, ніж у твердих тілах, але все ж таки вона є доволі сильною, тому молекули втримуються одна біля одної і як наслідок рідини зберігають свій об’єм. Відстань між молекулами більша ніж в твердих тілах і взаємодія між молекулами не настільки велика як в твердих тілах, тому молекули рідини не тільки здійснюють коливальний рух біля положень рівноваги, але й час від часу можуть перепригувати з одного положення в інше, саме цим пояснюється головна властивість рідини – текучість, тобто здатність текти і не зберігати свою форму.
25. Газоподібний стан речовини
У газах відстані між молекулами у тисячі разів більші, ніж у рідинах, відповідно відсутній будь-який порядок у розташуванні молекул газу. Молекули газів вільно рухаються, здійснюючи безладний тепловий рух і переміщуються на значні відстані, тому що молекули слабко притягуються одна до одної. Як наслідок гази не зберігають ні форми ні об’єму.
26. Ідеальний газ – це газ, в якому молекули можна вважати матеріальними точками, а силами притягання й відштовхування між молекулами можна знехтувати.Це модель МКТ, тобто в природі ідеального газу не існує. Реальний газ набуває властивостей ідеального при значному розрідженні, коли середня відстань між молекулами набагато більша за їх розміри.
27. Макроскопічні параметри ідеального газу – це параметри, які характеризують систему як одне ціле і їх можна безпосередньо виміряти: тиск, об’єм, температура, густина
28. Мікроскопічні параметри ідеального газу – це параметри, які характеризують систему з точки зору її внутрішноьї будови, тобто параметри які характеризують окремо взяту молекулу газу: маса, швидкість молекул, їх кінетична енергія.
29. Тиск газу спричинений ударами об стінку посудини великої кількості молекул, які передають їй свій імпульс.
30. Середня
квадратична швидкість
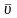 - величина, що визначається як
квадратний корінь середнього значення
квадрату швидкості молекул
- величина, що визначається як
квадратний корінь середнього значення
квадрату швидкості молекул
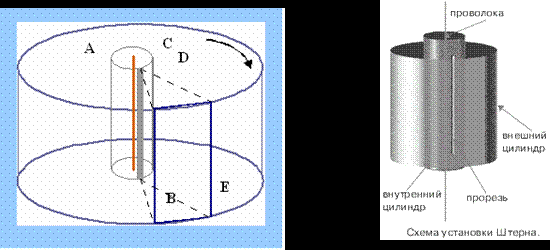
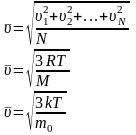
31. Визначення
швидкості руху молекул газу вперше
здійснив у 1920 році німецький фізик Отто
Штерн. Прилад складався з двох жорстко
з’єднаних коаксіальних циліндрів, по
осі яких натягувалася покрита сріблом
платинова дротина. Внутрішній циліндр
А мав дуже вузький проріз (щілину) вздовж
твірної. У приладі створювався високий
вакуум. Платинова дротина нагрівалась
електричним струмом і при досить високій
температурі з поверхні дротини
випаровувалось срібло. Всередині
внутрішнього циліндра утворювався
одноатомний газ срібла. Частина атомів
срібла потрапляли через щілину у простір
між циліндрами і осідала на поверхні
зовнішнього циліндра, утворюючи шар у
вигляді вузької смужки, ширина якої
приблизно дорівнювала ширині щілини.
Якщо привести циліндри в обертання з
кутовою швидкістю
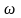 , то за час
, то за час
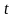 , поки молекула пролетить відстань від
внутрішнього циліндра до зовнішнього,
циліндри повернуться на деякий кут
, поки молекула пролетить відстань від
внутрішнього циліндра до зовнішнього,
циліндри повернуться на деякий кут
 і молекула потрапить не в те місце, куди
потрапляла при нерухомих циліндрах, а
зміститься на деяку відстань
і молекула потрапить не в те місце, куди
потрапляла при нерухомих циліндрах, а
зміститься на деяку відстань
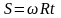 (див. рис.)
(див. рис.)
тоді швидкість руху молеку

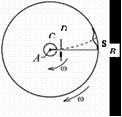
32. Основне рівняння МКТ встановлює зв’язок між мікроскопічним та макроскопічними параметрами системи.

Якщо скористатись
формулами для густини речовини
та для середньої кінетичної енергії
руху молекул
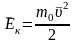 , то останнє рівняння можна переписати
наступним чином:
, то останнє рівняння можна переписати
наступним чином:
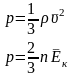
33. Теплова рівновага – стан при якому всі тіла мають однакову температуру. З часом будь-яка система переходить стан теплової рівноваги.
34. Температура
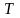 – фізична величина, що є мірою
середньої кінетичної енергії руху
атомів і молекул речовини; величина. Що
характеризує ступінь нагрітості тіла.
– фізична величина, що є мірою
середньої кінетичної енергії руху
атомів і молекул речовини; величина. Що
характеризує ступінь нагрітості тіла.
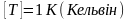
Температура є макроскопічним параметром термодинамічної системи, оскільки характеризує середньостатистичне значення кінетичної енергії молекул.
35. Зв’язок
між середньою кінетичною енергії руху
атомів і молекул речовини
 та її температурою
:
та її температурою
:

36. Стала
Больцмана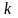 - фізична величина, що показує на
скільки зміниться середня кінетична
енергія молекули речовини при зміні її
температури на 1К
- фізична величина, що показує на
скільки зміниться середня кінетична
енергія молекули речовини при зміні її
температури на 1К