
- •8. Наведіть порівняння, які дозволяють уявити, наскільки молекули є численними.
- •13. Як пов’язані відносна молекулярна і молярна маса
- •17. Експериментальні факти, що підтверджують взаємодію між молекулами:
- •23. Твердий стан речовини
- •24. Рідкий стан речовини
- •25. Газоподібний стан речовини
- •37. Зв’язок між тиском і температурою ідеального газу
- •40. Співвідношення, що визначають зв’язок між температурним шкалами Цельсія і Кельвіна
- •42. Універсальна газова стала
- •47. Графіки ізотермічного процесу – ізотерми.
- •50. Графіки ізобарного процесу – ізобари
- •53. Графіки ізохорного процесу – ізохори
ОСНОВИ МОЛЕКУЛЯРНО – КІНЕТИЧНОЇ ТЕОРІЇ
1. Молекулярно – кінетична теорія (МКТ ) будови речовини – це теорія, яка пов’язує перебіг теплових явищ з особливостями внутрішньої будови речовини і вивчає причини, що зумовлюють тепловий рух. Вона пояснює теплові властивості твердих тіл, рідин і газів на основі теплового руху мікрочастинок, з яких вони складаються.
2. Основні положення МКТ будови речовини:
a) Речовина складається з мікрочастинок – атомів, молекул, іонів тощо.
b) Ці мікрочастинки перебувають у безперервному хаотичному русі й взаємодіють між собою.
3. Приклади фізичних явищ, які є непрямим доказом існування атомів і молекул:
a) Закон постійних відношень мас в хімічних реакціях
b) Броунівський рух – тепловий рух завислих в рідині або газі маленьких частинок речовини
c) Явище дифузії – взаємне проникнення речовин одна в одну. Дифузія широко застосовується в практичному житті людиною: фарбування тканин, соління овочів і т. д.
4. Які вимірювання треба провести, щоб оцінити розміри молекули маслинового масла?
Якщо пустити краплину олії (її об’єм відомий) на поверхню чистої води, то вона розпливеться, утворюючи тонку плівку, яка складається з одного шару молекул. Вимірявши площу утвореної плівки, можна визначити її товщину, тобто діаметр молекул.
5. Яким є порядок діаметра атома? Наведіть порівняння, які дозволяють уявити, наскільки молекули (атоми) є малими.
Сучасні методи
вимірювання дають змогу визначити
розміри молекул і атомів, які приблизно
однакові для молекул кожної речовини
і мають той самий порядок
 .
.
Молекули і атоми настільки малі, що уявити їх розміри модна тільки порівнянням. Так, атом заліза у стільки разів менший за волоський горіх, у скільки горіх менший за Місяць. Якщо збільшити молекулу води до розмірів головки шпильки, то сама головка за такого самого збільшення була б більша за найвищу гору Землі – Джомолунгму.
6. Відносна
атомна маса речовини
 - відношення маси атома
- відношення маси атома
 даної речовини до
даної речовини до
 маси атома вуглецю
маси атома вуглецю
 :
:

Відносна атомна маса вимірюється в атомних одиницях маси
7. Атомна одиниця маси – дорівнює маси атома вуглецю . Експериментально встановлено,що

8. Наведіть порівняння, які дозволяють уявити, наскільки молекули є численними.
В 1 г води міститься
 молекул. Це число величезне. Воно
незмірно більше за кількість склянок
води, яка міститься у всіх морях, океанах,
річках.
молекул. Це число величезне. Воно
незмірно більше за кількість склянок
води, яка міститься у всіх морях, океанах,
річках.
9. Кількість
речовини –
це відношення кількості молекул у
даному тілі до кількості атомів
 в 0,012 кг вуглецю С-12.
в 0,012 кг вуглецю С-12.

Кількість речовини
можна також визначити відношенням маси
тіла
 до молярної
до молярної
маси речовини з
якої воно виготовлене

10. 1 моль – це така кількість речовини , яка містить стільки само атомів, молекул чи інших структурних елементів, скільки атомів міститься в 0,012кг вуглецю С-12.
Очевидно, що в 1 молі будь-якої речовини міститься однакова кількість атомів і молекул.
11. Стала Авогадро - кількість атомів і молекул, що міститься в 1 молі будь-якої речовини.

12. Молярна маса – це маса 1моля речовини.
Щоб визначити молярну масу достатньо масу молекули речовини помножити на сталу Авогадро

13. Як пов’язані відносна молекулярна і молярна маса

14. Густина
 – фізична величина, що дорівнює масі
речовини в одиниці об’єму і визначається
відношенням маси тіла до його об’єму
– фізична величина, що дорівнює масі
речовини в одиниці об’єму і визначається
відношенням маси тіла до його об’єму
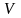 .
.

Густину речовини
можна визначити якщо масу її молекули
 помножити на
помножити на
Концентрацію
 речовини
речовини

15.Концентрація
-
фізична величина, що показує яка кількість
молекул міститься в одиниці
об’єму речовини, і визначається
відношенням кількості молекул в тілі до
його об’єму
до
його об’єму
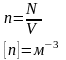
16. Фізичні явища, що є доказом взаємодії молекул: виникнення сил пружності внаслідок деформації тіла.
17. Експериментальні факти, що підтверджують взаємодію між молекулами:
a) Два свинцеві відполіровані циліндри при стискуванні злипаються настільки сильно, що витримують підвішування до них тягаря в декілька кілограмів;
b) Утворення на різальних інструментах «наросту» металу, який ріжеться;
c) Виготовлення деталей методом порошкової металургії:
d) Якщо заповненні полу свинцеву кулю водою і заварити її, а потім почати стискати, то вода почне просочуватись крізь стінки кулі.
18. Природа сил міжмолекулярної взаємодії: електромагнітна природа.
19. Відстані
на яких проявляються сили міжмолекулярної
взаємодії:
вони короткодіючі і суттєво залежать
від відстані між молекулами ( сили
притягання
 , сили відштовхування
, сили відштовхування
 ). Сила взаємодії практично відсутня,
коли молекули знаходяться на відстанях,
що в кілька разів перевищують їх розміри.
). Сила взаємодії практично відсутня,
коли молекули знаходяться на відстанях,
що в кілька разів перевищують їх розміри.
20. Графік
залежності сил міжмолекулярної
 взаємодії
двох молекул від відстані між цими
молекулами. Залежність
сил взаємодії молекул F
від відстані між ними можна зобразити
графічно, вважаючи сили відштовхування
додатними, а сили притягання — від'ємними.
Нехай одна з молекул знаходиться в
початку координат, а друга — на деякій
відстані г, від неї. Між ними діє дуже
мала сила взаємного притягання і ще
менша сила відштовхування. В міру
зближення молекул спочатку швидше
зростає сила притягання, а потім — сила
відштовхування. На відстані r0, що
становить приблизно суму радіусів
молекул, сила притягання дорівнює силі
відштовхування. Ця відстань OВ = г0
відповідає положенню стійкої рівноваги
молекул і називається рівноважною.
При дальшому зближенні молекул (r < r0)
сила відштовхування переважає силу
притягання. На графіку показано також
залежність рівнодійної сил взаємодії
двох частинок від відстані між ними. Ця
сила дорівнює алгебраїчній сумі сил
відштовхування і притягання. Кожна
ордината кривої взаємодії, яка відповідає
будь-якій відстані r, є результатом
алгебраїчного додавання ординат двох
перших кривих. Крива зміни сили взаємодії
молекул показує, що при відстанях між
частинками r > r0 переважають сили
взаємного притягання, а при r < r0 — сили
відштовхування. Це пояснює виникнення
сил пружності під час деформації тіл.
взаємодії
двох молекул від відстані між цими
молекулами. Залежність
сил взаємодії молекул F
від відстані між ними можна зобразити
графічно, вважаючи сили відштовхування
додатними, а сили притягання — від'ємними.
Нехай одна з молекул знаходиться в
початку координат, а друга — на деякій
відстані г, від неї. Між ними діє дуже
мала сила взаємного притягання і ще
менша сила відштовхування. В міру
зближення молекул спочатку швидше
зростає сила притягання, а потім — сила
відштовхування. На відстані r0, що
становить приблизно суму радіусів
молекул, сила притягання дорівнює силі
відштовхування. Ця відстань OВ = г0
відповідає положенню стійкої рівноваги
молекул і називається рівноважною.
При дальшому зближенні молекул (r < r0)
сила відштовхування переважає силу
притягання. На графіку показано також
залежність рівнодійної сил взаємодії
двох частинок від відстані між ними. Ця
сила дорівнює алгебраїчній сумі сил
відштовхування і притягання. Кожна
ордината кривої взаємодії, яка відповідає
будь-якій відстані r, є результатом
алгебраїчного додавання ординат двох
перших кривих. Крива зміни сили взаємодії
молекул показує, що при відстанях між
частинками r > r0 переважають сили
взаємного притягання, а при r < r0 — сили
відштовхування. Це пояснює виникнення
сил пружності під час деформації тіл.
21. Основні агрегатні стани речовини: твердий, рідкий і газоподібний.
22. Фазовий перехід речовини у фізиці означає таку трансформацію внутрішньої структури речовин, при якій відбувається різкий стрибок певної фізичної характеристики системи, викликаний малою зміною іншої характеристики. Розрізняють фазові переходи першого і другого роду.
Різні фази тієї самої речовини можуть знаходитися у рівновазі, стикаючись одна з одною. Подібна рівновага спостерігається лише в обмеженому інтервалі температур.
Температури, при яких речовина переходить з однієї фази у іншу називають температурою переходу (перетворення).
Загалом розрізняють три температури переходу, які залежать від тиску (перша – найменше)
а) температура плавлення;
б) температура пароутворення;
в) температура сублімації (возгонки).
За умови, що зовнішній тиск є нормальним (760 мм.рт.ст.) і залишається сталим говорять про:
а) точку плавлення при переході з твердої фази у рідку або про точку затвердіння для зворотного переходу;
б) точку кипіння при переході рідини у газ (пару) або про точку зрідження (конденсації) для зворотного переходу;
в) точку сублімації (возгонки) при переході тіла у газоподібний стан (в деяких випадках такий перехід можливий за нормального тиску).
Перехід речовини з однієї фази в іншу супроводжується поглинанням або виділенням енергії, яка називається теплотою фазового перетворення. Переходи, які супроводжуються поглинанням або виділенням теплоти, називають фазовими переходами першого роду. Під час фазових переходів речовини першого роду змінюється порядок розташування молекул в речовині, характер їх руху та сили міжмолекулярної взаємодії.
