
- •Зав. Кафедрой физики ___________ д.М. Левин
- •Зав. Кафедрой физики ___________ д.М. Левин
- •1. Цели и задачи практических занятий:
- •2. План занятий.
- •3. Темы занятий.
- •Занятие 1. Кинематика поступательного и вращательного движения. Тангенциальное и нормальное ускорение, радиус кривизны.
- •Прямая задача кинематики
- •Обратная задача кинематики
- •Кинематика вращательного движения.
- •Связь линейных и угловых величин в кинематике.
- •Качественные задачи.
- •Задачи для самостоятельной работы.
- •Занятие 2 Динамика поступательного и вращательного движения.
- •Качественные задачи.
- •З адачи для самостоятельной работы.
- •Занятие 3 Законы сохранения импульса, момента импульса и механической энергии
- •Качественные задачи.
- •Задачи для самостоятельной работы.
- •Занятие 4 Механические колебания: собственные незатухающие и затухаюшие, вынужденные.
- •Задачи для самостоятельной работы.
- •Занятие 5 Идеальный газ: уравнение состояния, работа, внутренняя энергия, теплоемкость. Первое начало термодинамики.
- •Качественные задачи
- •Задачи для самостоятельной работы.
- •Занятие 6 Второе начало термодинамики. Кпд тепловой машины. Распределения Максвелла и Больцмана.
- •Качественные задачи
- •Задачи для самостоятельной работы.
Задачи для самостоятельной работы.
4![]() .1с.
Тонкий однородный стержень массы m
= 2 кг и длины l =
1,5 м подвешен на горизонтальной
оси, проходящей перпендикулярно стержню
через его конец. К нижнему концу
прикрепили небольшой свинцовый шарик
такой же массы m.
Найдите частоту малых колебаний такого
маятника. Трением в оси пренебречь.
Принять g = 10 м/с2.
Ответ: 0,534 Гц
.1с.
Тонкий однородный стержень массы m
= 2 кг и длины l =
1,5 м подвешен на горизонтальной
оси, проходящей перпендикулярно стержню
через его конец. К нижнему концу
прикрепили небольшой свинцовый шарик
такой же массы m.
Найдите частоту малых колебаний такого
маятника. Трением в оси пренебречь.
Принять g = 10 м/с2.
Ответ: 0,534 Гц
4.2с. Грузик
массой m = 100 г
прикреплен к пружине жесткости k
= 200 Н/м и совершает незатухающие
гармонические колебания в горизонтальной
плоскости с амплитудой А = 2 мм. В
начальный момент грузик находился в
крайнем положении. За какое время он
пройдет путь, равный
![]() ?
?
4.3с. Тонкий однородный стержень длины l = 50 см и массы m 100 г совершает гармонические незатухающие колебания под действием силы тяжести относительно горизонтальной оси, перпендикулярной стержню и проходящей через его конец. В положении равновесия стержень имеет угловую скорость = 0,5 рад/с. Найдите максимальный угол (в радианах), на который отклоняется стержень в процессе движения. g = 10 м/с2.
4.4с.
Грузик массы m 200 г
совершает собственные затухающие
колебания на пружинке жесткости k
=100 Н/м по закону
![]() см. Найдите логарифмический декремент
затухания.
см. Найдите логарифмический декремент
затухания.
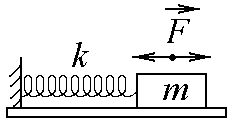 4.5с.
Невесомая пружинка жесткости k
= 10 Н/м одним концом прикреплена к
стене, а другим – к бруску массы m
= 50 г, лежащему на горизонтальной
поверхности. Вдоль поверхности на брусок
действует гармоническая сила
4.5с.
Невесомая пружинка жесткости k
= 10 Н/м одним концом прикреплена к
стене, а другим – к бруску массы m
= 50 г, лежащему на горизонтальной
поверхности. Вдоль поверхности на брусок
действует гармоническая сила
![]() Н. Найдите амплитуду вынужденных
колебаний бруска. Диссипативные силы
в системе отсутствуют. Собственными
колебаниями пренебречь.
Н. Найдите амплитуду вынужденных
колебаний бруска. Диссипативные силы
в системе отсутствуют. Собственными
колебаниями пренебречь.
Занятие 5 Идеальный газ: уравнение состояния, работа, внутренняя энергия, теплоемкость. Первое начало термодинамики.
Идеальный газ это модель, в которой принимаются следующие упрощения:
1) суммарным объемом всех молекул можно пренебречь по сравнению с объемом сосуда;
2) молекулы взаимодействуют только при соударениях друг с другом и со стеной сосуда, но взаимодействием молекул на расстоянии можно пренебречь.
Уравнение
состояния идеального газа
(Менделеева-Клапейрона) связывает три
макропараметра термодинамической
системы (газа) – давление
![]() ,
объем
,
объем
![]() и абсолютную температуру
,
измеряемую в Кельвинах:
и абсолютную температуру
,
измеряемую в Кельвинах: ![]() , (5.1)
, (5.1)
где
![]() – количество вещества или число молей,
– масса газа в сосуде,
– количество вещества или число молей,
– масса газа в сосуде,
![]() – молярная масса газа.
– молярная масса газа.
Абсолютная
температура является мерой средней
кинетической энергии молекулы: ![]() (5.2)
(5.2)
где
![]() =
=![]() – число степеней свободы молекулы газа
или число независимых координат, с
помощью которых можно описать положение
молекулы в пространстве, причем
– число степеней свободы молекулы газа
или число независимых координат, с
помощью которых можно описать положение
молекулы в пространстве, причем
![]() – число поступательных степеней свободы,
– число поступательных степеней свободы,
![]() – число вращательных степеней свободы,
– число вращательных степеней свободы,
![]() – число колебательных степеней свободы,
– число колебательных степеней свободы,
![]() Дж/К – постоянная Больцмана. Для жестких
молекул, у которых не возбуждены
колебательные степени свободы, существует
всего три значения
:
Дж/К – постоянная Больцмана. Для жестких
молекул, у которых не возбуждены
колебательные степени свободы, существует
всего три значения
:
для
одноатомных молекул
![]() ;
;
для
двухатомных молекул;
![]() ;
;
для
трех- и более атомных молекул
![]() .
.
Внутренняя
энергия идеального газа это
суммарная кинетическая энергия всех
молекул: ![]() , (5.3)
, (5.3)
Примерами
одноатомных молекул могут быть молекулы
таких газов, как гелий
![]() ,
неон
,
неон
![]() ,
аргон
,
аргон
![]() ,
криптон
,
криптон
![]() ,
ксенон
,
ксенон
![]() –
благородные газы. Двухатомные молекулы
у молекулярного водорода
–
благородные газы. Двухатомные молекулы
у молекулярного водорода
![]() ,
кислорода
,
кислорода
![]() ,
азота
,
азота
![]() .
Трехатомные молекулы у углекислого
газа
.
Трехатомные молекулы у углекислого
газа
![]() ,
водяного пара
,
водяного пара
![]() ,
озона
,
озона
![]() .
Многоатомные молекулы у метана
.
Многоатомные молекулы у метана
![]() ,
этилового спирта (этанола)
,
этилового спирта (этанола)
![]() и т.д.
и т.д.
Если изменять объем газа, то газ при этом совершает работу:
![]() . (5.4)
. (5.4)
Из (5.4) видно, что работа газа при расширении положительная, а при сжатии – отрицательная. Если объем газа не менятся (изохорический процесс), то газ работу не совершает.
Первое
начало термодинамики: тепло, данное
газу, идет на изменение внутренней
энергии газа и на совершение газом
работы над внешними телами. ![]() , (5.5)
, (5.5)
где
![]() – изменение внутренней энергии идеального
газа,
– изменение внутренней энергии идеального
газа,
![]() – элементарная работа газа при изменении
объема на малую величину
– элементарная работа газа при изменении
объема на малую величину
![]() .
.
Теплоемкостью газа называется величина, характеризующая количество тепла, необходимое для нагревания всего газа на 1 К.
![]() (5.6)
(5.6)
В
зависимости от способа изменения
состояния газа, теплоемкость может
принимать разные значения и даже может
быть функцией температуры
![]() .
Если теплоемкость газа является
постоянной величиной
.
Если теплоемкость газа является
постоянной величиной
![]() ,
то такой поцесс называется политропическим.
,
то такой поцесс называется политропическим.
В качестве примера политропического процесса можно привести изохорический процесс с теплоемкостью
![]() , (5.7)
, (5.7)
изобарический процесс с теплоемкостью
![]() (5.8)
(5.8)
Из
(5.6) следует, что при известной зависимости
![]() можно найти тепло
можно найти тепло
![]() ,
необходимое для нагревания газа от
тепературы
,
необходимое для нагревания газа от
тепературы
![]() до
до
![]() :
:
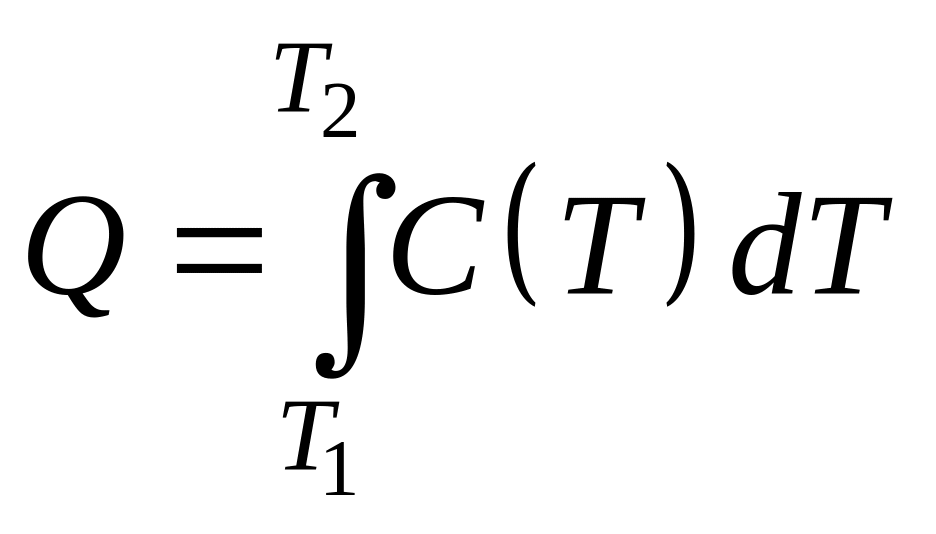 (5.9)
(5.9)
5.1. Сколько тепла надо сообщить m = 220 г углекислого газа, чтобы при неизменной температуре t 0 = 27 0 С расширить его в e2 = (2,72)2 раз? Ответ: Q = 24,93 кДж.
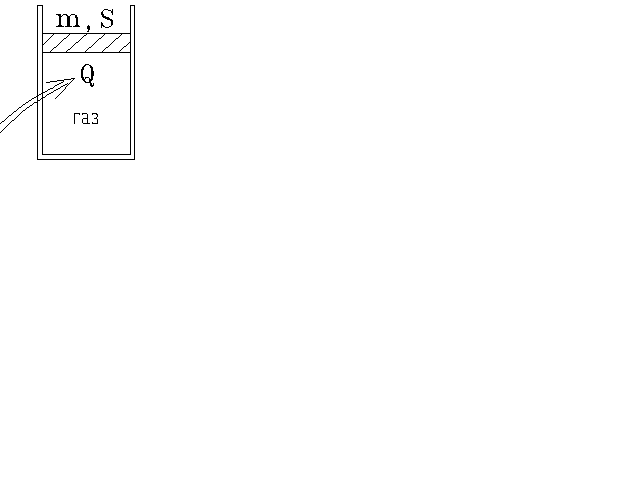 5.2.
Идеальный одноатомный газ в количестве
4 моль находится в сосуде под незакреплённым
поршнем массы m = 1 кг и
площади S = 0,1 м 2 .
Газу сообщено тепло Q =
1001 Дж. На какую высоту h
поднялся поршень?
5.2.
Идеальный одноатомный газ в количестве
4 моль находится в сосуде под незакреплённым
поршнем массы m = 1 кг и
площади S = 0,1 м 2 .
Газу сообщено тепло Q =
1001 Дж. На какую высоту h
поднялся поршень?
Атмосферное давление p а = 10 5 Па , g = 10 м/с 2 .
Ответ:
![]()
5.3.
Какую работу надо совершить над m
= 16 г кислорода, чтобы очень быстро
(адиабатически) охладить его на
![]() ?
(415,5 Дж.)
?
(415,5 Дж.)
5.4.
Некоторое количество идеального
газа имело объём 1 л и давление 105
Па. Какую работу совершает этот газ,
расширяясь до вдвое большего объёма в
процессе T/V
2 = const? Ответ:
![]() .
.
5.5.
Один моль идеального газа совершает
процесс
![]() ,
где b = const.
Чему равна теплоемкость газа в этом
процессе? (
,
где b = const.
Чему равна теплоемкость газа в этом
процессе? (![]() )
)
5.6. Теплоемкость
одного моля идеального одноатомного
газа зависит от температуры по закону
![]() ,
где
,
где
![]() Дж/К,
Дж/К,
![]() К.
К.
Найти
работу, совершенную газом, при изменении
температуры газа от
![]() до
до
![]() К.
Универсальная газовая постоянная R
= 8,3 Дж/мольК;
К.
Универсальная газовая постоянная R
= 8,3 Дж/мольК;
Ответ: –2334 Дж
