
- •Зав. Кафедрой физики ___________ д.М. Левин
- •Зав. Кафедрой физики ___________ д.М. Левин
- •1. Цели и задачи практических занятий:
- •2. План занятий.
- •3. Темы занятий.
- •Занятие 1. Кинематика поступательного и вращательного движения. Тангенциальное и нормальное ускорение, радиус кривизны.
- •Прямая задача кинематики
- •Обратная задача кинематики
- •Кинематика вращательного движения.
- •Связь линейных и угловых величин в кинематике.
- •Качественные задачи.
- •Задачи для самостоятельной работы.
- •Занятие 2 Динамика поступательного и вращательного движения.
- •Качественные задачи.
- •З адачи для самостоятельной работы.
- •Занятие 3 Законы сохранения импульса, момента импульса и механической энергии
- •Качественные задачи.
- •Задачи для самостоятельной работы.
- •Занятие 4 Механические колебания: собственные незатухающие и затухаюшие, вынужденные.
- •Задачи для самостоятельной работы.
- •Занятие 5 Идеальный газ: уравнение состояния, работа, внутренняя энергия, теплоемкость. Первое начало термодинамики.
- •Качественные задачи
- •Задачи для самостоятельной работы.
- •Занятие 6 Второе начало термодинамики. Кпд тепловой машины. Распределения Максвелла и Больцмана.
- •Качественные задачи
- •Задачи для самостоятельной работы.
Занятие 6 Второе начало термодинамики. Кпд тепловой машины. Распределения Максвелла и Больцмана.
Изучая
процесс превращения теплоты в работу,
Р.Клаузиус в 1865 г ввел понятие энтропии
![]() ,
которое определил через ее приращение
,
которое определил через ее приращение
![]() :
:
![]() , (6.1)
, (6.1)
где
![]() – бесконечно малое приращение тепла,
полученное термодинамической системой
при данной температуре.
– бесконечно малое приращение тепла,
полученное термодинамической системой
при данной температуре.
Энтропия – функция состояния системы. Если известен явный вид зависимости энтропии от термодинамических параметров (температуры, давления, объема), то из (6.1) можно рассчитать количество тепла, полученное системой в заданном процессе:
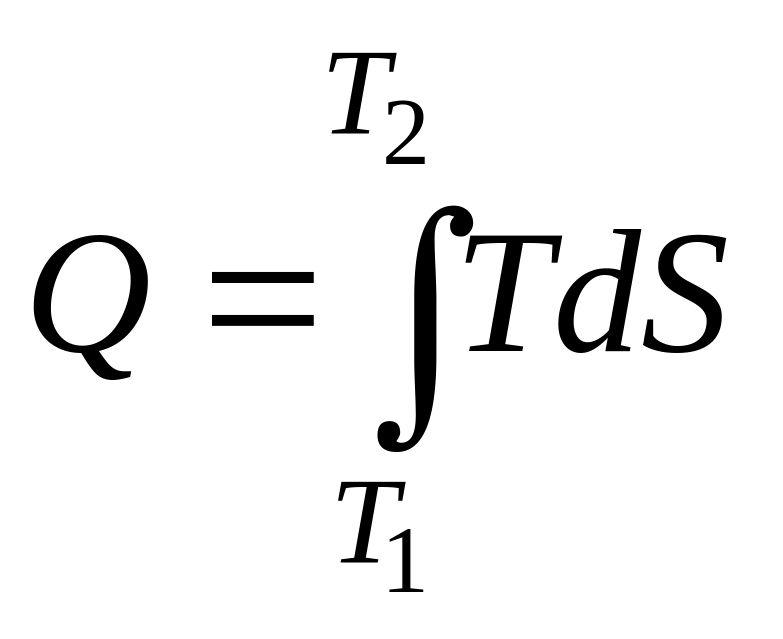 (6.2)
(6.2)
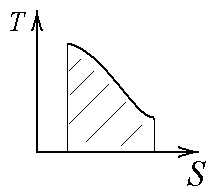
Если
дана зависимость температуры от энтропии
в виде графика, то теплота, полученная
газом определяется, как площадь под
кривой
![]() (см. рис.).
(см. рис.).
Теормодинамическую систему, совершающую циклический процесс и совершающую работу за счет получения тепла от нагревателя, называют тепловой машиной. Характерным параметром тепловой машины является коэффициент полезного действия:
![]() или
или
![]() . (6.3)
. (6.3)
где
![]() – работа, совершенная машиной за цикл.
Чтобы тепловая машина могла работать
непрерывно, она должна совершать
циклический процесс, получая некоторую
порцию тепла от нагревателя
– работа, совершенная машиной за цикл.
Чтобы тепловая машина могла работать
непрерывно, она должна совершать
циклический процесс, получая некоторую
порцию тепла от нагревателя
![]() и обязательно отдать часть тепла
холодильнику
и обязательно отдать часть тепла
холодильнику
![]() .
Нагревателем и холодильником могут
служить более нагретое тело с температурой
.
Нагревателем и холодильником могут
служить более нагретое тело с температурой
![]() (печь) и менее нагретое с температурой
(печь) и менее нагретое с температурой
![]() (холодная вода), с которыми по очереди
контактирует рабочее тело (например
газ в цилиндре под поршнем).
(холодная вода), с которыми по очереди
контактирует рабочее тело (например
газ в цилиндре под поршнем).
Самый большой КПД при одинаковых и будет у тепловой машины, работающей по циклу Карно, состоящего из двух изотерм и двух адиабат. Такую машину называют идеальной тепловой машиной и ее КПД
![]() (6.4)
(6.4)
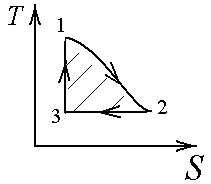 Если
рабочий цикл тепловой машины изображен
графически в виде замкнутой фигуры в
координатах
,
то работа газа за цикл будет равна
площади этой фигуры (см. рис. цикл
1-2-3-1). Тепло, полученное от нагревателя,
находится при этом как площадь под
кривой 1-2, где энтропия возрастает (на
участке 2-3 тепло отдается холодильнику).
Если
рабочий цикл тепловой машины изображен
графически в виде замкнутой фигуры в
координатах
,
то работа газа за цикл будет равна
площади этой фигуры (см. рис. цикл
1-2-3-1). Тепло, полученное от нагревателя,
находится при этом как площадь под
кривой 1-2, где энтропия возрастает (на
участке 2-3 тепло отдается холодильнику).
Продолжателем
идей Р.Клаузиуса в молекулярно-кинетической
теории газов, в которую тот ввел элементы
теории вероятности, был Д.К.Максвелл,
получивший функцию распределения
молекул идеального газа по модулям их
скоростей
![]() :
:
![]() ,
(6.5)
,
(6.5)
где
![]() – постоянная Больцмана;
– постоянная Больцмана;
![]() – масса одной молекулы. С помощью этой
функции можно рассчитать относительную
долю молекул, обладающих скоростями в
диапазоне от
до
– масса одной молекулы. С помощью этой
функции можно рассчитать относительную
долю молекул, обладающих скоростями в
диапазоне от
до
![]() .
.
![]() . (6.6)
. (6.6)
Интегрируя
выражение (6.6), можно убедиться, что
относительная доля молекул, обладающих
скоростями в бесконечном диапазоне
скоростей, равна 1: ![]() (6.7)
(6.7)
Рис.6.1.
Распределение Максвелла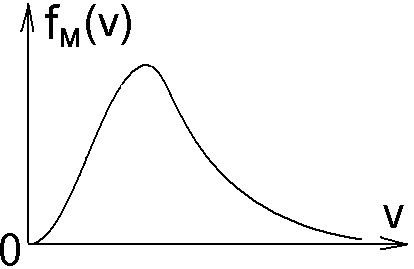
![]() ,
(6.8)
,
(6.8)
где – универсальная газовая постоянная; – молярная масса газа.
Анализируя формулы (6.8) и (6.7) можно прийти к выводу, что при увеличении температуры положение максимума функции распределения смещается вправо по оси скоростей, но при этом площадь под кривой не меняется и равна всегда 1.
Кроме средней вероятной скорости (6.8) в молекулярно-кинетической теории используется понятие средней скорости
![]() (6.9)
(6.9)
и среднеквадратичной скорости
![]() . (6.10)
. (6.10)
Используя
распределение Максвелла по проекциям
скоростей, можно найти число ударов
молекул
![]() в единицу времени
в единицу времени
![]() (частоту ударов) о поверхность
единичной площади
(частоту ударов) о поверхность
единичной площади
![]() (6.11)
(6.11)
и среднюю длину свободного пробега молекулы
![]() , (6.12)
, (6.12)
где
![]() – концентрация молекул газа,
– концентрация молекул газа,
![]() – эффективное сечение молекулы,
– эффективное сечение молекулы,
![]() – эффективный диаметр молекулы.
– эффективный диаметр молекулы.
Кроме
распределения Максвелла по скоростям
молекул (6.5) необходимо упомянуть
распределение Больцмана по высоте
молекул в равновесном
изотермическом
столбе газа (например в изотермической
модели атмосферы): ![]() , (6.13)
, (6.13)
где
![]() и
и
![]() – концентрации молекул газа на высоте
от поверхности Земли и на нулевой высоте
соответственно,
– молярная масса газа,
– ускорение свободного падения, которое
считается постоянным в пределах всего
столба газа,
– абсолютная температура, постоянная
по всему столбу газа.
– концентрации молекул газа на высоте
от поверхности Земли и на нулевой высоте
соответственно,
– молярная масса газа,
– ускорение свободного падения, которое
считается постоянным в пределах всего
столба газа,
– абсолютная температура, постоянная
по всему столбу газа.
Формула для давления газа
![]() (6.14)
(6.14)
в
сочетании с (6.13) позволяет определить
давление газа на разных высотах в
изотермической равновесной атмосфере
или барометрическую
формулу:
![]() (6.15)
(6.15)
Необходимо учесть тот факт, что давление атмосферы около поверхности Земли не зависит от температуры, так как масса всего воздуха в атмосфере, который своим весом давит на площадь Земли, не меняется ни зимой, ни летом.
6.1.
Два моля азота сначала изобарически
нагревают в два раза, а затем изотермически
сжимают в два раза. Найти суммарное
изменение энтропии в этих двух процессах.
Ответ:
![]()
6.2. Теплоёмкость термодинамической системы (не идеального газа) в некотором процессе изменяется с температурой по закону C = b/T2 , где b = 800 кДж . К. Найти изменение энтропии системы в этом процессе при её нагревании от T 1 = 100 K до T 2 = 200 K.
Ответ:
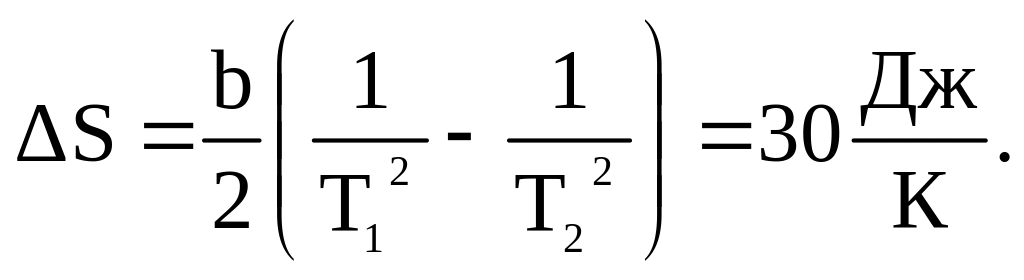
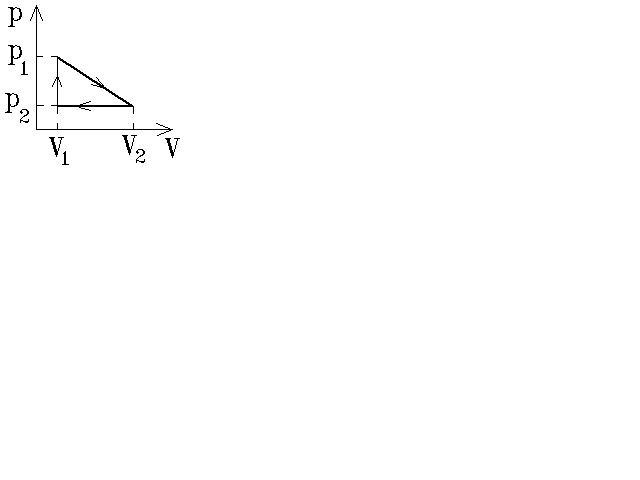 6.3.
Идеальный трёхатомный газ совершает
циклический процесс, изображённый на
диаграмме, где p 1
= 3p 2 , V
2 = 5V 1 . Найти
к.п.д. этого процесса.
6.3.
Идеальный трёхатомный газ совершает
циклический процесс, изображённый на
диаграмме, где p 1
= 3p 2 , V
2 = 5V 1 . Найти
к.п.д. этого процесса.
Ответ:
![]()
6.4.
К.п.д. циклического процесса, изображённого
на T – S –
диаграмме, равен
![]() Найти температуру T1,
если T3 = 300 К, а T
2 = 350 К.
Найти температуру T1,
если T3 = 300 К, а T
2 = 350 К.
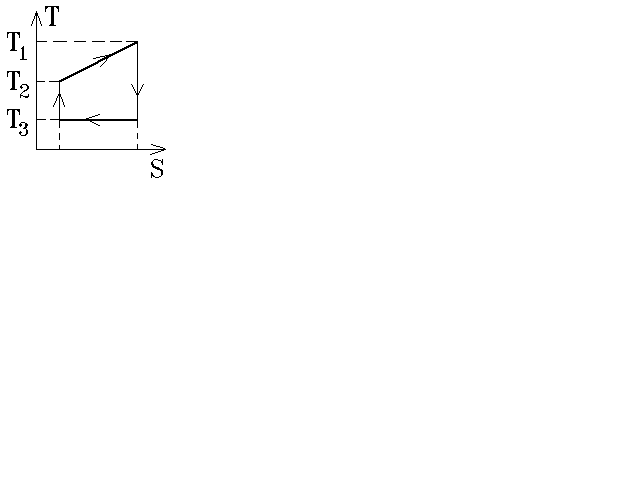 Ответ:
T1 = 400 K.
Ответ:
T1 = 400 K.
6.5.
Идеальный газ находился в закрытом
сосуде, а средняя квадратичная скорость
молекул была равна
![]() .
Потом газ был нагрет так, что средняя
вероятная скорость молекул стала равна
.
Потом газ был нагрет так, что средняя
вероятная скорость молекул стала равна
![]() .
=500
м/с;
=450
м/с. Найти: отношение частоты ударов
молекул о единичную площадку в первом
и во втором состояниях
.
=500
м/с;
=450
м/с. Найти: отношение частоты ударов
молекул о единичную площадку в первом
и во втором состояниях
![]() .
.
