
- •Лекция 3 качественный анализ
- •Окрашивание пламени соединениями некоторых элементов
- •Приемы и техника выполнения реакций
- •Классификация аналитических реакций
- •Классификация аналитических реагентов
- •2. Образование (мешающими ионами) соединений, препятствующих наблюдению аналитического сигнала.
- •3. Вероятность проведения аналитической реакции открытия невелика, например, в результате связывания реагента мешающими ионами. Устранение мешающих ионов в качественном анализе
- •1. Изменение кислотности среды
- •2. Окисление или восстановление мешающих ионов
- •3. Комплексообразование
- •4. Экстракция
- •5. Осаждение
- •Анализ индивидуального вещества
- •Создать условия протекания частной реакции;
- •Устранить мешающее влияние сопутствующих компонентов;
- •Зарегистрировать аналитический сигнал.
- •Обнаружить некоторые катионы.
- •2. Обнаружение окислителей и восстановителей.
- •Сульфидная (сероводородная) классификация
- •Связь сульфидной классификации катионов с электронной конфигурацией атомов и ионов
- •Кислотно-основная классификация
- •Связь кислотно-основной классификации катионов с электронной конфигурацией атомов и ионов
- •Классификация анионов
- •Классификация анионов
- •Первая группа анионов
- •Вторая группа анионов
- •Третья группа анионов
- •Качественные реакции на катионы и анионы
- •Катионы
Лекция 3 качественный анализ
Качественным анализом называется определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе.
При этом утверждение об отсутствии данного компонента («не обнаружен») подразумевает, что его содержание ниже некоторого предела. Таким образом, деление на качественный и количественный (определяющий содержание компонента) анализ в определенной степени условно.
Основная задача качественного химического анализа – установление состава анализируемого вещества.
Качественный анализ можно проводить с помощью физических, химических и физико-химических методов.
Аналитическая реакция – химическое превращение анализируемого вещества при действии аналитического реагента с образованием продуктов с заметными аналитическими признаками. В качестве аналитических реакций чаще всего используют реакции образования окрашенных соединений; выделение или растворение осадков, газов; образование соединений, люминесцирующих в растворах.
Аналитические признаки – такие свойства анализируемого вещества или продуктов его превращения (цвет, запах, угол вращения плоскости поляризации света и т. д.), которые позволяют судить о наличии в нем тех или иных компонентов.
ТРЕБОВАНИЯ К АНАЛИТИЧЕСКИМ РЕАКЦИЯМ И РЕАКТИВАМ
Те вещества, которые используют для проведения аналитических реакций, называют реактивами или реагентами. Используемые реактивы должны быть правильно приготовлены и правильно храниться. Нельзя использовать загрязненные реактивы.
По степени чистоты выделяют следующие категории реактивов:
особой чистоты (оч),
химически чистые (хч),
чистые для анализа (чда),
чистые (ч),
очищенные (очищ),
технические (техн).
Чистота реактивов определяется ГОСТами и техническими условиями. Для целей анализа обычно используют реактивы с марками чда и хч. В зависимости от состава принято выделять неорганические и органические реактивы.
Наиболее широко в качественном анализе применяют реакции, проходящие в растворах, т. е. выполняемые мокрым путем. Из большего числа реакций, в которые вступают ионы, для аналитических целей служат только некоторые, удовлетворяющие следующим требованиям.
1. Наличие легко наблюдаемого внешнего эффекта:
а) Появление, изменение, исчезновение окраски раствора (цветные реакции),
например Fe3+ -ионы образуют с тиоцианатом соединение кроваво-красного цвета;
или Mn2+ → MnO4- → MnO42- .
б/цв. фиолетовый зеленый
б) образование осадка,
например Ва2+-ионы образуют с дихроматом калия желтый осадок хромата бария;
в) растворение осадка,
например гидротартрат калия растворим в горячей воде, сильных кислотах и щелочах;
или Hg2+ + 2J− →↓HgJ2; HgJ2 + 2KJ− → K2[HgJ4].
красный б/цв.
г) выделение газа, например сульфиты под действием минеральных кислот выделяют SO2, имеющий запах горящей серы.
SO32- + 2H+ → SO2↑+ H2O
д) Реакции образования кристаллов строго определенной формы (микрокристаллоскопические реакции)
б)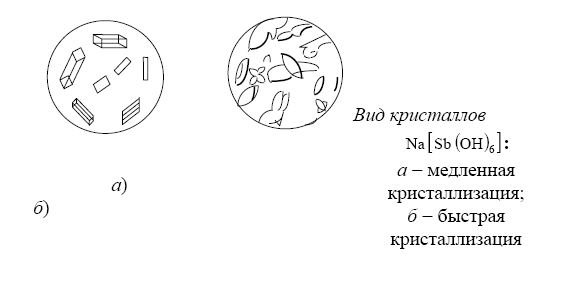

е) Реакции окрашивания пламени.
Таблица 1
