
- •Рибосомы
- •Эндоплазматическая сеть
- •Комплекс Гольджи
- •Функции комплекса Гольджи:
- •Аппарат внутриклеточного переваривания: эндосомы и лизосомы
- •Эндосомы
- •Пероксисомы
- •Энергетический аппарат клетки: митохондрии
- •Цитоскелет
- •Микротрубочки
- •Клеточный центр (цитоцентр)
- •Реснички и жгутики
- •Микрофиламенты
- •Функции микрофиламентов:
- •Промежуточные филаменты
- •Классы промежуточных филаментов и их идентификация.
- •Микротрабекулы
- •Включения
- •Ядро клетки
- •Ядерная оболочка
- •Ядрышко
- •Гибель клеток
- •Структурно-функциональные изменения клеток при некрозе
- •Значение апоптоза в развитии тканей и механизмах тканевого гомеостаза у человека
Гибель клеток
Число клеток в организме, органах и тканях регулируется гомеостатическими механизмами и определяется динамическим равновесием образованием клеток путем пролиферации и их гибелью. Поэтому гибель клеток, наряду с их размножением и дифференцировкой, является одним из ключевых процессов и факторов в обеспечении нормальной жизнедеятельности различных тканей. При гибели клеток могут наблюдаться два вида морфологических изменений, которые соответствуют различным механизмам ее развития – некроз и апоптоз.
Некроз (от греч. nekrosis - умирание) возникает под действием резко выраженных повреждающих факторов – перегревания (гипертермии), переохлаждения (гипотермии), недостатка кислорода (гипоксии), нарушения кровоснабжения (ишемии), метаболических ядов, химических препаратов, механической травмы и др. Некроз представляет собой "смерть в результате несчастного случая" и часто охватывает различные по численности группы клеток.
Структурно-функциональные изменения клеток при некрозе
на начальных этапах его развития проявляются набуханием цитоплазмы и отдельных органелл (в особенности, митохондрий). Отмечается дисперсия рибосом, расширение цистерн ЭПС. Эти морфологические изменения обусловлены нарушением избирательной проницаемости плазмолеммы и развиваются в ответ на прекращение деятельности мембранных ионных насосов (из-за непосредственного повреждения мембраны или вследствие отсутствия необходимой энергии). Повышение концентрации Са2+ в гиалоплазме вызывает активацию связанных с мембраной фосфолипаз, которые разрушают мембранные фосфолипиды и взывают обширные повреждения мембран. Разрушение клеточных структур резко укоряется на поздних стадиях некроза после выделения гидролаз и других ферментов из поврежденных лизосом.
Изменения ядра при некрозе связаны с расщеплением ядерной ДНК лизосомальной ДНКазой на фрагменты различной длины (без какой-либо закономерности). Первоначально гетерохроматин конденсируется в виде крупных глыбок под кариолеммой, однако он не образует четко очерченных скоплений полулунной формы, которые характерны для ядер клеток, подвергающихся апоптозу (см. ниже). В дальнейшем ядро уменьшается, уплотняется (явление кариопикноза – от греч. karyon – ядро и pycnosis – уплотнение), распадается (подвергается кариорексису от греч. karyon – ядро и rexis – разрыв) и лизируется (явление кариолизиса – от греч. karyon - ядро и lysis – разрыв).
Поздние явления при некрозе включают разрыв ядерной оболочки плазмолеммы и мембран органелл, разрушение и растворение ядра утрату базофилии набухшей цитоплазмой, исчезновение клеточных границ и распад клетки.
Для некроза, в отличие от апоптоза не являющегося активным процессом (см. ниже), не требуется продолжающейся синтетической активности клетки, он не сопровождается активацией путей внутриклеточной сигнализации. Продукты распада клеток попадают в межклеточные пространства, привлекают лейкоциты и макрофаги, фагоцитирующие клеточный детрит. Фагоциты, в свою очередь, выделяют разнообразные вещества, которые обусловливают активацию и приток различных клеток вследствие хемотаксиса. Описанным образом развивается и в течение определенного времени поддерживается воспалительная реакция на продукты разрушения клеток при их некрозе.
Апоптоз – физиологическая (запрограммированная) гибель клеток.
Апоптоз (от греч. apoptosis – листопад) – «смерть клетки в результате самоубийства (самоуничтожения)» – активный, генетически контролируемый процесс клеточной гибели, регулируемый внутренней программой, которая запускается внешними факторами. Развитие апоптоза индуцируется особыми генами (киллерными генами), которые обеспечивают синтез ряда веществ, обусловливающих разрушение клетки. Обнаружены также "гены-спасители", экспрессия которых противодействует развертыванию программы апоптоза (наиболее изученным ингибитором апоптоза служит ген bcl-2).
Апоптоз представляет собой энергоемкий процесс и сопровождается активацией сигнальных систем в клетке. Он обычно происходит асинхронно в отдельных клетках или мелких клеточных группах, разделенных численно превосходящими жизнеспособными клетками. Апоптоз наблюдается в различных тканях человека и животных в норме, патологии, эмбриональном развитии и у взрослого.
Сигналы, запускающие генетическую программу апоптоза, обладают специфичностью для клеток различных тканей. К наиболее общим индуцирующим сигналам относятся:
(1) Нарушение баланса регуляторных воздействий, поддерживающих нормальную дифференцировку и функциональную активность клеток, например, вследствие дефицита стимулирующих факторов (гормонов, факторов роста, некоторых цитокинов), потери контакта с другими клетками или компонентами межклеточного вещества и др. К этой же категории сигналов, вероятно, относятся и те, что возникают в клетке при ее естественном старении;
(2) Воздействие физиологических активаторов (индукторов) апоптоза . ФНО (фактора некроза опухолей), ИФНγ (интерферона-γ ), ТФР β(трансформирующего фактора роста-β), молекулы Fas, глюкокортикоидов некоторых интерлейкинов. Этот эффект тканеспецифичен: некоторые из указанных веществ в клетках одних тканей индуцируют апоптоз, тогда как в других являются его ингибиторами (факторами выживания).
(3) Воздействие разнообразных повреждающих физических и химических факторов (гипертермии, гипоксии, оксидантов, токсинов, ишемии, облучения) умеренных по интенсивности, которые при большей интенсивности приводят к развитию некроза. Причиной апоптоза обычно служат вызываемые действием указанных факторов неустранимые повреждения ДНК (см. выше) или резкие метаболические сдвиги;
(4) Некоторые инфекции, в особенности, вирусные.
Структурно-функциональные изменения клеток при апоптозе. На наиболее ранних этапах развития апоптоза до возникновения структурных изменений в клетках в их цитоплазме в течение латентного периода длительностью до 12 ч происходит синтез ферментов, которые необходимы для осуществления гибели клетки. Эту стадию, однако, проходит большее число клеток, нежели погибает в конечном итоге, так как часть из них выживает благодаря "спасению" в результате активации особых "генов-спасителей" и действия специфических трофических факторов.
Наиболее ранним морфологическим проявлением апоптоза, выявляемым на электронно-микроскопическом уровне, служит утрата клетками специализированных структур на их поверхности (например, микроворсинок и межклеточных соединений), их отделение от соседних (рис. 3-24). Развитие апоптоза морфологически на светооптическом уровне также проявляется уплотнением ядра (в котором накапливаются крупные глыбки хроматина), конденсацией цитоплазмы, которая уплотняется, сморщивается и уменьшается в размерах (отчего апоптоз был назван также "сморщивающим некрозом" – shrinkage necrosis в англо-язычной литературе). Уплотнение цитоплазмы приводит ко все более компактному расположению органелл, которые при апоптозе, в отличие от некроза, сохраняют свою целостность.
Изменения в ядре при апоптозе обусловлены активацией эндогенной Са2+/Мg2+-зависимой эндонуклеазы, что приводит к упорядоченному расщеплению геномной ДНК в межнуклеосомных участках на отдельные нуклеосомные сегменты. Хроматин укладывается в ядре в виде крупных полулуний, после чего ядро распадается на фрагменты, окруженные мембраной. Таким образом, в отличие от некроза, изменения ядра при апоптозе включают только кариопикноз и своеобразный кариорексис (без разрушения кариолеммы); кариолизис отсутствует.
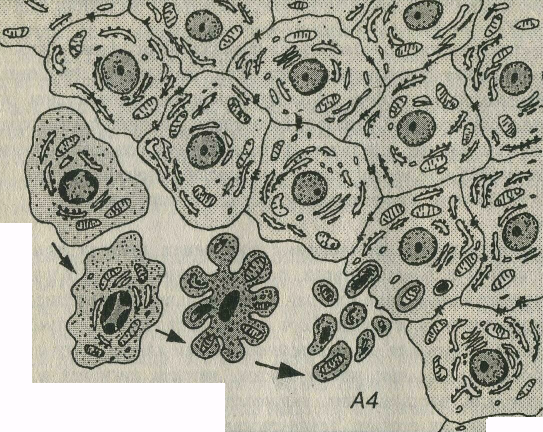
Рис. 3-24. Морфологические изменения клеток при апоптозе. А1-А4 - клетки на последовательных стадиях апоптоза: А1 - начало апоптоза - утрата клеткой соединений с соседними интактными клетками и ее отделение от них; А2 - сжатие и уплотнение цитоплазмы и ядра, изменение формы клетки, распределение гетерохроматина в виде полулуний под кариолеммой; АЗ - нарастающее сжатие и уплотнение клетки, образование вздутий и выростов на ее поверхности, кариопикноз; А4 - распад клетки на фрагменты, окруженные плазмолеммой (апоптозные тела) и их фагоцитоз соседними интактными клетками.
При прогрессировании апоптоза нарастающая конденсация цитоплазмы сочетается с изменением формы клетки – она образует многочисленные крупные вздутия и выпячивания (поверхность клетки при этом как бы "вскипает"), а также "кратеры" (по-видимому, в участках слияния с плазмолеммой пузырьков, образующихся из цистерн грЭПС).
Образование и удаление апоптозных тел. Вьшячивания, содержащие жизнеспособные органеллы, а также фрагменты ядра, отшнуровываются, формируя крупные окруженные мембраной фрагменты округлой или овальной формы - апоптозные тела. Образование апоптозных тел связано с преобразованиями цитоскелета: в частности, перешнуровка цитоплазмы происходит с участием пучков актиновых микрофиламентов, разрушение которых блокирует ход апоптоза. Число и размеры образующихся клеточных фрагментов (апоптозных тел) варьируют в широких пределах и обычно тем значительнее, чем крупнее разрушающаяся клетка. В некоторых случаях клетка сморщивается целиком, превращаясь в одно сферическое апоптозное тело. Апоптозные тела быстро захватываются соседними клетками посредством фагоцитоза перевариваются ими. Некоторые тела могут разрушаться внеклеточно, другие же поглощаются местными фагоцитами. Нейтрофилы в фагоцитозе апоптозных тел не участвуют, воспалительная реакция отсутствует.
Процесс апоптоза развивается сравнительно быстро и обычно длится от нескольких минут до нескольких часов (в среднем, морфологачески регистрируемые его стадии – от начала конденсации хроматина до полного переваривания апоптозных тел, занимают 1-3 ч).
Биохимические процессы при апоптозе. Сигнал, запускающий апоптоз, инициирует внутриклеточную каталитическую реакцию, которая включает ряд этапов:
(1) передачу сигнала в клеточное ядро (обеспечивается различными механизмами, опосредованными ионами Са2+, фосфолипазой, тирозинкиназой, протеинкиназами А и С, цАМФ, сфирингомиелином/церамидом и др. молекулами),
(2) активацию "летальных", или "киллерных" генов, ответственных за развертывание программы апоптоза,
(3) включение процессов транскрипции и трансляции (в результате которых осуществляется синтез апоптоз-специфических белков),
(4) активацию ряда ферментных систем, вызывающих необратимые изменения в ядре и цитоплазме клетки.
Деятельность указанных ферментных систем на заключительном этапе биохимических преобразований при апоптозе генетически контролируется и координируется, разворачиваясь в определенном порядке. К наиболее важным ферментным системам относят (в порядке их активации):
(1) цистеиновые протеазы семейства ICE (сокращенное название от англ. IL-1 Converting Enzyme - фермент, конвертирующнй ИЛ-1), представляющие собой протеолитическую каскадную аутокаталитичес-ую систему, а также ICE-подобные протеазы;
(2) гранзимы (сериновые протеазы);
(3) эндонуклеазы, обусловливающие фрагментацию ДНК в участках между нуклеосомами с формированием цепей ДНК стандартной длины. Эта реакция, развивающаяся еще до протеолиза гистонов и других ядерных белков, настолько специфична, что ее используют в качестве маркера процесса апоптоза.
